Det har tradisjonelt vært et aksiom i akuttmedisinen at ca. 80 % av alle tilfeller med plutselig hjertestans skyldes akutt eller kronisk koronarsykdom. Dette tallet gjengis i de fleste eldre lærebøker. Nyere epidemiologiske data og registerstudier tyder imidlertid på at andelen i dag ligger nærmere 60 %. Dette avviket mellom tradisjonelle oppfatninger og nyere realiteter skyldes primært den betydelige nedgangen i forekomsten av alvorlige akutte koronarsyndromer og bedre primærprevensjon de siste tiårene. I tillegg har implementeringen av rask revaskularisering ved akutt koronarsyndrom (STEMI, NSTEMI, ustabil angina) økt overlevelsen og redusert forekomsten av sene arytmiske komplikasjoner og hjertestans (Jerkeman et al.).
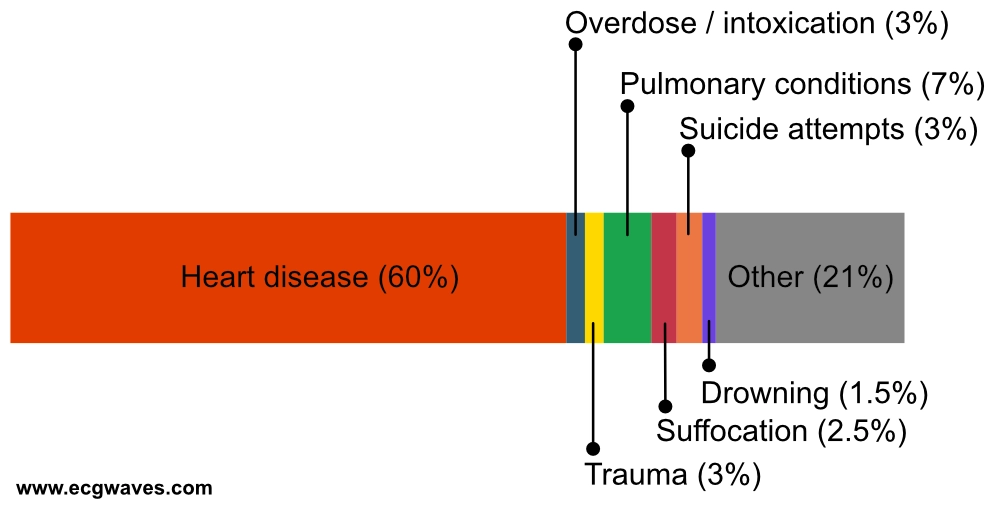
Det er ofte utfordrende å fastslå den eksakte årsaken til en hjertestans utenfor sykehus (OHCA). Obduksjon er sterkt anbefalt når den underliggende årsaken er ukjent, særlig hos personer under 40 år, for å avdekke potensielt arvelige tilstander som kan få konsekvenser for slektninger. Dessverre blir obduksjon ofte ikke utført, dels grunnet kostnader og dels grunnet logistikk. Usikkerheten rundt etiologi gjenspeiles i klassifiseringssystemet anbefalt av Utstein-retningslinjene (tabell 1). Disse brede kategoriene er nødvendige for å kunne systematisere data fra den prehospitale fasen, hvor diagnostiske muligheter er begrensede (Perkins et al.). Figur 1 viser data fra det svenske hjertestansregisteret, som skiller ut kardiale etiologier som en dominerende gruppe.
| Årsak | Definisjon |
|---|---|
| Medisinsk årsak | Omfatter hjertestans forårsaket av hjertesykdom, andre indremedisinske tilstander (lungeemboli, gastrointestinal blødning, intrakraniell blødning/hjerneslag, elektrolyttforstyrrelser osv.) samt tilfeller der årsaken ikke faller inn under de andre kategoriene. |
| Traumer | Hjertestans forårsaket av stump eller penetrerende vold, trafikkulykker, fall, brannskader eller andre fysiske traumer. |
| Drukning | Hjertestans sekundært til hypoksi ved drukning. |
| Elektrokusjon | Hjertestans utløst av elektrisk strøm gjennom thorax (som induserer VF/asystoli) eller lynnedslag. |
| Asfyksi | Asfyksi som følge av ytre årsaker, for eksempel fremmedlegeme i luftveiene, henging eller kvelning. |
| Overdose / Intoksikasjon | Tilsiktet eller utilsiktet overdosering av legemidler (f.eks. opioider, trisykliske antidepressiva), narkotika eller andre toksiske stoffer som forårsaker arytmi eller respirasjonsstans. |
Kardial etiologi og mekanismer
Hjertestans forårsaket av kardiovaskulære tilstander kan betraktes som stokastiske (tilfeldige) hendelser i den forstand at tidspunktet er vanskelig å forutsi. De aller fleste tilfeller av plutselig hjertedød skyldes maligne ventrikulære arytmier (ventrikkeltakykardi [VT] som degenererer til ventrikkelflimmer [VF]). At forekomsten er stokastisk illustreres ved at det store flertallet av hjerteinfarkt og episoder med myokardiskemi ikke resulterer i hjertestans. Kun en forsvinnende liten andel av iskemiske episoder fører til VF.
Forståelsen av dette fenomenet kan beskrives ved hjelp av Coumels triangel: For at en malign arytmi skal oppstå, kreves ofte en interaksjon mellom tre elementer:
- Et arytmogent substrat (f.eks. arrvev etter infarkt, fibrose, kardiomyopati).
- En trigger (f.eks. ventrikulær ekstrasystole, R-på-T fenomen).
- Modulerende faktorer (f.eks. iskemi, elektrolyttforstyrrelser, autonom ubalanse).
Hjertestans er dermed resultatet av et «perfekt storm-scenario», der disse faktorene sammenfaller. Iskemi, hemodynamikk, det autonome nervesystemet (sympatikusaktivering), elektrolyttkonsentrasjoner (spesielt kalium og magnesium) og genetisk predisposisjon samvirker for å utløse VT eller VF. Mens noen faktorer varierer fra sekund til sekund (f.eks. iskemigrad, autonom tonus), tar andre måneder eller år å utvikle (f.eks. myokardial remodellering og arrdannelse).
Ventrikulære arytmier er lettere å indusere når et arytmogent substrat er tilstede. Et substrat kan defineres som en fysiologisk eller anatomisk forandring som tillater opprettholdelse av arytmier, oftest gjennom mekanismer for hjertearytmier som re-entry. Typiske eksempler er nekrotisk vev eller fibrose som skaper ledningsblokk og langsom ledning, noe som legger til rette for sirkelstrømmer.
Kroniske og akutte koronarsyndromer
Koronarsykdom er fortsatt den dominerende årsaken til plutselig hjertestans i den voksne befolkningen.
- Akutt myokardiskemi kan indusere polymorf ventrikulær takykardi og ventrikkelflimmer ved å endre de elektrofysiologiske egenskapene i myokard (endret refraktærperiode og ledningshastighet). Dette kan inntreffe når som helst i forløpet av koronarsykdom, og er dessverre ofte den første (og siste) manifestasjonen av sykdommen. Mekanismen er ofte funksjonell re-entry rundt den iskemiske sonen.
- Akutt hjerteinfarkt (AMI) medfører risiko for både tidlige og sene arytmier. Risikoen for VT/VF er høyest i den hyperakutte fasen (første minutter til timer). I denne fasen er arytmiene ofte knyttet til iskemi og reperfusjonsskade.
- MINOCA (Myocardial Infarction with Non-Obstructive Coronary Arteries) er en tilstand hvor pasienten oppfyller kriteriene for hjerteinfarkt, men uten obstruktive stenoser ved angiografi. Årsaker kan være spasmer, mikrovaskulær dysfunksjon, eller spontan disseksjon (SCAD). Også disse pasientene har risiko for maligne arytmier.
- Kroniske totale okklusjoner (CTO) er komplette okklusjoner av koronararteriene som har vart i mer enn 3 måneder. Selv om kollateraler perfunderer området, er blodforsyningen sjelden tilstrekkelig under stress (f.eks. takykardi), noe som gir iskemi. I tillegg representerer CTO-området ofte en blanding av viabelt myokard og arrvev, som utgjør et potent substrat for re-entry VT. Nyere studier viser at omtrent 35 % av pasienter med hjertestans utenfor sykehus med sjokkbar rytme har en CTO (Lemkes et al.).
- Iskemisk kardiomyopati refererer til tilstanden hvor koronarsykdom har ført til betydelig svekket venstre ventrikkelfunksjon. Kombinasjonen av redusert ejeksjonsfraksjon (LVEF), omfattende arrvev og potensial for ny iskemi gir en svært høy risiko for plutselig hjertestans. Det er denne gruppen som hyppigst profitterer på profylaktisk implanterbar hjertestarter (ICD).
Det er viktig å merke seg at blant pasienter som overlever en hjertestans, er forekomsten av tidligere gjennomgått hjerteinfarkt (med arrdannelse) betydelig høyere enn akutt hjerteinfarkt. Gamle infarkter med arrvev utgjør substratet for monomorf VT, som kan degenerere til VF. I POST-SCD-studien fant man at akutt koronarsyndrom var årsaken i kun ca. 30 % av tilfellene, mens kronisk koronarsykdom var dominerende (Tseng et al.).
Andre årsaker relatert til koronararteriene
- Medfødte anomalier i koronararteriene
- Anomal avgang av koronararterier (f.eks. venstre hovedstamme fra høyre sinus valsalva) forekommer hos en liten andel av befolkningen, men er en viktig årsak til plutselig død hos unge idrettsutøvere. Mekanismen antas å være kompresjon av arterien mellom aorta og truncus pulmonalis under anstrengelse.
- Myokardbroer (som forekommer hos ca. 1 % av befolkningen, eller flere i obduksjonsstudier) er vanligvis benigne, men kan i sjeldne tilfeller øke risikoen for plutselig hjertestans ved iskemi under anstrengelse (se figur 2).
- Koronare embolier
- Septiske embolier fra endokarditt (aorta- eller mitralklaff).
- Emboli fra tromber i venstre atrium (ved atrieflimmer) eller venstre ventrikkel (etter infarkt).
- Paradokse embolier via patent foramen ovale (PFO).
- Koronararteritt og inflammasjon
- Kawasakis sykdom (koronaraneurismer).
- Systemiske vaskulitter som Polyarteritis nodosa (PAN) eller kjempecellearteritt.
- Spontan koronararteriedisseksjon (SCAD)
- En viktig årsak til ACS og hjertestans hos yngre og middelaldrende kvinner, ofte uten tradisjonelle risikofaktorer.
- Koronarspasmer (Prinzmetals angina) kan forårsake transmural iskemi og maligne arytmier selv uten aterosklerose. Kokainmisbruk er en viktig differensialdiagnose her.

Troponin for differensialdiagnostikk ved hjertestans
Måling av hjertespesifikt Troponin T (TnT) eller I (TnI) er standard ved mottak av pasienter med hjertestans. Den diagnostiske verdien for å påvise akutt koronarokklusjon er imidlertid begrenset i denne settingen. Hjertestans i seg selv, samt gjenopplivingsforsøk (HLR) og eventuelle defibrilleringer, fører til myokardsskade og utslipp av troponiner, uavhengig av om årsaken var et hjerteinfarkt eller ikke.
Studier, inkludert arbeid av Agusala et al., viser at nesten alle pasienter som får gjenopprettet sirkulasjon (ROSC) har forhøyede troponinnivåer. Nivåene skiller dårlig mellom infarkt-relatert hjertestans og andre årsaker (f.eks. lungeemboli, primær arytmi) i akuttfasen. Beslutning om akutt koronarangiografi bør derfor baseres på EKG (ST-elevasjoner), klinisk presentasjon og sannsynlighet for koronar årsak, snarere enn en enkelt troponinverdi.
Hypertrofi og hypertrofisk kardiomyopati
Venstre ventrikkelhypertrofi (LVH) er en sterk prediktor for kardiovaskulær død. Den vanligste årsaken er langvarig hypertensjon. LVH medfører økt muskelmasse, fibrose og endret repolarisering, noe som øker risikoen for arytmier. Samtidig koronarsykdom forsterker denne risikoen ytterligere.
Hypertrofisk Kardiomyopati (HCM)
Hypertrofisk kardiomyopati (HCM) er den vanligste arvelige hjertesykdommen (prevalens 1:500) og kjennetegnes av uforklarlig hypertrofi, ofte asymmetrisk. HCM er en ledende årsak til plutselig død hos unge og idrettsutøvere. Arytmimekanismen er kompleks og involverer myocytt-uorden (disarray), fibrose og iskemi i små kar.
- HOCM (Hypertrofisk Obstruktiv Kardiomyopati): Hos ca. 1/3 foreligger obstruksjon i venstre ventrikkels utløp (LVOT) i hvile, og hos enda flere ved provokasjon. Selv om obstruksjonen gir symptomer, er det arytmiene (VT/VF) som forårsaker plutselig død.
- Risikostratifisering: Det finnes kalkulatorer (f.eks. HCM Risk-SCD) som estimerer 5-års risiko for hjertestans basert på faktorer som synkope, maksimal veggtykkelse, venstre atriediameter og familiehistorie. Høy risiko indikerer behov for ICD.
Kardiomyopatier
Kardiomyopatier representerer strukturelle og funksjonelle sykdommer i myokard som ikke skyldes koronarsykdom, hypertensjon eller klaffefeil. Felles for dem er forekomsten av myokardfibrose som arytmisubstrat.
Dilatert kardiomyopati (DCM)
DCM kjennetegnes av dilatasjon og redusert systolisk funksjon av venstre (og eventuelt høyre) ventrikkel. Omtrent 30-50 % av tilfellene er genetisk betinget. En særlig viktig undergruppe er pasienter med mutasjoner i Lamin A/C-genet. Disse pasientene har svært høy risiko for maligne arytmier og plutselig død, ofte før hjertesvikt symptomene blir alvorlige. Tidlig ICD-implantasjon vurderes ofte hos disse.
Blant pasienter med hjertesvikt med redusert ejeksjonsfraksjon (HFrEF) dør ca. 50 % plutselig, antatt arytmisk død (Packer et al.). Jo lavere EF, desto høyere absolutt risiko, selv om andelen som dør av pumpesvikt øker i sluttstadiet.
Andre kardiomyopatier
- Arytmogen kardiomyopati (ACM/ARVC): Tidligere kalt arytmogen høyre ventrikkel-dysplasi/kardiomyopati. Sykdommen kjennetegnes av at myokard erstattes av fett- og bindevev. Dette skjer typisk i høyre ventrikkel (ARVC), men venstre ventrikkel er også ofte involvert. Pasientene har høy risiko for ventrikulære arytmier, særlig utløst av fysisk anstrengelse. Konkurranseidrett er kontraindisert.
- Restriktiv kardiomyopati (RCM): Sjelden tilstand med stive ventrikkelvegger og alvorlig diastolisk dysfunksjon.
- Peripartum kardiomyopati: Hjertesvikt som oppstår i siste del av svangerskap eller de første mnd etter fødsel. Kan ha et dramatisk forløp med hjertestans, men mange restitueres fullstendig.
Inflammatoriske hjertesykdommer og lagringssykdommer
Myokarditt (hjertemuskelbetennelse) er en viktig årsak til hjertestans hos yngre. Mens viral myokarditt ofte er benign, finnes det mer aggressive former:
- Kjempecellemyokarditt: Sjelden, men svært aggressiv form med høy mortalitet og arytmirisiko.
- Hjertesarkoidose: En granulomatøs sykdom som kan infiltrere myokard. Klinisk presentasjon er ofte ledningsforstyrrelser (AV-blokk) og ventrikulære arytmier. Hjerteinvolvering forekommer hos ca. 20-25 % av pasienter med systemisk sarkoidose. PET-scan og MR er sentrale i diagnostikken.
- Amyloidose: Avleiring av amyloide fibriller (AL eller ATTR). Gir fortykket myokard og økt risiko for både ledningsforstyrrelser og arytmier.
Hjerteklaffsykdom
Hjerteklaffsykdommer endrer hjertets hemodynamikk og fører til remodellering, hypertrofi og dilatasjon, som alle er pro-arytmiske.
- Aortastenose (AS): Alvorlig AS medfører trykkbelastning, konsentrisk hypertrofi og iskemi. Plutselig død forekommer hos ca. 1 % av asymptomatiske pasienter per år, men risikoen øker drastisk ved symptomdebut (synkope, angina, dyspné).
- Mitralklaffprolaps (MVP) og Mitral Annular Disjunction (MAD): MVP har tradisjonelt vært ansett som en benign tilstand. Nyere forskning har imidlertid identifisert en «arytmisk MVP»-fenotype. Mitral Annular Disjunction (MAD) er en tilstand der det er en abnorm separasjon mellom mitralklafferingen og ventrikkelmyokardiet. Dette fører til unormal bevegelse av basalveggen og fibrose i papillærmusklene, noe som kan gi opphav til livstruende ventrikulære arytmier selv uten alvorlig klaffelekkasje (Bennett et al.).
Ledningsforstyrrelser (Bradyarytmier)
Selv om takyarytmier dominerer, kan plutselig hjertestans også skyldes bradykardi og asystoli.
Total AV-blokk (grad 3) innebærer at ingen impulser ledes fra atrier til ventrikler. Pasienten er avhengig av en «escape-rytme» (erstatningsrytme). Hvis denne utgår fra distale deler av ledningssystemet (His-bunt eller ventrikkelmyokard), er den langsom og upålitelig. Asystoli kan inntreffe plutselig.
Pasienter med bifascikulært blokk (f.eks. høyre grenblokk + venstre fremre fascikkelblokk) har økt risiko for progresjon til totalblokk, særlig ved synkope eller akutt iskemi.
Elektriske sykdommer (Kanalopatier)
Dette er primære elektriske sykdommer i hjertet uten strukturelle feil (normalt ekkokardiogram og MR). De skyldes mutasjoner i genene som koder for ionekanaler (Na+, K+, Ca2+).
Lang QT-tid syndrom (LQTS)
LQTS kjennetegnes av forlenget repolarisering (QT-tid), som predisponerer for en spesifikk form for polymorf VT kalt Torsades de Pointes. Denne kan være selvterminerende (fører til synkope) eller degenerere til VF (hjertestans).
Medfødt LQTS: De vanligste formene er LQT1 (trigger: fysisk aktivitet, spesielt svømming), LQT2 (trigger: emosjonelt stress, høye lyder/vekkerklokke) og LQT3 (trigger: hvile/søvn). Behandling inkluderer betablokkere (spesielt nadolol/propranolol) og ev. ICD ved høy risiko.
Ervervet LQTS: Langt vanligere enn medfødt. Utløses ofte av en kombinasjon av predisposisjon og legemidler (antibiotika, psykofarmaka, antiarytmika) eller elektrolyttforstyrrelser (hypokalemi, hypomagnesemi). Se liste over legemidler som forlenger QT-tiden.
Brugadas syndrom
En arvelig natriumkanalsykdom (oftest SCN5A-mutasjon). EKG viser karakteristiske høyre grenblokk-lignende forandringer med ST-elevasjon i V1-V3 (se figur 3). Arytmier oppstår typisk i hvile, under søvn eller ved feber. Febernedsettende behandling er derfor viktig hos disse pasientene. Mange pasienter er asymptomatiske, men synkope er et alvorlig faresignal.
Katekolaminerg polymorf ventrikkeltakykardi (CPVT)
En alvorlig tilstand (oftest ryanodin-reseptor mutasjon) der fysisk aktivitet eller akutt emosjonelt stress utløser typisk to-veis (bidireksjonell) VT eller polymorf VT. Hvile-EKG er normalt. Ubehandlet har tilstanden høy dødelighet i ung alder. Behandles aggressivt med betablokkere og ofte flekainid.
Andre årsaker (H’ene og T’ene)
I akuttfasen av en hjertestans benytter klinikere ofte huskeregelen «4 H-er og 4 T-er» for å identifisere reversible årsaker:
- Hypoksi (oksygenmangel).
- Hypovolemi (blodtap/væsketap).
- Hyper-/hypokalemi og andre metabolske forstyrrelser.
- Hypotermi (nedkjøling).
- Tromboemboli (lungeemboli eller massivt hjerteinfarkt).
- Tamponade (væske i hjerteposen som klemmer av hjertet).
- Toksine (forgiftninger, medikamentoverdoser).
- Trykkpneumothorax (punktert lunge med overtrykk).
Lungeemboli er en viktig differensialdiagnose ved pulsløs elektrisk aktivitet (PEA). Massiv lungeemboli gir høyre ventrikkel-svikt og sirkulasjonskollaps.
Klinisk utredning av hjertestansoverlevende
For pasienter som overlever hjertestans utenfor sykehus, er grundig utredning avgjørende for å forhindre residiv. Dersom akutt koronarangiografi ikke påviser en klar årsak (f.eks. okklusjon), bør utredningen omfatte:
- MR hjerte: «Gullstandard» for å påvise strukturelle avvik, fibrose, myokarditt, sarkoidose eller spesifikke kardiomyopatier.
- Genetisk testing: Spesielt viktig hos yngre pasienter eller ved mistanke om kardiomyopati eller kanalopati. Positive funn utløser behov for familieutredning (kaskadescreening).
- Provokasjonstester: Arbeids-EKG (for å avdekke CPVT eller iskemi), ajmalin-test (for å avdekke skjult Brugada syndrom).
- Implantasjon av ICD: De fleste overlevende etter hjertestans uten reversibel årsak vil ha indikasjon for sekundærprofylakse med hjertestarter (ICD).
Referanser
Sadie Bennett, Ritu Thamman, Timothy Griffiths, Cheryl Oxley, Jamal Nasir Khan, Thanh Phan, Ashish Patwala, Grant Heatlie, Chun Shing Kwok. Mitral ringformet disjunksjon: En systematisk litteraturgjennomgang Sadie Bennett. Ekkokardiografi . 2019 aug;36 (8):1549-1558.
Vaduganathan M, Patel R.B, Michel A, et al. Dødsmåte ved hjertesvikt med bevart ejeksjonsfraksjon. J Am Coll Cardiol . 2017;69:556-569.
Ekstrom K, Lehtonen J, Nordenswan H.K, et al. Sudden death in cardiac sarcoidosis: an analysis of nationwide clinical and cause-of-death registries. Eur Heart J . 2019;40:3121-3128.
Finocchiaro G, Papadakis M, Robertus J.L, et al. Etiologi ved plutselig død i idrett: innsikt fra et regionalt register i Storbritannia. J Am Coll Cardiol . 2016;67:2108-2115.
Minners J, Rossebo A, Chambers J.B, et al. Plutselig hjertedød hos asymptomatiske pasienter med aortastenose. Heart . 2020;106:1646-1650
Urena M, Webb J.G, Eltchaninoff H, et al. Sen hjertedød hos pasienter som gjennomgår kateterbasert utskifting av aortaklaffen: forekomst og prediktorer for avansert hjertesvikt og plutselig hjertedød. J Am Coll Cardiol . 2015;65:437-448.
Fulton B.L, Liang J.J, Enriquez A, et al. Imaging characteristics of papillary muscle site of origin of ventricular arrhythmias in patients with mitral valve prolapse. J Cardiovasc Electrophysiol . 2018;29:146-153.
Myerburg R.J. Fysiologiske variasjoner, miljøfaktorer og genetiske modifikasjoner ved arvelige LQT-syndromer. J Am Coll Cardiol . 2015;65:375-377.
Sollazzo F, Palmieri V, Gervasi S.F, et al. Sudden cardiac death in athletes in Italy during 2019: Internet-based epidemiological research. Medicina (Kaunas) . 2021;57.
Tseng Z.H, Olgin J.E, Vittinghoff E, et al. Prospektiv fylkesomfattende overvåking og obduksjonskarakterisering av plutselig hjertedød: post scd-studie. Sirkulasjon . 2018;137:2689-2700.
Koronararterieanomalier En entitet på jakt etter en identitet Paolo Angelini Opprinnelig publisert13. mars 2007https://doi.org/10.1161/CIRCULATIONAHA.106.618082. Circulation. 2007;115:1296-1305