Ventrikkelflimmer, pulsløs elektrisk aktivitet og plutselig hjertestans
Ventrikkelflimmer, pulsløs elektrisk aktivitet (PEA) og plutselig hjertestans
Dette kapittelet omhandler patofysiologi, EKG-karakteristika og klinisk håndtering av ventrikkelflimmer (VF) og pulsløs elektrisk aktivitet (PEA). Dette er maligne arytmier som medfører total sirkulasjonsstans og død dersom ikke avansert hjerte- og lungeredning (HLR) iverksettes umiddelbart. Ventrikkelflimmer er elektrofysiologisk karakterisert av kaotisk elektrisk aktivitet drevet av multiple re-entry-kretser (wavelets) i ventrikelmyokardet. Dette forhindrer koordinert kontraksjon, noe som momentant eliminerer hjertets slagvolum. Klinisk manifesterer dette seg som sirkulasjonskollaps, bevisstløshet og respiratorisk stans. I motsetning til ventrikkeltakykardi (VT), som kan være pulsgivende, er VF per definisjon en hjertestansrytme som svært sjelden konverterer spontant til sinusrytme.
Omtrent 80 % av alle tilfeller av plutselig hjertestans med sjokkbar rytme skyldes ventrikkelflimmer eller pulsløs VT. Den dominerende etiologien er aterosklerotisk hjertesykdom (koronarsykdom), hvor akutt iskemi utløser elektrisk ustabilitet. Andre viktige årsaker inkluderer kardiomyopatier (hypertrofisk, dilatert eller arytmogen høyre ventrikkelkardiomyopati), primære elektriske sykdommer som Brugadas syndrom og Lang QT-tid syndrom, samt tidlig repolarisering. Metabolsk stress utløst av elektrolyttforstyrrelser (spesielt hypokalemi og hypomagnesemi), alvorlig acidose, hypotermi og hypoksemi senker terskelen for VF betydelig.
EKG-kjennetegn ved ventrikkelflimmer
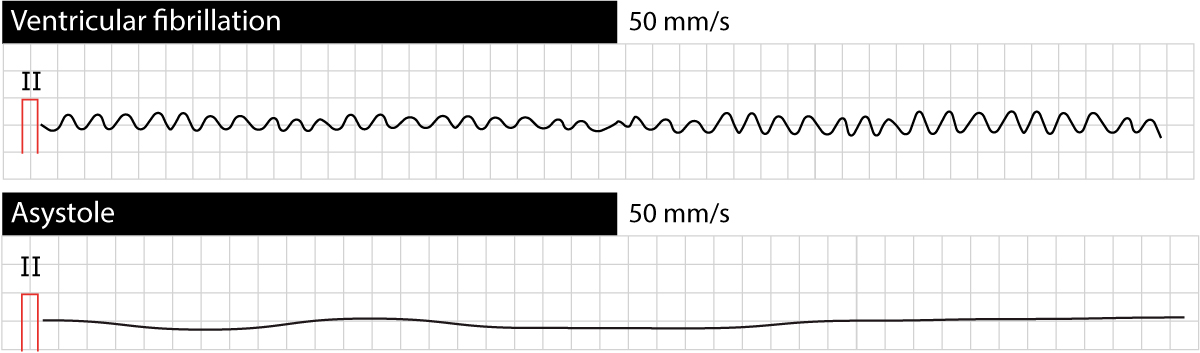
Ved ventrikkelflimmer viser EKG-et totalt fravær av organisert elektrisk aktivitet. Det sees uregelmessige oscillasjoner med varierende morfologi, frekvens og amplitude. Ingen identifiserbare P-bølger, QRS-komplekser eller T-bølger foreligger. Frekvensen på flimmerbølgene ligger vanligvis mellom 150 og 500 per minutt, men er ofte vanskelig å kvantifisere nøyaktig.
Grovfibret vs. finfibret ventrikkelflimmer
Det er klinisk relevant å skille mellom grovfibret og finfibret VF:
- Grovfibret VF: Karakteriseres av høy amplitude (> 0,2 mV). Dette indikerer ofte en nylig oppstått arytmi med bevart energireserve i myokard. Grovfibret VF har generelt høyere sannsynlighet for vellykket defibrillering.
- Finfibret VF: Karakteriseres av lav amplitude (< 0,2 mV). Dette sees ofte ved langvarig hjertestans hvor myokard er utarmet for energisubstrater (ATP). Finfibret VF kan være vanskelig å skille fra asystole på monitor, og prognosen er dårligere. Uten effektiv HLR vil grovfibret VF degenerere til finfibret VF og til slutt asystole.
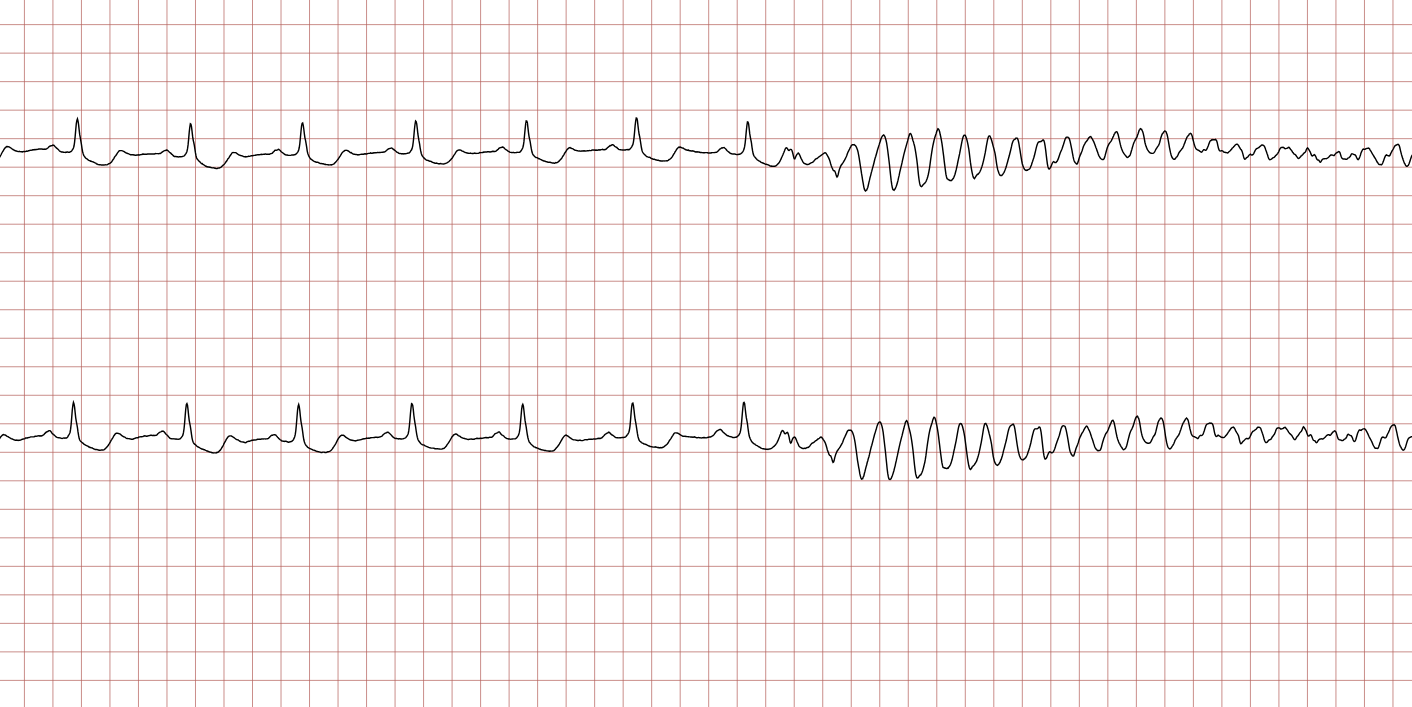
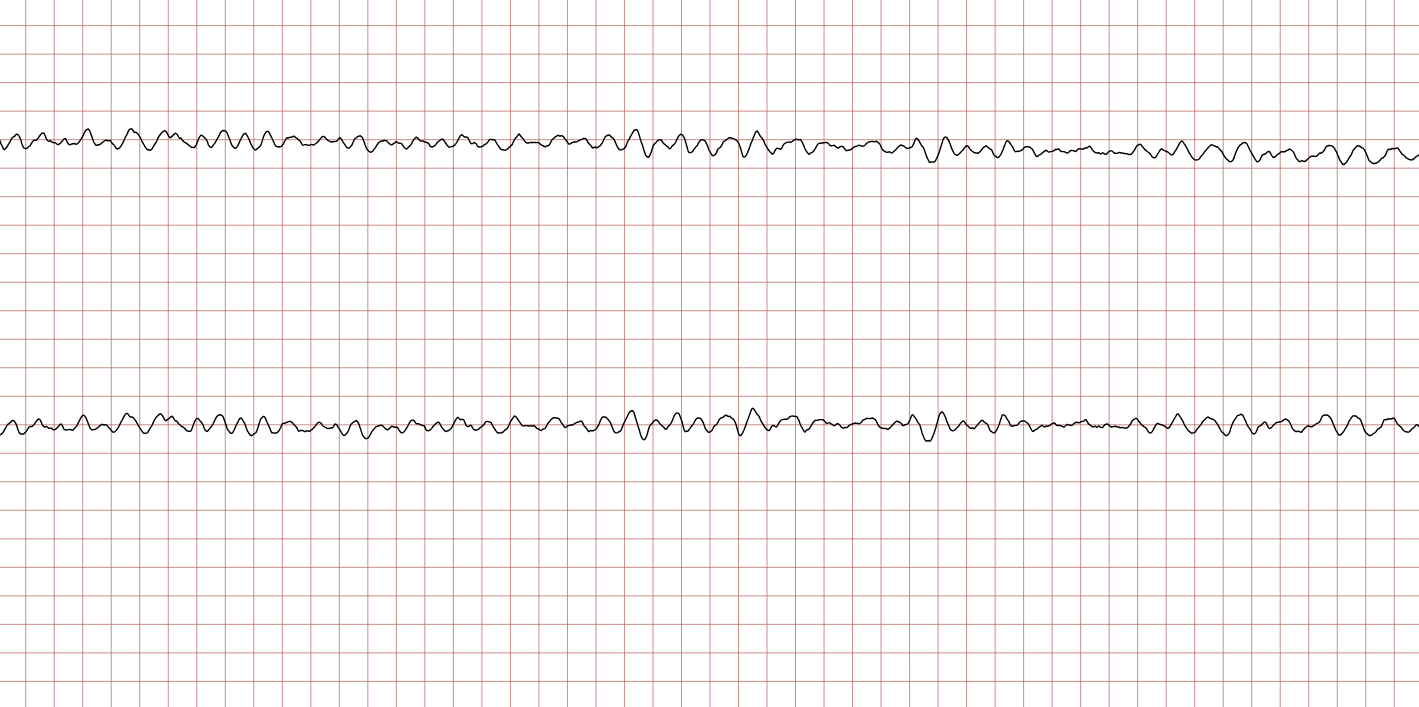
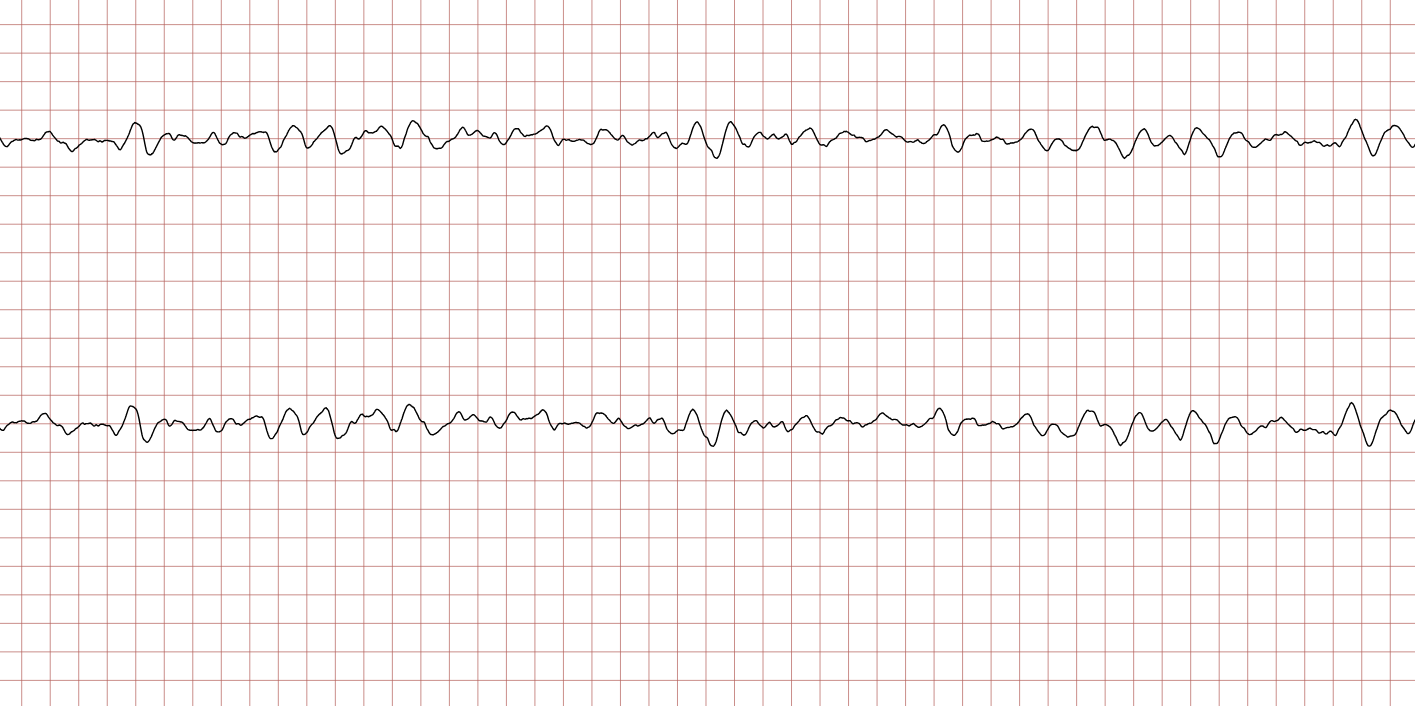
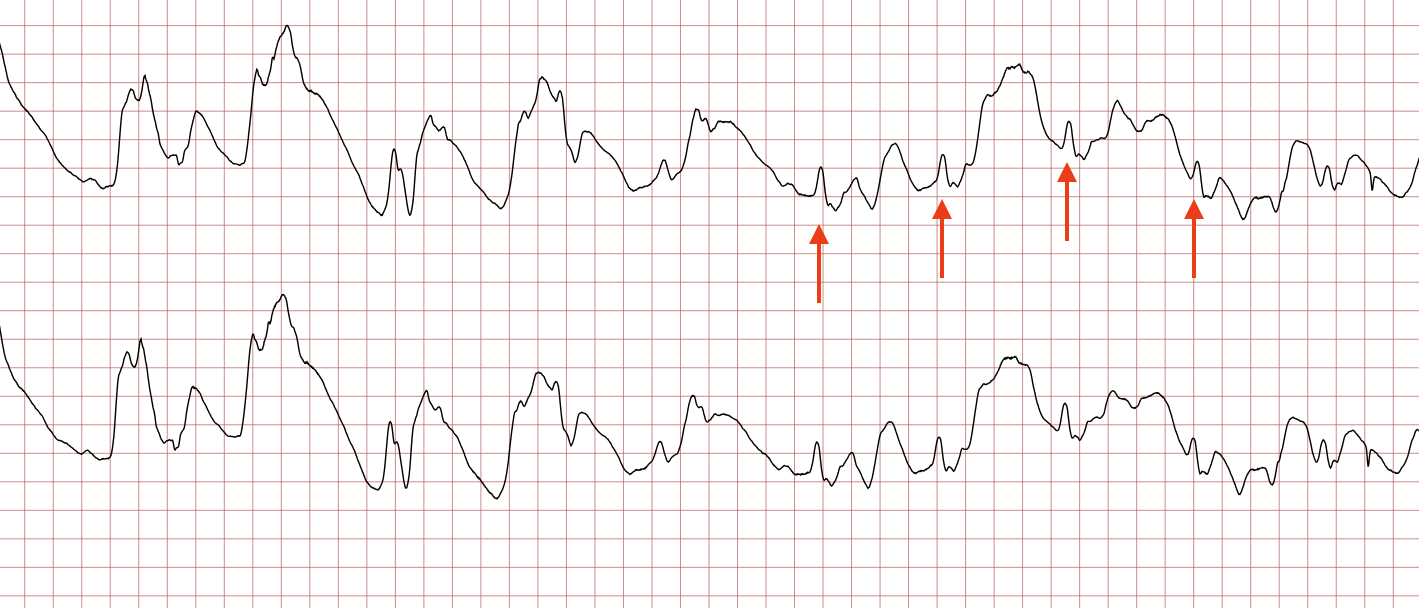
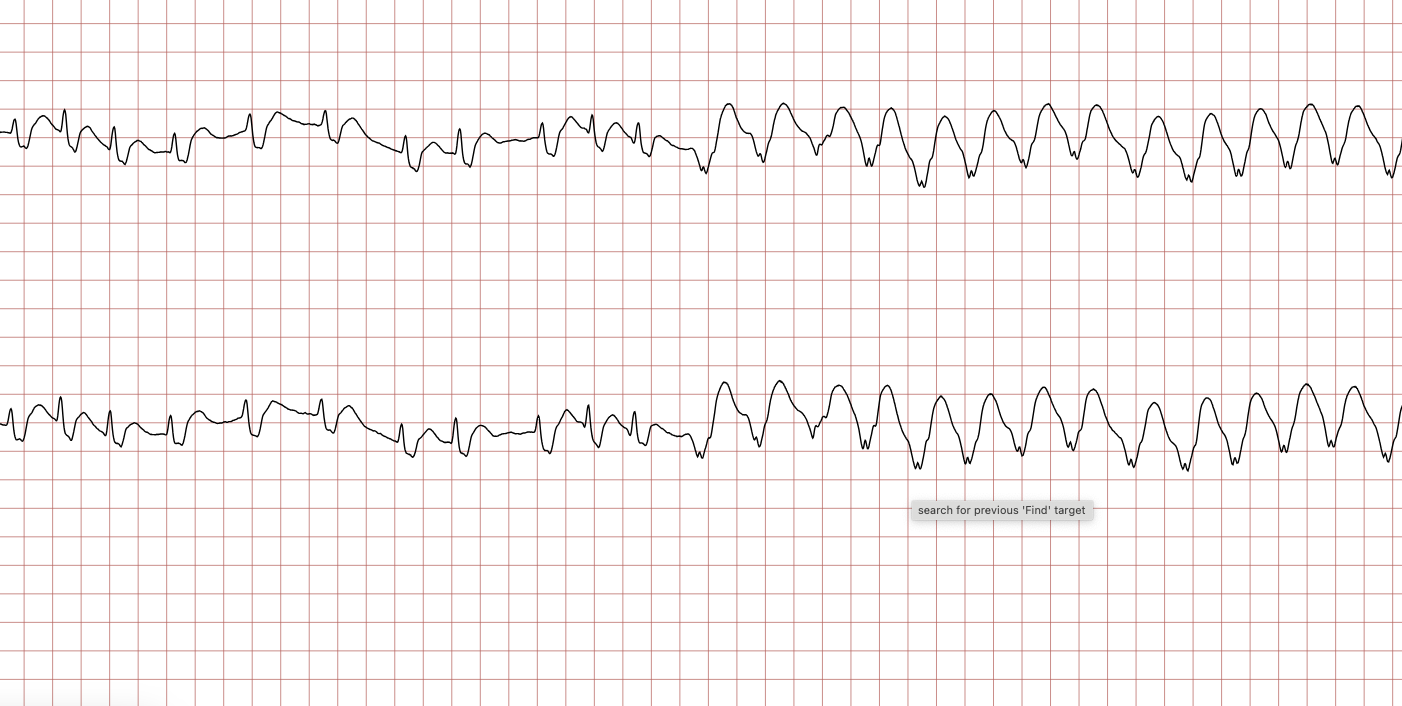
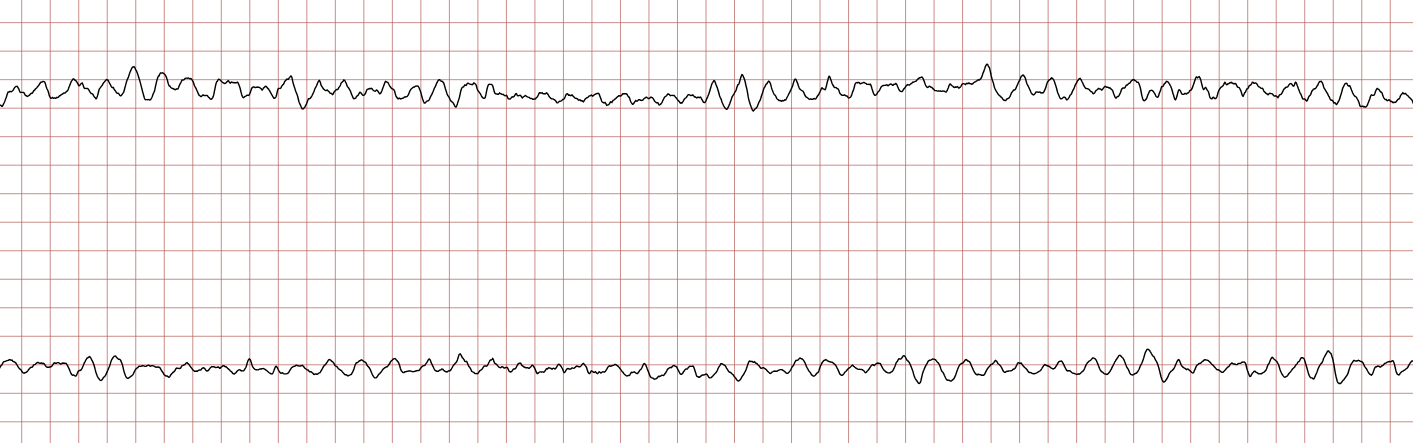
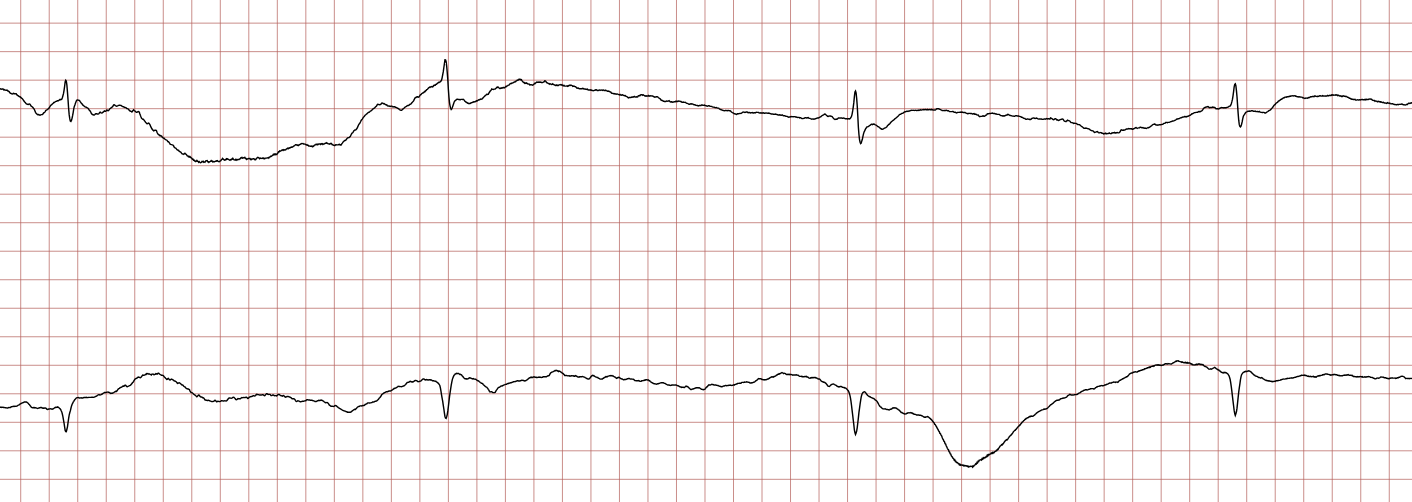
EKG-tilfelle 1: Ventrikulær takykardi som utvikler seg til ventrikkelflimmer
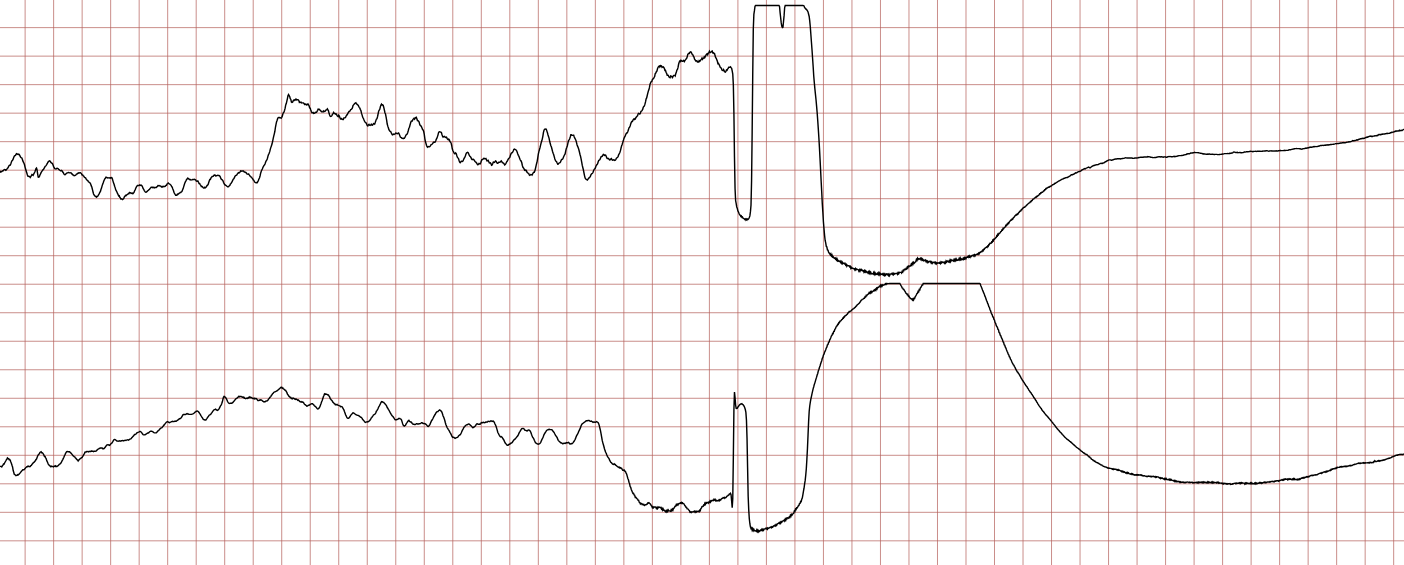
Nedenfor vises sekvensielle EKG-registreringer under en plutselig hjertestans hos en 43 år gammel mann. Kasuistikken illustrerer dynamikken i en hjertestanssituasjon, inkludert degenerering av rytme, effekt av defibrillering og ROSC (Return of Spontaneous Circulation).
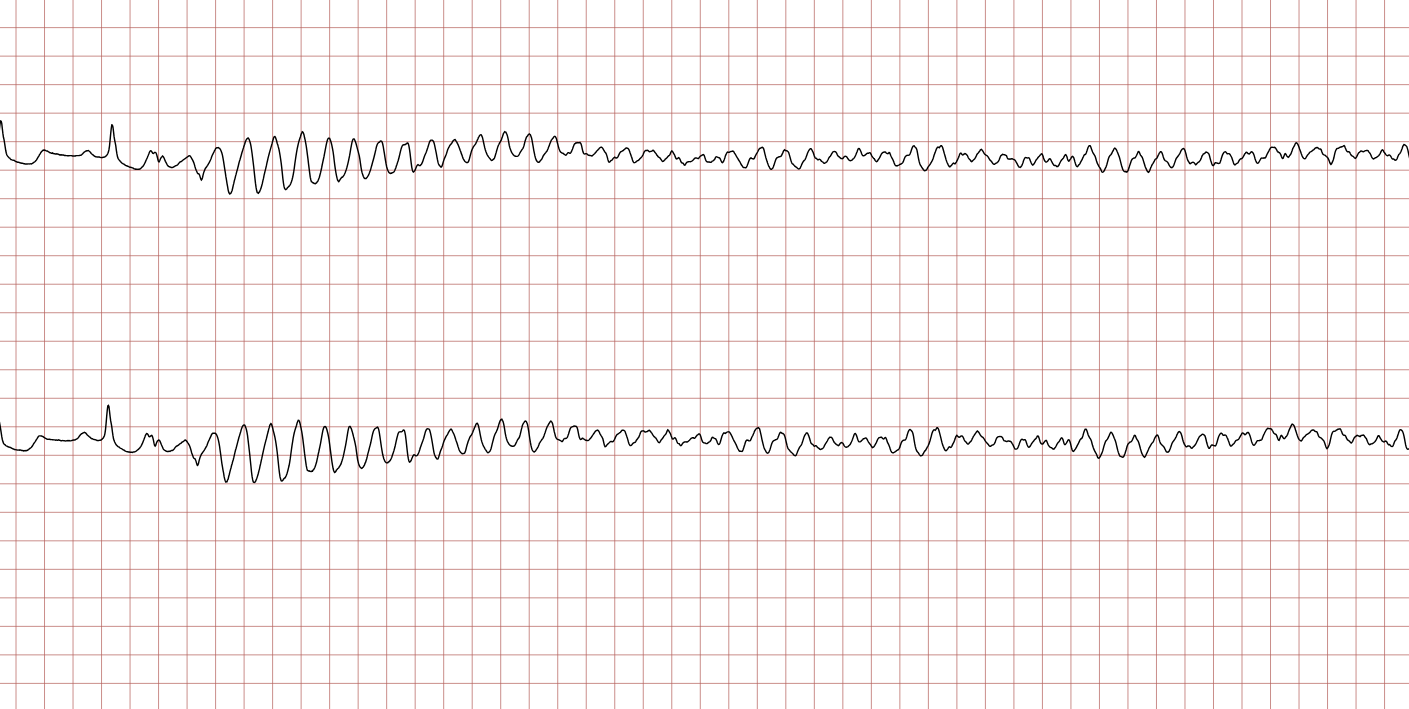

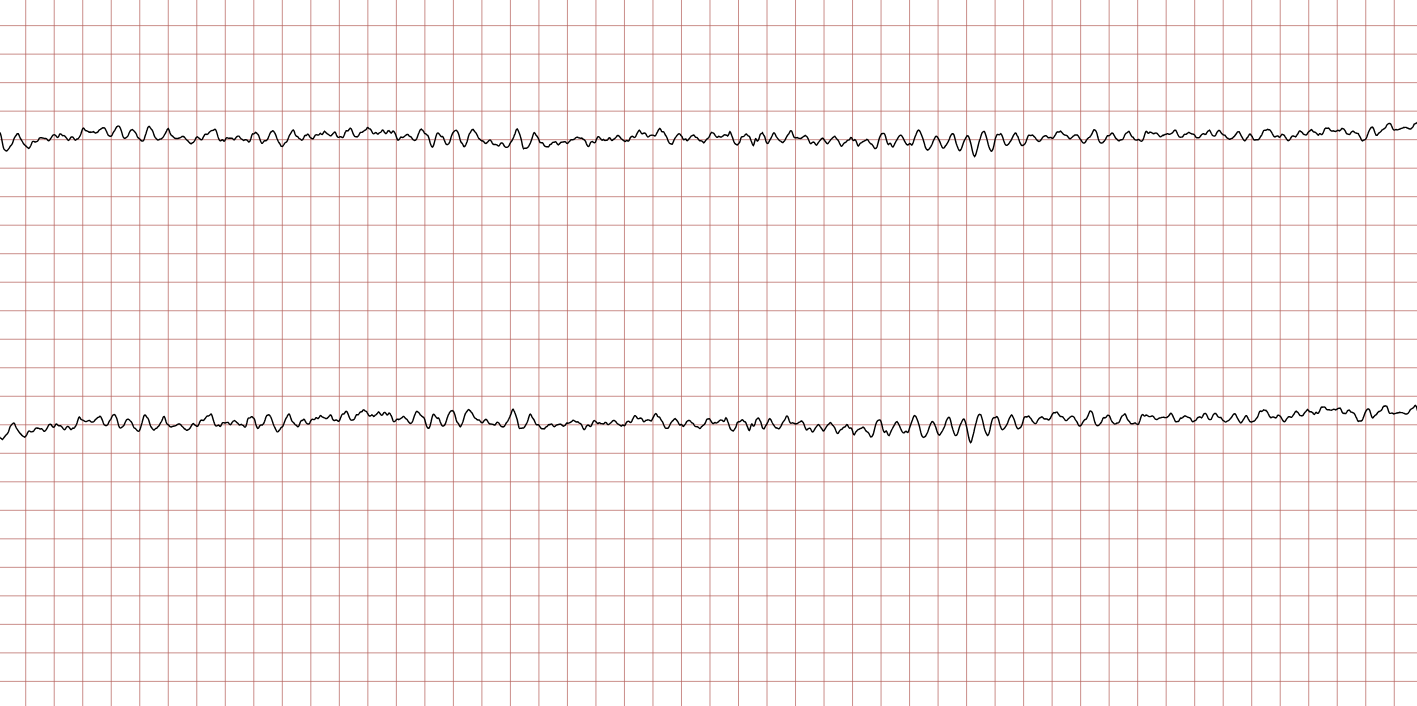




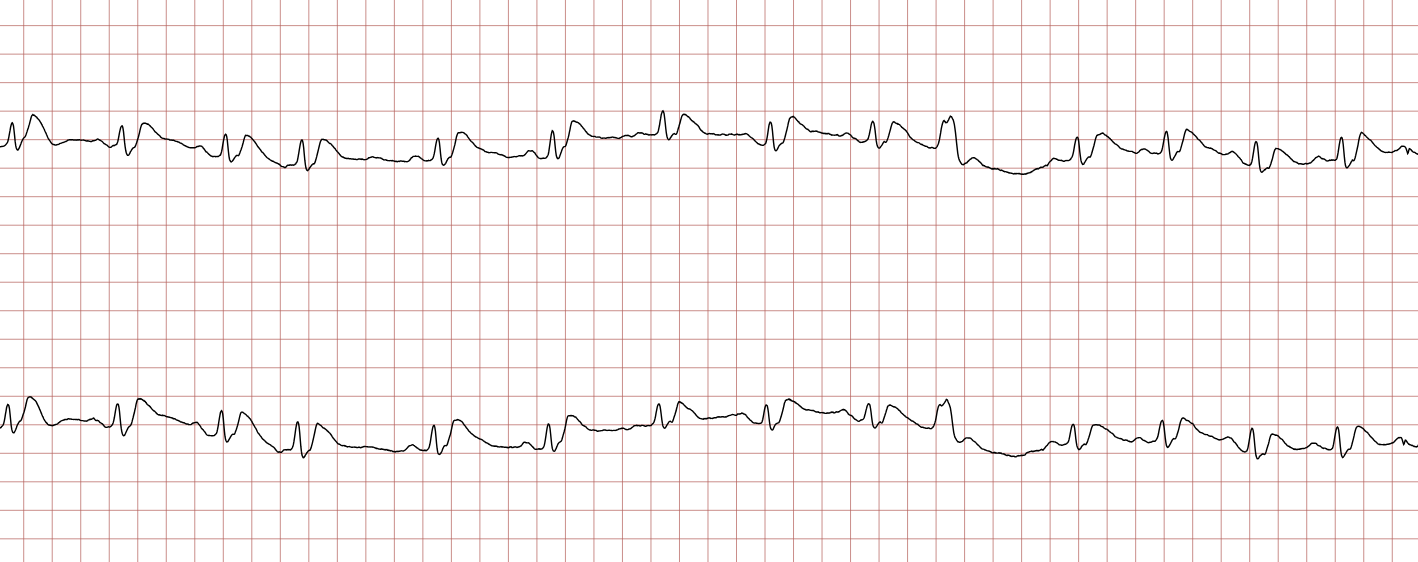

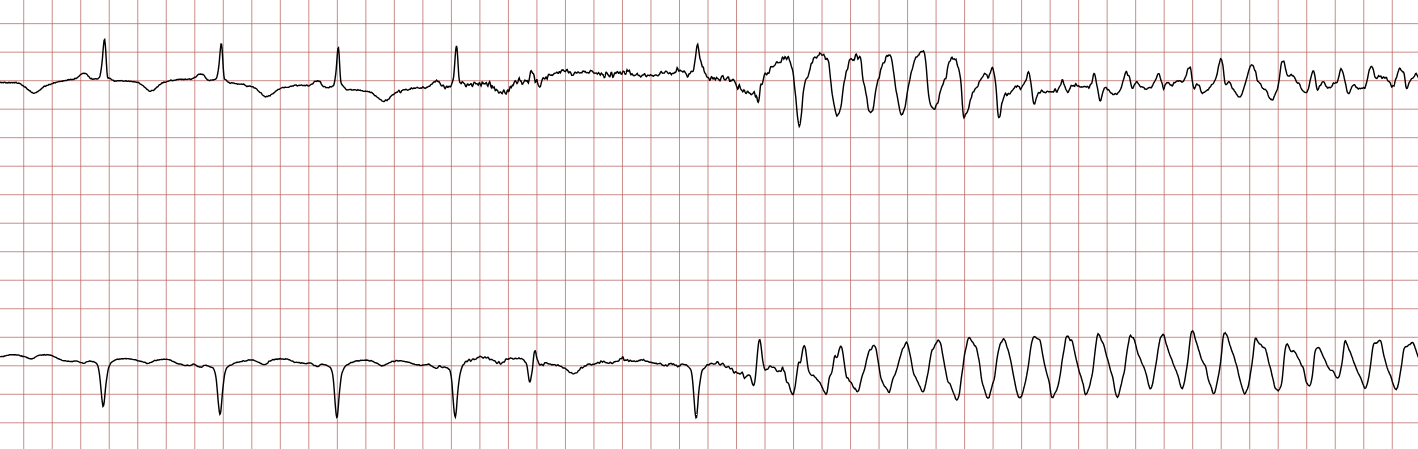
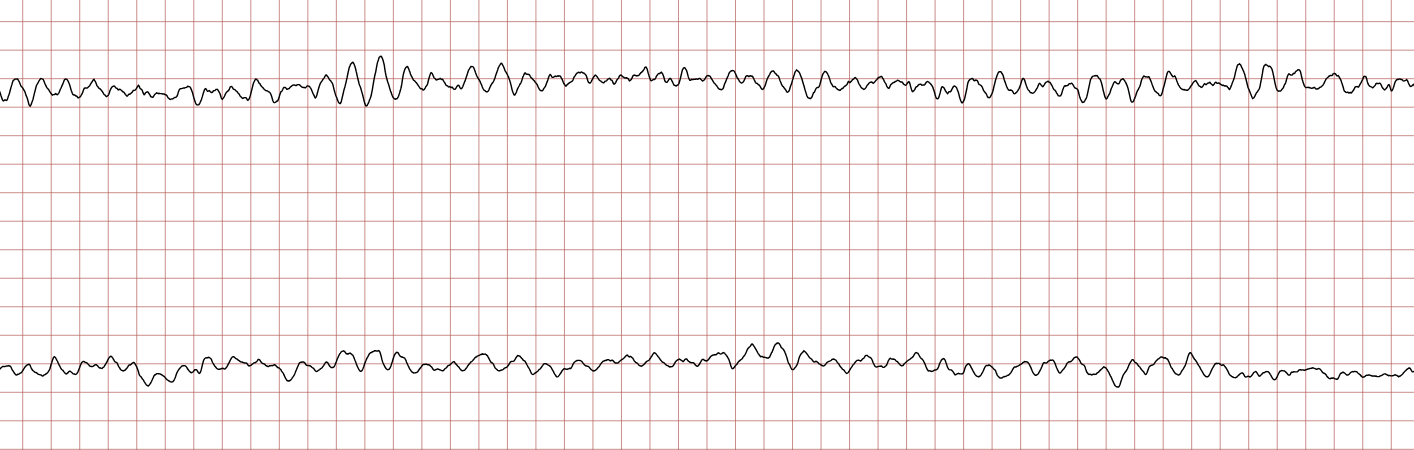
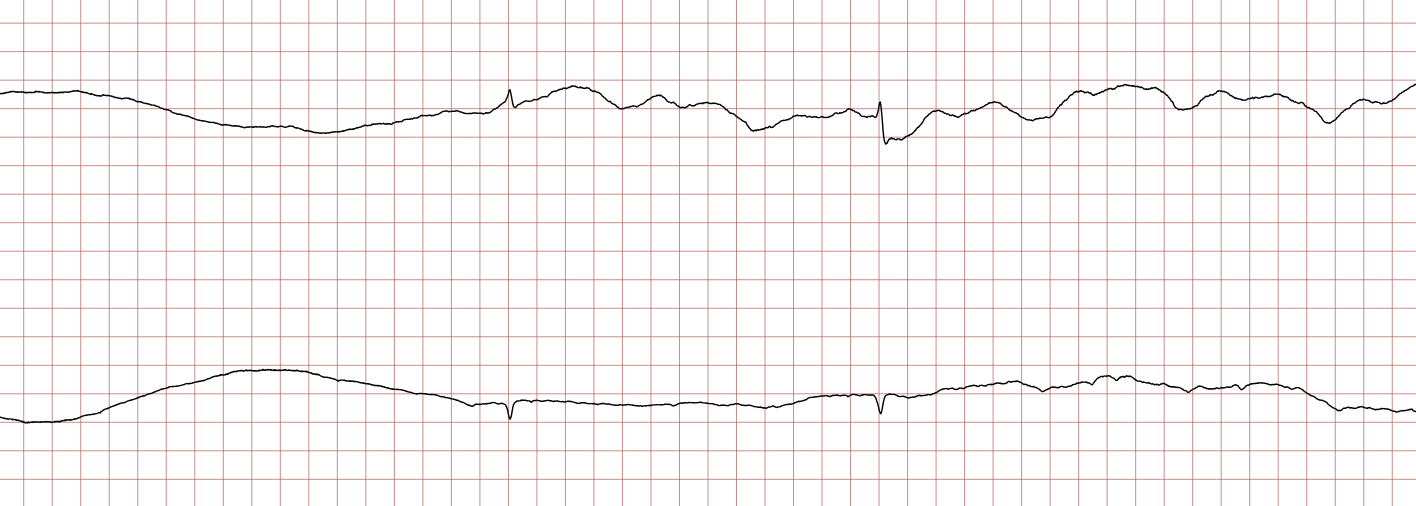
EKG-tilfelle 2: Ventrikulær takykardi som utvikler seg til ventrikkelflimmer
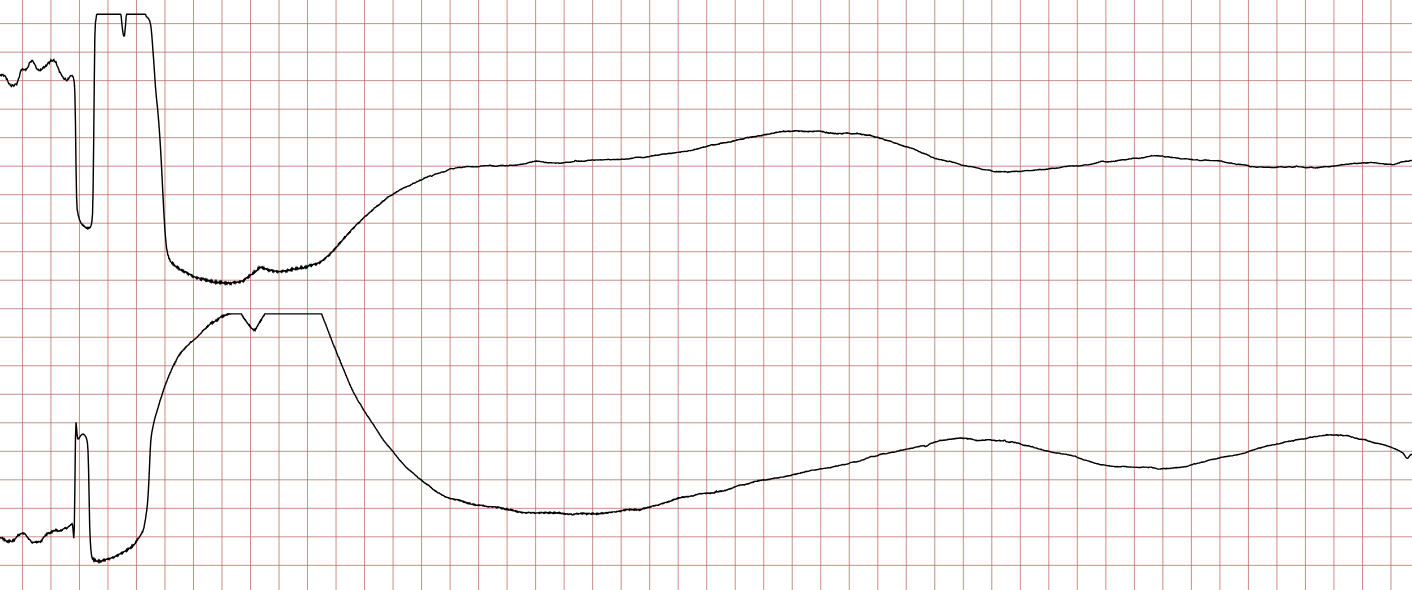
Nedenfor vises sekvensielle EKG-registreringer under en plutselig hjertestans hos en 62 år gammel mann. Hvert EKG viser to avledninger som er registrert samtidig.
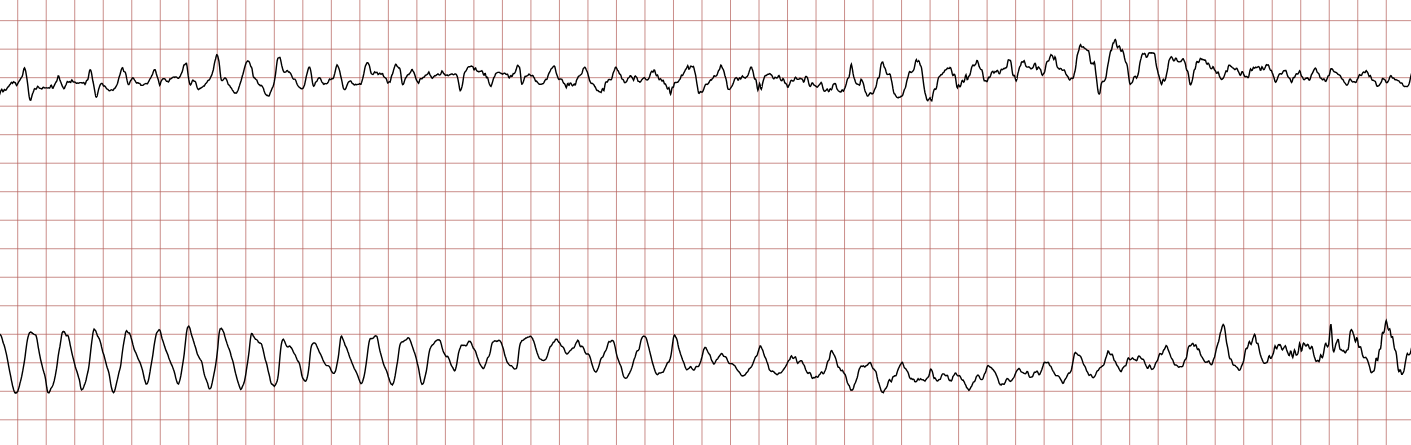
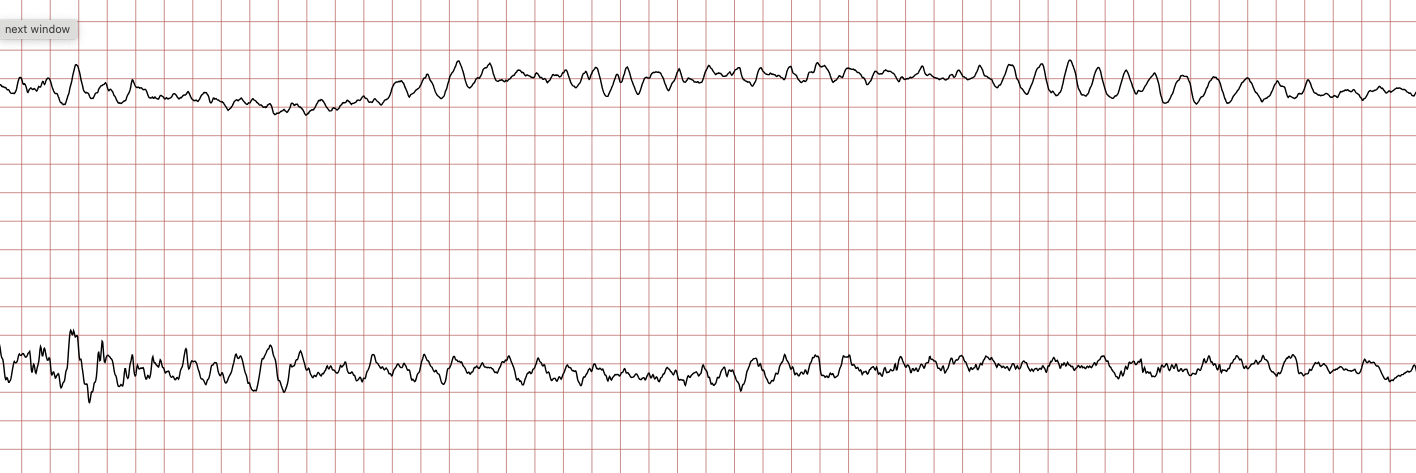
Behandling av ventrikkelflimmer
Ventrikkelflimmer og pulsløs ventrikkeltakykardi er sjokkbare rytmer. Umiddelbar defibrillering er den eneste effektive behandlingen for å avslutte arytmien og gjenopprette organisert hjerterytme. Sannsynligheten for vellykket defibrillering reduseres med 5–10 % for hvert minutt som går uten behandling.
Behandlingen følger standardiserte algoritmer fra Norsk Resuscitasjonsråd (NRR) og European Resuscitation Council (ERC):
- Defibrillering: Gi ett sjokk så raskt som mulig (vanligvis 150–200 J bifasisk for voksne).
- HLR: Start brystkompresjoner umiddelbart etter sjokkavgivelse. Ikke bruk tid på å sjekke puls eller rytme før etter 2 minutter med HLR (30:2-syklus). Høykvalitets brystkompresjoner er avgjørende for å opprettholde koronar perfusjon og øke sjansen for at neste sjokk lykkes.
- Legemidler: Dersom VF vedvarer etter 3. sjokk, gis adrenalin 1 mg i.v./i.o. og amiodarone 300 mg i.v./i.o. Adrenalin gjentas deretter hvert 3.–5. minutt, mens en ytterligere dose amiodarone (150 mg) kan gis ved vedvarende VF etter 5. sjokk.
Hjertestans og plutselig hjertedød
For detaljer om den praktiske gjennomføringen, se Plutselig hjertestans og hjerte-lungeredning (HLR).
Hjertestans defineres som opphør av mekanisk hjerteaktivitet, bekreftet ved fravær av bevissthet, normal pust og palpabel puls. Plutselig hjertedød (Sudden Cardiac Death, SCD) defineres som uventet naturlig død av kardial årsak som inntreffer innen 1 time etter symptomdebut (eller innen 24 timer etter at personen sist ble sett i live og symptomfri). Iskemi er den dominerende årsaken, men mekanismen er nesten alltid en letal arytmi.
Den terminale hendelsen følger ofte et forutsigbart mønster: En utløsende faktor (f.eks. akutt iskemi, elektrolyttforstyrrelse eller fysisk stress) trigger ventrikkeltakykardi (VT), som raskt degenererer til ventrikkelflimmer (VF). Uten behandling vil VF over tid miste amplitude (bli finfibret) og ende i asystole (figur 1), som er endestadiet av elektrisk aktivitet. Prognosen ved asystole er svært dårlig sammenlignet med sjokkbare rytmer.
Underliggende årsaker til plutselig hjertedød
- Koronarsykdom (80 %): Både akutt hjerteinfarkt og arrvev etter tidligere infarkt kan danne substrat for re-entry-arytmier.
- Kardiomyopatier (10–15 %): Hypertrofisk kardiomyopati (HCM) er vanligste årsak til SCD hos unge utøvere. Dilatert kardiomyopati (DCM) og arytmogen høyre ventrikkelkardiomyopati (ARVC) er også viktige differensialdiagnoser.
- Primære elektriske sykdommer (5 %): Kanalopatier som Lang QT-syndrom (LQTS), Brugadas syndrom, Katekolaminerg polymorf VT (CPVT) og kort QT-syndrom. Disse pasientene har strukturelt normale hjerter, men ustabil elektrofysiologi.
- Andre årsaker: Aortastenose, myokarditt, commotio cordis (slag mot brystet i sårbar fase), tamponade og lungeemboli.
Asystole og brady-asystole
Asystole representerer totalt fravær av ventrikulær elektrisk aktivitet og sees i EKG som en flat linje («flatline»). Det er viktig å verifisere asystole i to avledninger for å utelukke ekstremt finfibret VF, da sistnevnte teoretisk sett kan profitere på defibrillering (selv om retningslinjer anbefaler HLR først for å øke amplituden). Brady-asystole (eller agonal rytme) defineres som asystole avbrutt av sporadiske, brede og bisarre komplekser (QRS) som ikke genererer puls. Dette representerer ofte de aller siste elektriske utladningene i et døende myokard.
Behandling av asystole og brady-asystole
Asystole er en ikke-sjokkbar rytme. Defibrillering har ingen hensikt og vil kun medføre avbrudd i livreddende kompresjoner. Behandlingen fokuserer på høykvalitets HLR og tidlig administrasjon av adrenalin (1 mg i.v./i.o. så snart som mulig, gjentas hvert 3.–5. minutt) for å øke koronar perfusjonstrykk, samt identifisering av reversible årsaker.
Pulsløs elektrisk aktivitet (PEA)
Synonym: Elektromekanisk dissosiasjon (EMD)
Pulsløs elektrisk aktivitet (PEA) defineres som forekomst av organisert elektrisk aktivitet i EKG (som normalt ville gitt puls), hos en pasient uten palpabel puls. EKG kan vise tilsynelatende normal sinusrytme, men oftere sees en bradykard rytme med brede komplekser. Tilstanden innebærer at hjertets elektriske system fungerer, men at den mekaniske kontraksjonen enten er fraværende eller så svak at den ikke genererer et målbart blodtrykk.
Pseudo-PEA vs. Sann PEA
Med økende bruk av ultralyd (POCUS) i akuttmedisin, skiller man nå ofte mellom:
- Sann PEA: Ingen hjertekontraksjoner er synlige på ultralyd (hjertet står stille). Prognosen er svært dårlig.
- Pseudo-PEA (PREM – Pulseless Rhythm with Echocardiographic Motion): Ultralyd viser svake myokardkontraksjoner, men de er for svake til å gi palpabel puls. Denne tilstanden skyldes ofte dyp hypovolemi eller massiv lungemboli, og har bedre prognose enn sann PEA hvis årsaken korrigeres aggressivt.
Årsaker til pulsløs elektrisk aktivitet (4 H-er og 4 T-er)
PEA skyldes nesten alltid en underliggende, ofte reversibel, fysiologisk forstyrrelse. For å lykkes med gjenopplivning må klinikeren raskt identifisere og behandle årsaken. Huskeregelen «4 H-er og 4 T-er» benyttes systematisk:
- Hypoksi: Sikre frie luftveier og oksygenering.
- Hypovolemi: Mistanke ved traume, blødning eller dehydrering. Behandles med væske/blod.
- Hypotermi: Mål temperatur. Vurder oppvarmingsteknikker.
- Hyper-/hypokalemi (og metabolske forstyrrelser): Vurder ved nyresvikt eller diuretika-bruk.
- Tamponade (kardial): Mistanke ved halsvenestuvning eller penetrerende skade. Krever perikardiocentese eller torakotomi.
- Trykkpneumotoraks: Mistanke ved ensidig lungelyd/traume. Krever nåledekompresjon/thoraxdren.
- Trombose (koronar eller pulmonal): Massivt hjerteinfarkt eller lungeemboli. Trombolyse kan vurderes ved mistenkt LE under pågående HLR.
- Toksiner: Forgiftninger (f.eks. betablokkere, kalsiumblokkere, trisykliske antidepressiva). Vurder antidot.
Behandling av pulsløs elektrisk aktivitet
PEA er en ikke-sjokkbar rytme. Hovedpillarene i behandlingen er:
- HLR: Kontinuerlige kompresjoner med minimale avbrudd.
- Adrenalin: 1 mg i.v./i.o. settes så raskt som mulig, deretter hvert 3.–5. minutt.
- Årsaksbehandling: Systematisk utredning og intervensjon mot 4 H-er og 4 T-er (f.eks. gi væske, dekomprimere brystkasse, gi motgift).
- Ultralyd: Bruk av POCUS under rytmesjekk anbefales for å identifisere potensielt reversible årsaker som tamponade, lungeemboli (høyre ventrikkel-dilatasjon) eller hypovolemi.