STEMI (hjerteinfarkt med ST-elevasjon): Diagnose, EKG, kriterier og behandling
STEMI (akutt hjerteinfarkt med ST-elevasjon): Epidemiologi, diagnose (EKG), kriterier og behandling
Akutt ST-elevasjonsinfarkt (STEMI) representerer den mest tidskritiske manifestasjonen av koronararteriesykdom. Dette kapittelet omhandler patofysiologi, definisjoner, diagnostiske kriterier og behandling av pasienter med akutt STEMI. Selv om EKG-forandringer ved akutt STEMI er omtalt tidligere (se EKG-forandringer ved akutt hjerteinfarkt), gis det en repetisjon med klinisk fokus nedenfor. Behandlingskjeden og akutt håndtering omtales i detalj. De kliniske definisjonene og anbefalingene som presenteres, er harmonisert med retningslinjene fra European Society of Cardiology (ESC) og Norsk Cardiologisk Selskap, samt relevante oppdateringer fra American Heart Association (AHA) og American College of Cardiology (ACC). Omfattende vitenskapelig dokumentasjon, basert på store randomiserte, kontrollerte studier, danner grunnlaget for anbefalingene i dette kapittelet.
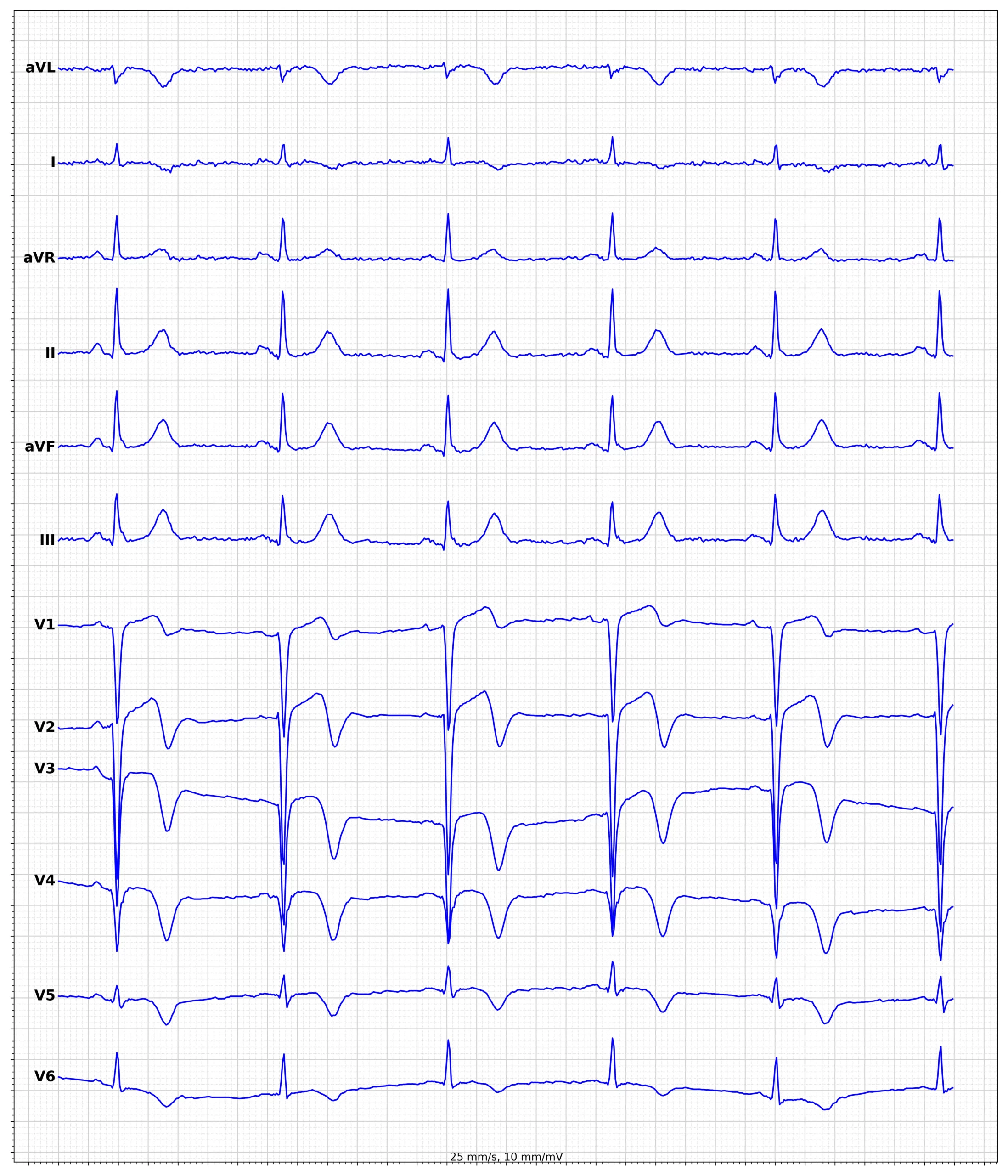
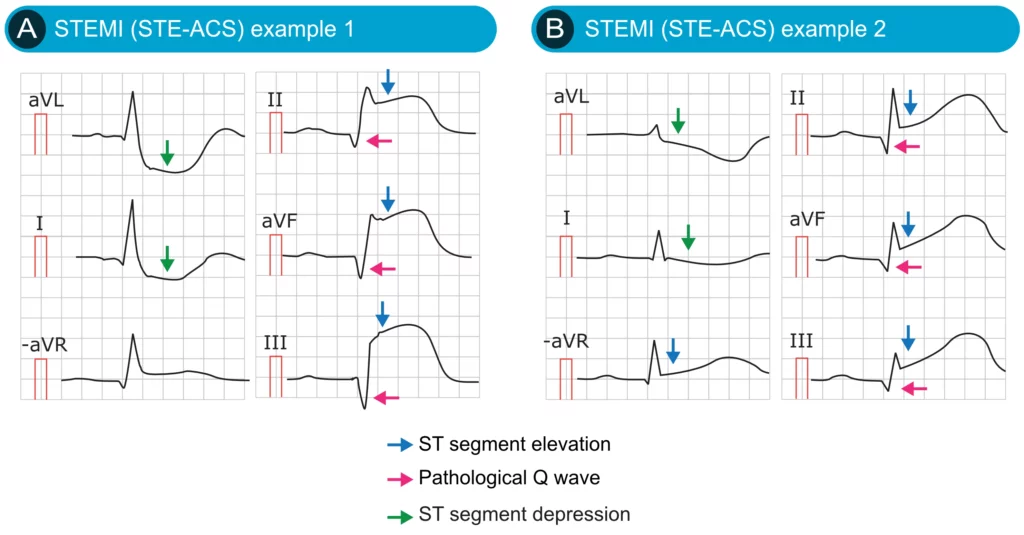
EKG-eksempler på hjerteinfarkt med ST-elevasjon (STEMI)
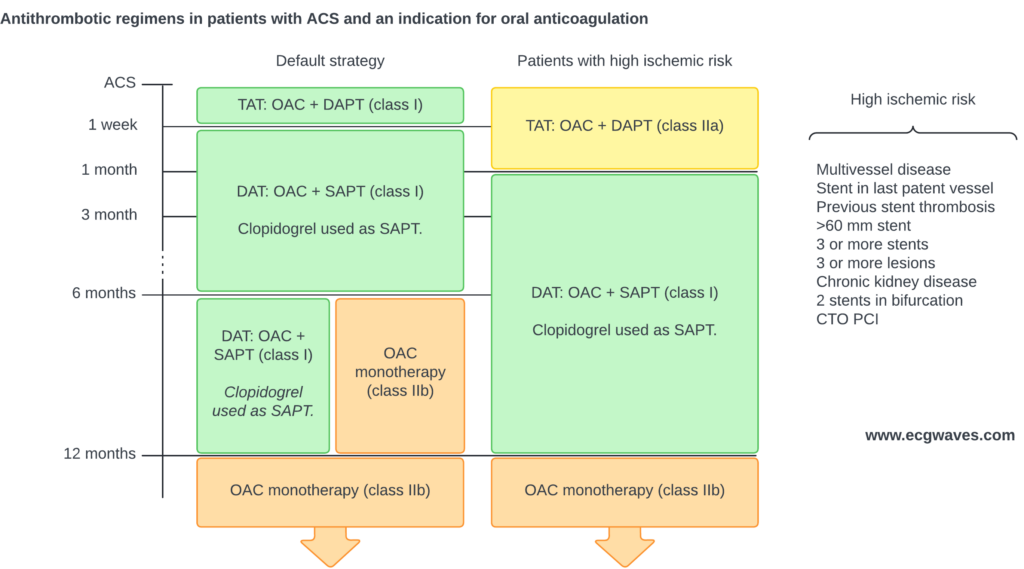
Oversikt over behandling
Klikk på diagrammet for å forstørre det.
Brystsmerter (retrosternalt trykk eller ubehag) er kardinalsymptomet på myokardiskemi. Ved STEMI er smertene ofte intense og vedvarende, gjerne ledsaget av vegetative symptomer som kvalme, oppkast og kaldsvette. Den patofysiologiske årsaken til den uttalte symptombyrden ved STEMI sammenlignet med NSTEMI (ikke-ST-elevasjonsinfarkt) eller ustabil angina (UA), er graden av iskemi. Ved STEMI foreligger en komplett okklusjon av en epikardial koronararterie, noe som medfører transmural iskemi og rask nekrose av myokardveggen. Ved NSTEMI og UA er okklusjonen oftest partiell eller intermitterende, noe som resulterer i subendokardiell iskemi og ofte mildere symptomer. Denne forskjellen underbygger også den betydelig høyere risikoen for maligne ventrikulære arytmier ved STEMI i akuttfasen. Ventrikkeltakykardi (VT) og ventrikkelflimmer (VF) kan inntreffe umiddelbart etter okklusjon og er den dominerende dødsårsaken prehospitalt.
Behandlingskjeden ved akutt STEMI
Optimal prognose ved STEMI er direkte korrelert med tiden fra symptomdebut til reperfusjon. Dette krever et sømløst samarbeid mellom AMK (113), ambulansetjenesten, luftambulanse, akuttmottak og PCI-senteret. Regionale helseforetak har etablerte STEMI-protokoller for å minimere forsinkelser («Time is muscle»). Nøkkelen er rask identifisering prehospitalt, helst med direkte overføring til kateteriseringslaboratorium (PCI-lab) uten omvei via lokalsykehus, dersom transporttiden tillater det (se tidsgrenser under reperfusjonsstrategi).
Diagnostisering av akutt STEMI
Diagnosen STEMI er i akuttfasen primært basert på klinikk og EKG. Prehospitalt personell spiller en avgjørende rolle. 12-avlednings EKG skal tas ved første medisinske kontakt (FMC), ideelt sett innen 10 minutter. Sensitiviteten og spesifisiteten for prehospital EKG-tolkning varierer, men moderne telemetri muliggjør konferering med kardiolog ved PCI-senteret. Studier på ambulansepersonells tolkningsevne viser (Ducas et al., Mencl et al.):
- Sensitivitet: Ca. 75 %. Dette innebærer at man ikke bør stole blindt på automatisk tolkning eller kun prehospital vurdering ved sterkt mistenkelig klinikk, men heller konferere med spesialist.
- Spesifisitet: Relativt lav (ca. 53 %) i enkelte studier uten legetolkning, noe som understreker viktigheten av å kjenne til STEMI-mimickers (se differensialdiagnoser).
- Negativ prediktiv verdi (NPV): Svært høy (99,7 %), noe som betyr at et normalt EKG prehospitalt er en god indikator på fravær av STEMI, men det utelukker ikke NSTEMI eller ustabil angina.
Merk: Måling av hjertetroponiner (TnT/TnI) er ikke nødvendig for å iverksette reperfusjonsbehandling ved STEMI. Venting på blodsvar forsinker livreddende behandling og er kontraindisert ved klare EKG-forandringer og typisk klinikk.
Generelle prinsipper for behandling
Behandlingen av STEMI hviler på fire pilarer: (1) Akutt reperfusjon (primær PCI eller fibrinolyse), (2) Dobbel platehemming (DAPT), (3) Antikoagulasjon, og (4) Anti-iskemisk/symptomatisk behandling. Målet er å gjenopprette koronar perfusjon, begrense infarktstørrelsen, forebygge re-okklusjon og behandle komplikasjoner som arytmi og hjertesvikt. Figur 1 illustrerer flytskjema for valg av reperfusjonsstrategi.
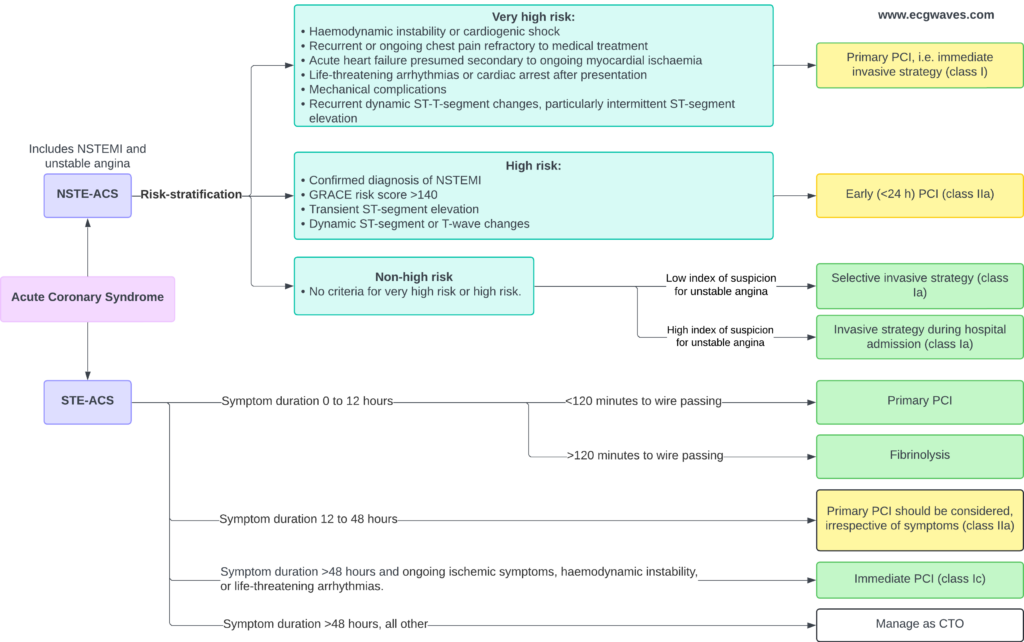
Diagnose og definisjon av akutt STEMI (hjerteinfarkt med ST-elevasjon)
Akutt koronarsyndrom (ACS) inndeles basert på EKG-funn ved ankomst:
- STE-ACS (STEMI): Karakterisert ved vedvarende brystsmerter og signifikante ST-elevasjoner (eller ekvovalenter som nytt venstre grenblokk). Dette indikerer akutt totalokklusjon og krever umiddelbar reperfusjon. Diagnosen «Hjerteinfarkt» bekreftes formelt når troponinstigning foreligger, men behandlingen starter før dette svaret.
- NSTE-ACS: Omfatter NSTEMI og Ustabil Angina (UA). Her mangler ST-elevasjoner; pasienten har ofte ST-senkninger, T-inversjoner eller normalt EKG. Skillet mellom NSTEMI og UA går på om det foreligger myokardskade (troponinutslipp) eller ikke.
Klassifikasjonen er avgjørende for behandlingsvalg: STEMI krever umiddelbar revaskularisering («blålys til PCI-lab»), mens NSTE-ACS oftest behandles med tidlig invasiv utredning (innen 24 timer), avhengig av risikoprofil.
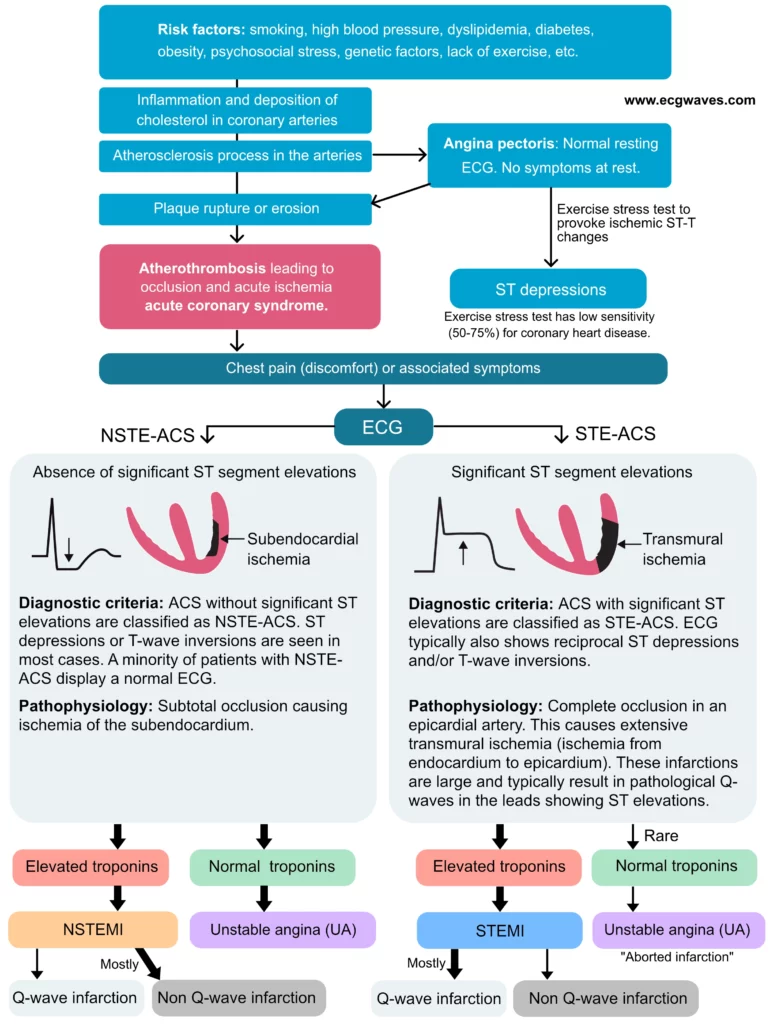
Patofysiologi ved STEMI
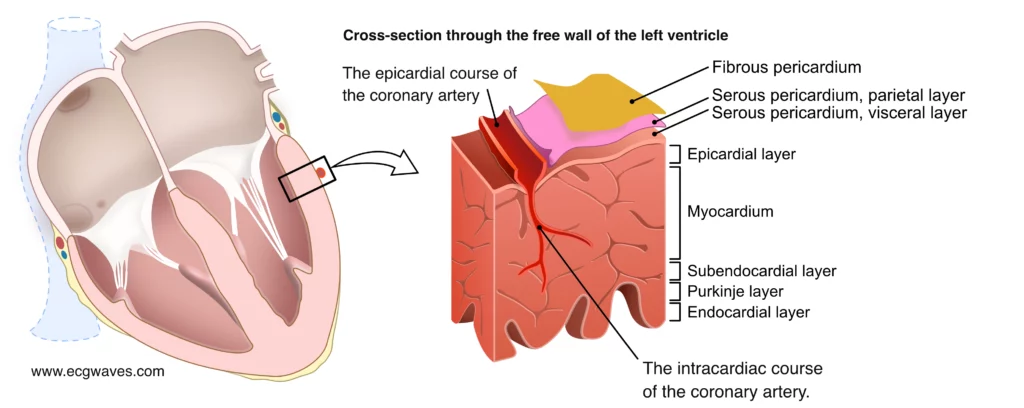
Den underliggende årsaken til STEMI er nesten alltid ruptur eller erosjon av et aterosklerotisk plakk (Type 1 hjerteinfarkt). Plakkruptur eksponerer trombogene stoffer (som vevsfaktor) for blodet, noe som trigger rask plateaggregering og dannelse av en fibrinrik trombe. Denne tromben okkluderer arterielumen fullstendig. Uten blodforsyning oppstår transmural iskemi, som raskt progredierer til irreversibel nekrose (infarkt) fra endokard mot epikard (bølgefront-fenomenet). Tidsvinduet for å redde myokard er kort; irreversibel skade starter allerede etter 20-30 minutter.
Video 1 og 2 viser obstruksjonen av blodstrømmen hos en pasient med STEMI (video 1) og resultatet av PCI (video 2).
Video 1 (over): Angiogram som viser akutt okklusjon av venstre circumflex (CX).
Video 2 (over): Vellykket rekanalisering etter PCI med stentimplantasjon (Todt et al.).
MINOCA: Hjerteinfarkt uten obstruktive koronararterier
I ca. 5-10 % av tilfellene der pasienten presenterer med symptomer og troponinutslipp forenlig med hjerteinfarkt, finner man normale eller nær normale koronararterier (ingen stenose >50 %) ved angiografi. Dette kalles MINOCA (Myocardial Infarction with Non-Obstructive Coronary Arteries). Årsakene kan være plakk-erosjon, spontan koronardisseksjon (SCAD), koronarspasme, mikrovaskulær dysfunksjon eller embolier. Det er viktig å skille MINOCA fra tilstander som myokarditt eller Takotsubo-kardiomyopati, ofte ved hjelp av MR hjerte. Behandlingen av MINOCA må skreddersys den underliggende årsaken.
Epidemiologi ved hjerteinfarkt med ST-elevasjon
Forekomst av ST-elevasjonsinfarkt
Andelen STEMI har sunket i den vestlige verden og utgjør nå omtrent 25–40 % av alle hjerteinfarkt, mens NSTEMI øker. Dette skyldes dels bedre forebygging av alvorlig aterosklerose, men også høysensitive troponinmetoder som fanger opp mindre infarkter (NSTEMI) som tidligere ble klassifisert som ustabil angina.
Dødelighet ved STEMI
Dødeligheten har falt dramatisk takket være moderne reperfusjonsbehandling. Sykehusdødeligheten er nå under 5-6 % i mange registre, men totaldødeligheten (inkludert prehospitale dødsfall) er fortsatt betydelig. Alder er en sterk risikofaktor; pasienter over 75 år har markant høyere risiko. Kvinner med STEMI presenterer ofte senere og har høyere risiko for komplikasjoner, delvis grunnet høyere alder ved debut og mer komorbiditet.
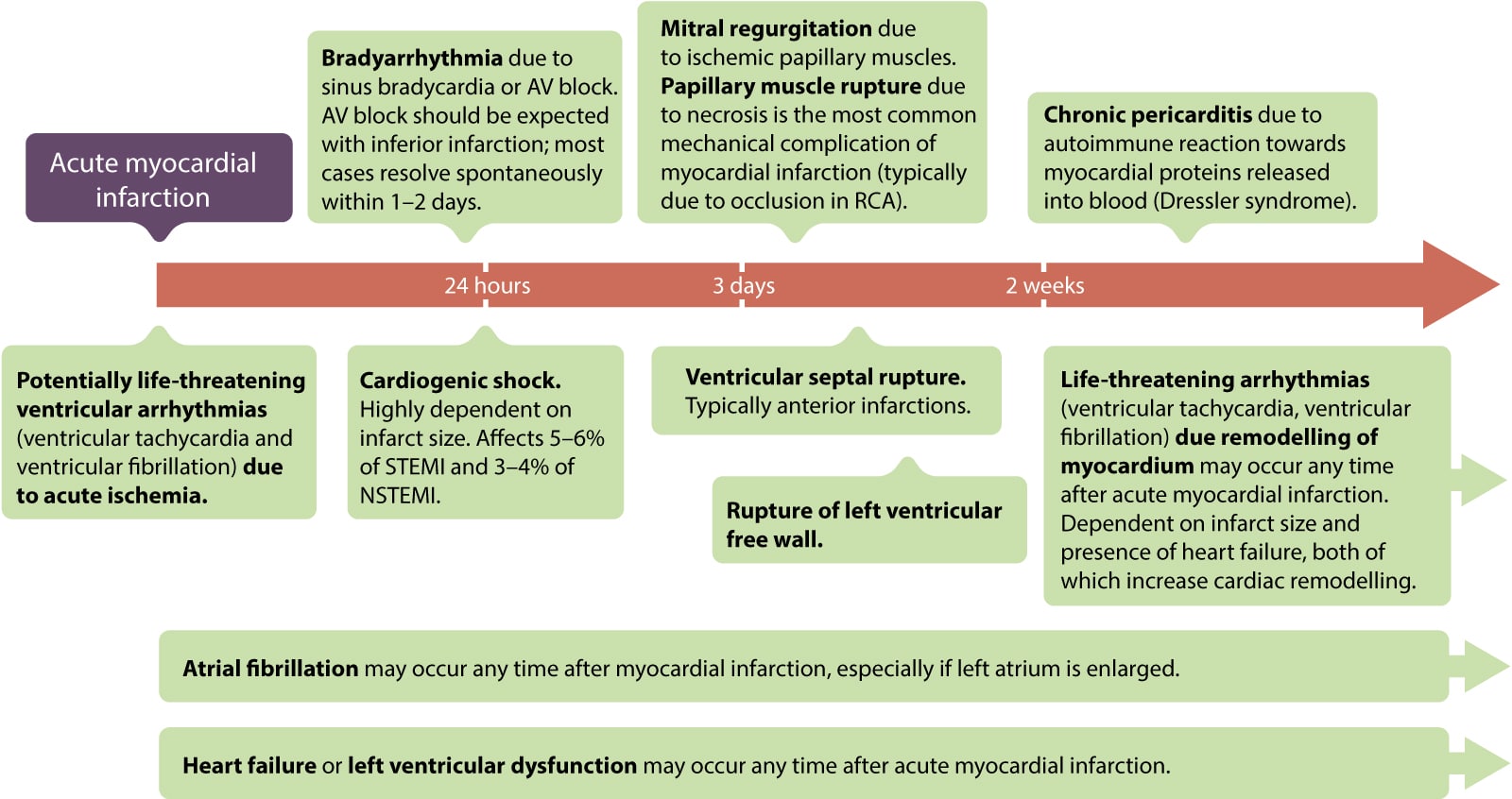
Akutte og langsiktige komplikasjoner ved akutt STEMI
Komplikasjoner inndeles i elektriske (arytmier), mekaniske (ruptur, svikt) og trombotiske.
- Elektriske: Ventrikkelflimmer (VF) og ventrikkeltakykardi (VT) er hyppigst i de første timene. Bradyarytmier (AV-blokk) sees ofte ved inferiore infarkter (grunnet iskemi i AV-knuten eller Bezold-Jarisch refleks).
- Mekaniske: Papillarmuskelruptur (gir akutt mitralinsuffisiens og lungeødem), ventrikkelseptumdefekt (VSD) og friveggsruptur (gir hjertetamponade og elektromekanisk dissosiasjon) er sjeldne (<1 %), men katastrofale komplikasjoner som krever øyeblikkelig kirurgi.
- Hjertesvikt og kardiogent sjokk: Omfattende myokardskade kan føre til pumpesvikt. Kardiogent sjokk er den ledende dødsårsaken hos pasienter som når sykehuset i live.
- Venstre ventrikkel-trombe: Ved store anteriore infarkter med apikal akinesi er det risiko for trombedannelse i venstre ventrikkel, som kan gi systemiske embolier (hjerneslag). Disse pasientene trenger antikoagulasjon (Marevan eller DOAK) i 3-6 måneder.
Killip-klassifikasjon ved akutt hjerteinfarkt
For å vurdere alvorlighetsgraden av hjertesvikt i akuttfasen, benyttes ofte Killip-klassifikasjonen. Den er en sterk prediktor for overlevelse.
| Killip Klasse | Kliniske funn | Estimert dødelighet (historiske data) |
|---|---|---|
| I | Ingen tegn til hjertesvikt (ingen knatrelyder, ingen 3. hjertetone) | 6% |
| II | Hjertesvikt (knatrelyder over <50% av lungefeltene, halsvenestuvning, 3. hjertetone) | 17% |
| III | Lungeødem (knatrelyder over >50% av lungefeltene) | 38% |
| IV | Kardiogent sjokk (hypotensjon, perifer vasokonstriksjon, oliguri) | 81% |
Papillarmuskelruptur (PMR) ved akutt hjerteinfarkt
Papillarmuskelruptur (PMR) er en dramatisk komplikasjon som oftest rammer posteromediale papillarmuskel ved inferiore/bakre infarkter (forsynt av RCA eller RCX), da denne muskelen kun har én blodforsyning. Anterolaterale papillarmuskel har dobbel blodforsyning (LAD og RCX) og rupturerer sjelden. Klinisk bilde er akutt innsettende lungeødem og sjokk. Systolisk bilyd kan være tilstede, men er av og til ikke hørbar ved rask trykkutjevning i venstre atrium. Øyeblikkelig ekkokardiografi er diagnostisk.
EKG ved akutt STEMI (ST-elevasjonsinfarkt)
Standard 12-avlednings EKG er gullstandarden. ST-elevasjon måles i J-punktet. Definisjonen krever signifikant elevasjon i minst to anatomisk sammenhengende avledninger. Det er viktig å merke seg kjønnsforskjeller i V2-V3.
Panel 1: EKG-kriterier for diagnostisering av akutt STEMI
- Nye ST-elevasjoner i minst to anatomisk sammenhengende avledninger:
- Menn ≥40 år: ≥2 mm (0,2 mV) i V2-V3 og ≥1 mm i andre avledninger.
- Menn <40 år: ≥2,5 mm i V2-V3 og ≥1 mm i andre avledninger.
- Kvinner (alle aldre): ≥1,5 mm i V2-V3 og ≥1 mm i andre avledninger.
- Høyre ventrikkel (V4R): ≥0,5 mm (≥1 mm hos menn <30 år). Indisert ved inferior STEMI og hypotensjon.
- Bakre vegg (V7-V9): ≥0,5 mm. Indisert ved resiproke senkninger i V1-V3.
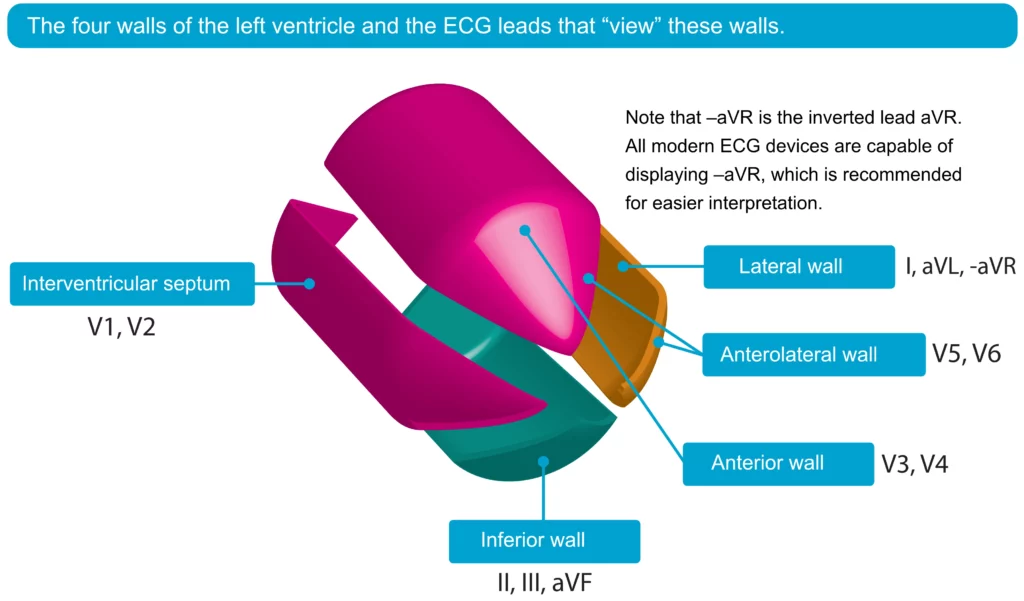
EKG-lokalisasjon gir informasjon om hvilken arterie som er okkludert (Culprit lesion):
- Anterior: ST-elevasjon i V1-V6 (LAD-okklusjon).
- Inferior: ST-elevasjon i II, III, aVF (RCA eller RCX).
- Lateral: ST-elevasjon i I, aVL, V5-V6 (RCX eller diagonal gren av LAD).
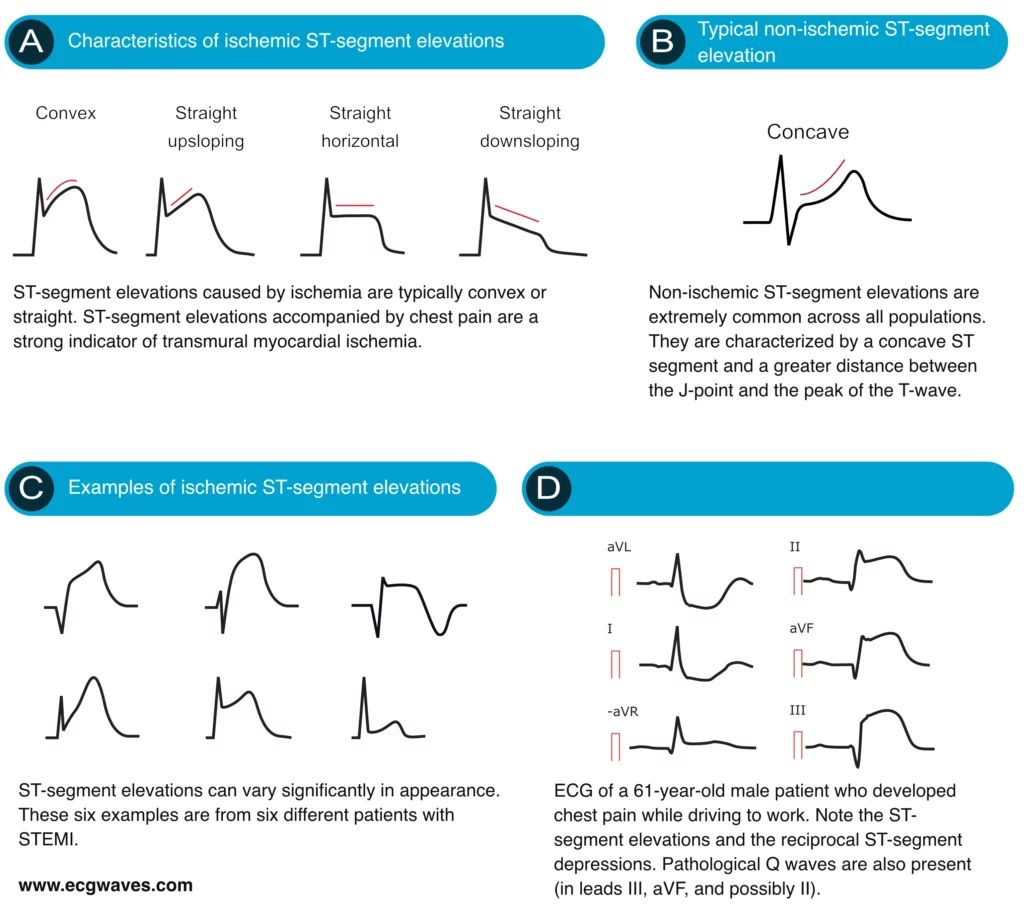
Kjennetegn ved iskemiske ST-elevasjoner
En viktig distinksjon er ST-segmentets morfologi. Iskemiske elevasjoner er ofte konvekse (buler oppover) eller flate, mens benigne elevasjoner (som ved perikarditt eller tidlig repolarisering) ofte er konkave (hengekøye-form). Dette er en tommelfingerregel, ikke en absolutt sannhet.
Andre årsaker til ST-elevasjoner
Differensialdiagnostikk er kritisk for å unngå feilbehandling (f.eks. trombolyse ved aortadisseksjon). De viktigste differensialdiagnosene inkluderer:
Panel 2. Differensialdiagnoser ved ST-elevasjoner
- Tidlig repolarisering (benign, ofte unge menn)
- Perikarditt (diffuse elevasjoner, PR-senkning)
- Venstre grenblokk (LBBB)
- Venstre ventrikkelhypertrofi (LVH)
- Hyperkalemi
- Brugadas syndrom
- Lungeemboli (S1Q3T3, høyrebelastning)
- Aortadisseksjon (kan dissekere inn i koronararterier og gi ekte STEMI)
- Takotsubo-kardiomyopati
- Prinzmetals angina (spasme)
Reciproke ST-senkninger
Tilstedeværelse av resiproke (speilvendte) ST-senkninger i motsatte avledninger styrker diagnosen STEMI betydelig og utelukker ofte perikarditt. For eksempel vil inferior STEMI (II, III, aVF) ofte ha resiproke senkninger i aVL og I.
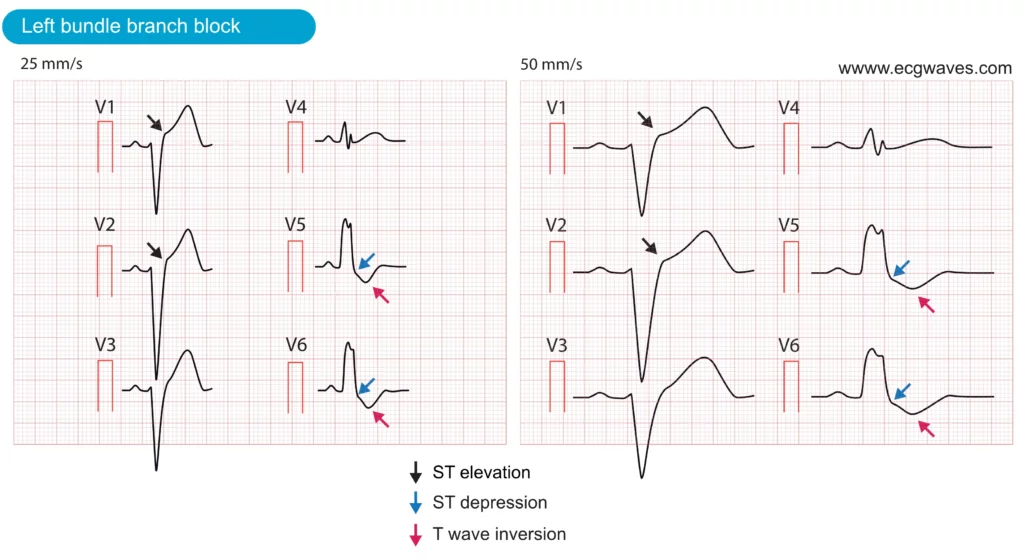
Spesielle hensyn: LBBB og RBBB
Venstre grenblokk (LBBB) og høyre grenblokk (RBBB)
Historisk har nytt venstre grenblokk (LBBB) blitt likestilt med STEMI. Nyere retningslinjer (ESC 2023) presiserer at:
- Pasienter med mistenkt iskemi og LBBB skal håndteres som STEMI uavhengig av om blokket er kjent nytt eller gammelt, dersom klinikken er overbevisende og pasienten er hemodynamisk ustabil.
- Høyre grenblokk (RBBB): Nytt RBBB i kombinasjon med brystsmerter kan indikere proksimal LAD-okklusjon eller hovedstamme-okklusjon og har dårlig prognose. Retningslinjene anbefaler nå at pasienter med vedvarende iskemiske symptomer og RBBB også vurderes for primær PCI på lik linje med STEMI.
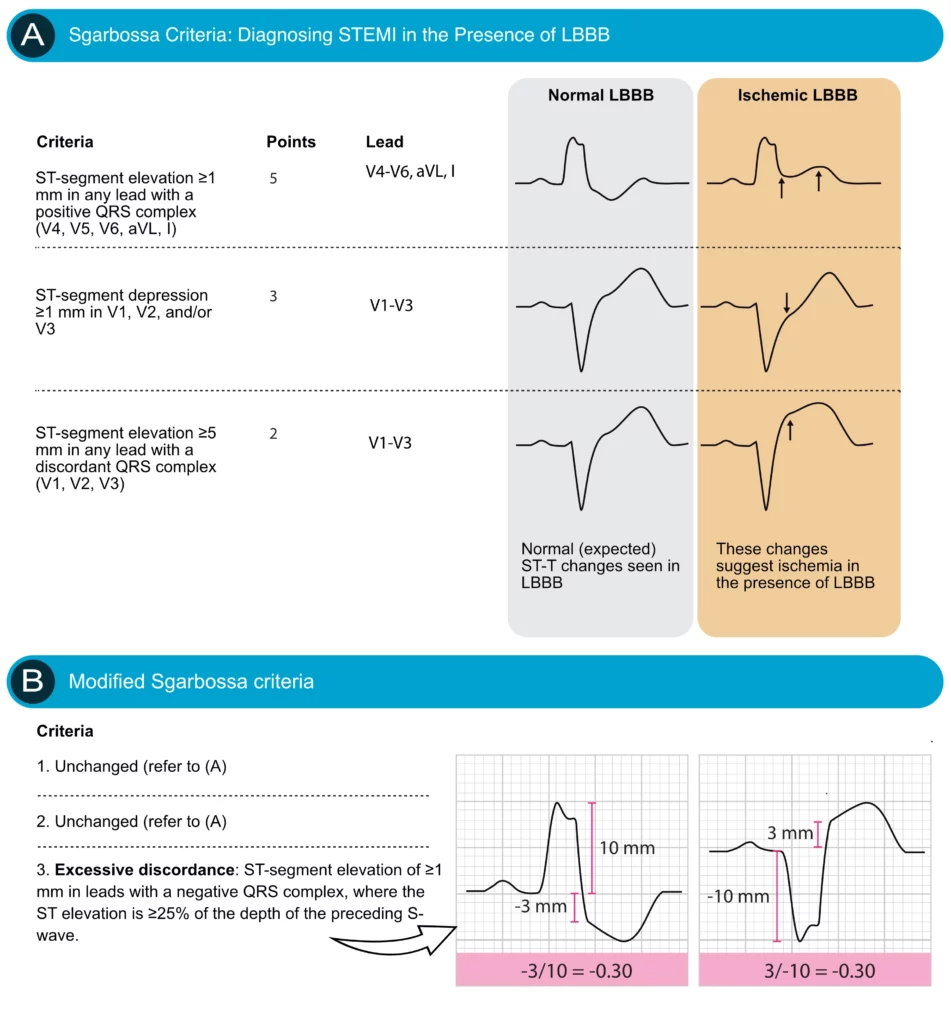
Diagnostikk av STEMI ved eksisterende LBBB er vanskelig på grunn av sekundære ST-forandringer («diskordans»). Sgarbossa-kriteriene (eller Smith-modifiserte Sgarbossa-kriterier) brukes for å identifisere «konkordante» forandringer som tyder på akutt infarkt.
Sgarbossa-kriterier (Forenklet)
- Konkordant ST-elevasjon ≥1 mm i avledning med positiv QRS (5 poeng).
- Konkordant ST-senkning ≥1 mm i V1-V3 (3 poeng).
- Diskordant ST-elevasjon ≥5 mm (2 poeng) (Mindre spesifikt, Smith-modifisert kriterium med ST/S ratio < -0.25 er bedre).
Behandling av pasienter med STEMI
Tid er muskel. Behandlingen starter prehospitalt og fortsetter på sykehus.
Den prehospitale fasen
Målet er rask diagnose (12-avlednings EKG), smertelindring og triagering direkte til PCI-senter. Ved transporttid >120 minutter til PCI, skal prehospital trombolyse vurderes (farmako-invasiv strategi).
Evidensbasert behandling av STEMI
Oksygen
Kun ved hypoksi (SpO2 <90 %). Rutinemessig oksygen til normoksiske pasienter er potensielt skadelig (vasokonstriksjon).
Smertebehandling
Morfin
Morfin 2,5-5 mg i.v. titrert til effekt.
Morfin reduserer smerte og angst, og gir venodilatasjon som avlaster hjertet. OBS: Morfin kan forsinke opptaket av perorale platehemmere (klopidogrel/ticagrelor/prasugrel) grunnet redusert ventrikkeltømming. Ved kvalme gis antiemetika (f.eks. metoklopramid).
Nitrater (Nitroglyserin)
Nitroglyserin 0,4 mg sublingualt ved brystsmerter. Forsiktighet ved hypotensjon og inferior infarkt (høyre ventrikkel-affeksjon).
Kontraindisert dersom pasienten har brukt PDE5-hemmere (Sildenafil/Viagra etc.) siste 24-48 timer, da dette kan gi refraktær hypotensjon.
Betablokkere
Akutt bruk
Intravenøs betablokker (f.eks. Metoprolol) kan vurderes ved ankomst PCI-senter hos hemodynamisk stabile pasienter (høyt blodtrykk, takykardi), men bør unngås ved tegn til hjertesvikt, hypotensjon eller risiko for sjokk.
Langtidsbruk
Rutinemessig bruk av betablokkere etter hjerteinfarkt har vært standard, men nyere studier (REDUCE-AMI, 2024) sår tvil om nytten hos pasienter med bevart venstre ventrikkelfunksjon (EF ≥50 %). Betablokkere er fortsatt indisert hos alle med redusert EF (≤40 %) eller systolisk hjertesvikt.
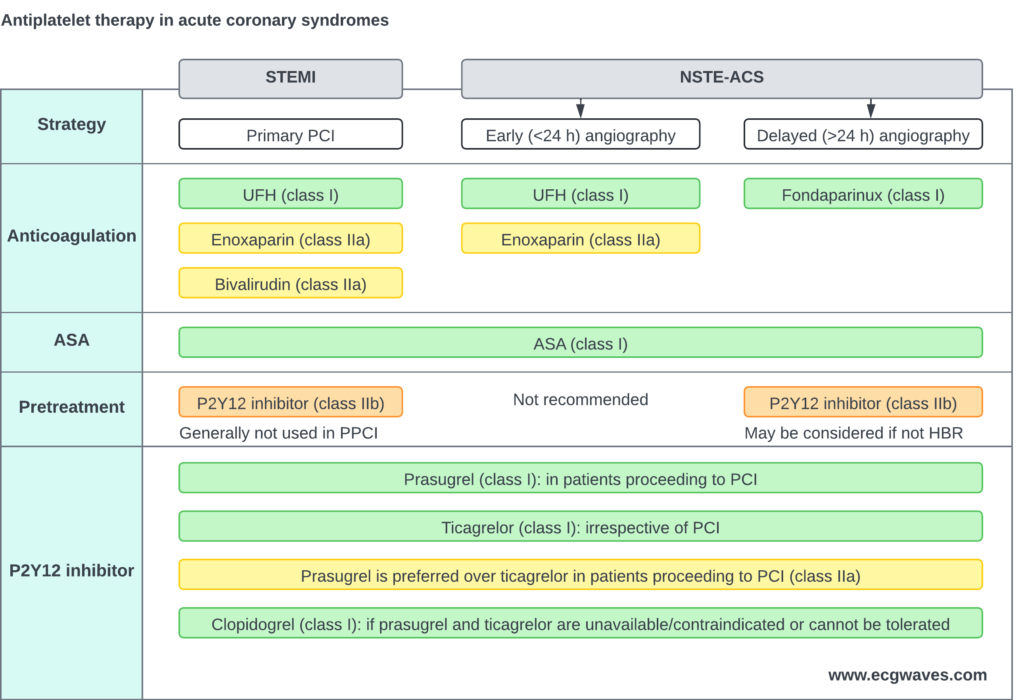
Antitrombotisk behandling
Aspirin (ASA)
Ladningsdose 300 mg (tyggetablett eller i.v.) umiddelbart. Vedlikehold 75 mg x 1 livslangt.
Dobbel platehemmende behandling (DAPT)
P2Y12-hemmere
Standardbehandling er ASA + en potent P2Y12-hemmer (Ticagrelor eller Prasugrel) i 12 måneder.
- Ticagrelor (Brilique): Ladning 180 mg, vedlikehold 90 mg x 2. Førstevalg i mange retningslinjer.
- Prasugrel (Efient): Ladning 60 mg, vedlikehold 10 mg x 1. Ofte foretrukket ved PCI (ISAR-REACT 5 studien), men kontraindisert ved tidligere slag.
- Klopidogrel (Plavix): Ladning 600 mg. Kun hvis potente hemmere er kontraindisert (høy blødningsrisiko) eller ved trombolyse.
Forbehandling («Pre-loading»)
Ved STEMI gis vanligvis P2Y12-hemmer så tidlig som mulig (prehospitalt eller ved ankomst), i motsetning til NSTEMI hvor man ofte venter til koronar anatomi er kjent.
Antikoagulasjon
Ufraksjonert heparin (UFH) i.v. er standard under PCI (bolus 70-100 IE/kg).
Bivalirudin eller Enoksaparin er alternativer, men UFH er mest brukt i Norge.
Reperfusjon: Primær PCI vs. Fibrinolyse
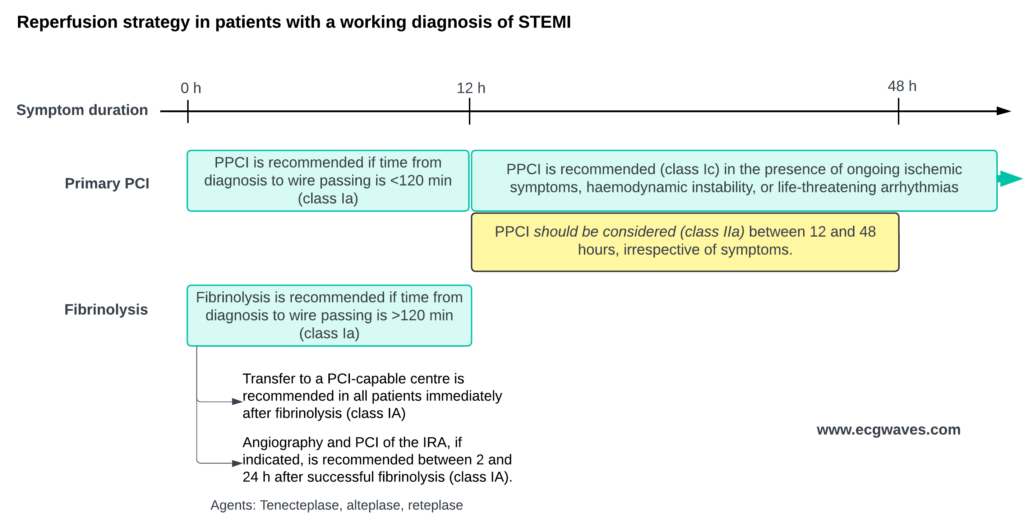
120-minutters regelen:
Dersom forventet tid fra diagnose (EKG) til åpning av kar (trådpassasje) er <120 minutter: Velg Primær PCI.
Dersom tid >120 minutter: Gi Fibrinolyse (Tenecteplase) umiddelbart (innen 10 min), og overfør deretter pasienten til PCI-senter for angiografi (Rescue PCI hvis mislykket, ellers rutineangiografi innen 2-24 timer).
Lipidsenkende behandling og sekundærforebygging
Etter STEMI er aggressiv risikofaktorintervensjon avgjørende for å forhindre nye hendelser.
Kolesterolsenkning
Høydose statin (f.eks. Atorvastatin 80 mg) startes umiddelbart hos alle, uavhengig av inngangsverdi på LDL.
Målsetting (ESC 2019/2023): LDL-kolesterol skal senkes til <1,4 mmol/L og med minst 50 % fra utgangsverdi. Dersom målet ikke nås med statin alene etter 4-6 uker, legges Ezetimib til. Ved manglende måloppnåelse vurderes PCSK9-hemmere.
Andre tiltak
- Røykeslutt: Det mest effektive enkelttiltaket.
- Rehabilitering: Alle bør henvises til hjerterehabilitering.
- ACE-hemmere/ARB: Indisert ved hjertesvikt (EF <40 %), diabetes eller hypertensjon.
Førerkortforskrifter
Pasienter med STEMI ilegges vanligvis et kjøreforbud på minimum 2 uker (Gruppe 1, privatbil) forutsatt ukomplisert forløp og bevart hjertefunksjon. Ved tyngre førerkortklasser (Gruppe 2 og 3) gjelder strengere regler og krav om 6 ukers karenstid samt spesialistattest.
Referanser
1. Ducas, J., et al. «Outcomes of a Pre-Hospital Diagnosis and Catheter Laboratory Activation Program for ST Elevation Myocardial Infarction» Journal of the American College of Cardiology, vol. 53, nr. 4, 2009, s. 246-252.
2. Byrne, R. A., et al. «2023 ESC Guidelines for the management of acute coronary syndromes» European Heart Journal, 2023.
3. Sgarbossa, E. B., et al. «Electrocardiographic Diagnosis of Evolving Acute Myocardial Infarction in the Presence of Left Bundle-Branch Block» The New England Journal of Medicine, vol. 334, nr. 8, 1996, s. 481-487.
4. Smith, S. W., et al. «Diagnosis of ST-Elevation Myocardial Infarction in the Presence of Left Bundle Branch Block With the ST-Elevation to S-Wave Ratio in a Modified Sgarbossa Rule» Annals of Emergency Medicine, vol. 60, nr. 6, 2012, s. 766-776.
5. Yndigegn, T., et al. (REDUCE-AMI) «Beta-Blockers after Myocardial Infarction and Preserved Ejection Fraction» New England Journal of Medicine, 2024.
6. Thygesen, K., Alpert, J. S., et al. «Fourth Universal Definition of Myocardial Infarction (2018).» Circulation, 138 (20), e618-e651.
7. Ibanez, B., et al. «2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation.» European Heart Journal.