Forutsigelse av plutselig hjertestans
Formålet med å oppdage og måle risikofaktorer er å få et presist estimat av risikoen, skreddersy behandlingen i henhold til denne risikoen og overvåke pasienten prospektivt. Sterke risikofaktorer fungerer som nyttige variabler i kliniske prediksjonsmodeller. Det har vært svært vellykket å fokusere på modifiserbare risikofaktorer i primær- og sekundærforebygging av aterosklerotisk hjerte- og karsykdom, både på befolknings- og individnivå. Flere prediksjonsmodeller, som SCORE2 og diverse risikoskårer for atrieflimmer (CHA2DS2-VASc), er utviklet og validert for prediksjon av hjertesvikt, koronarsykdom, akutt koronarsyndrom og hjerneslag (Steyerberg et al.). Det har imidlertid vist seg å være betydelig vanskeligere å oppnå tilsvarende presisjon når det gjelder prediksjon av plutselig hjertestans, spesielt i den generelle befolkningen.
Plutselig hjertestans er den mest dødelige manifestasjonen av hjerte- og karsykdom, og står for omtrent 50 % av alle kardiovaskulære dødsfall (Tsao et al.). En nylig utført metaanalyse viste at overlevelsen frem til utskrivning fra sykehus kun er 8,8 %, og overlevelsen etter 30 dager er 10,7 % ved hjertestans utenfor sykehus (Yan et al.). Den lave overlevelsen gjenspeiler tilstandens plutselige og hyperakutte karakter, hvor tidsvinduet for vellykket intervensjon er minimalt. Dette har fått forskere til å intensivere arbeidet med å utvikle strategier og verktøy for langsiktig forebygging og tidlig identifikasjon av høyrisikopasienter. Dessverre har disse forsøkene så langt hatt begrenset suksess i populasjonsstudier. Vår nåværende evne til å forutsi hjertestans hos individer uten kjent hjertesykdom er i beste fall dårlig.
En viktig forklaring på denne utfordringen er at plutselig hjertestans og død ofte er en stokastisk (tilfeldig) hendelse som krever et samspill mellom substrat og trigger. Denne tilfeldigheten har forundret forskere i over 80 år. Dette ble treffende uttrykt allerede i 1961 av Beck et al. i Journal of American Medical Association (JAMA):
[…] Av hver tiende av disse ofrene viste hjertet hos 6 eller 7 ingen nylig sykdom i kransarteriene eller i hjertemuskelen. Med andre ord er hjertet i dag anatomisk sett det samme som det var i går, bortsett fra at det utviklet seg en elektrisk ladning som fikk hjertet til å fibrillere. Denne elektriske faktoren kom og drepte og forsvant og ble ikke funnet i det døde hjertet. Dødsårsaken hos disse ofrene kan ikke forklares ut fra sykelig anatomi. Dette er ikke en ny erfaring verken for patologen eller indremedisineren. At det er noe som mangler i vår forståelse av denne problematikken, viser seg når døden inntreffer etter at offeret er «friskmeldt» og uten dødsårsaksforklaring […]
Det er bare i en liten og svært selektert undergruppe av pasienter at det er mulig å gjøre fornuftige prediksjoner med høy treffsikkerhet. Dette gjelder primært pasienter med etablert strukturell hjertesykdom og betydelig redusert venstre ventrikkelfunksjon, noe som ligger til grunn for dagens retningslinjer for implantasjon av ICD-er (implanterbar kardioverterdefibrillator). Vår manglende evne til å forutsi hjertestans i bredere grupper er tydelig på mange måter. Her følger noen kliniske paradokser:
- Moderne ICD-er er svært effektive og i stand til å terminere over 99 % av maligne ventrikulære takyarytmier. Teoretisk sett kan ICD-er forhindre nesten alle tilfeller av plutselig hjertedød forårsaket av VT/VF (som utgjør flertallet av tilfellene). Likevel er det bare en ubetydelig andel av alle hjertestansofre som har en ICD implantert på tidspunktet for hendelsen. De fleste kandidater identifiseres ikke før det er for sent.
- Omtrent halvparten av alle som rammes av hjertestans, har ingen tidligere erkjent hjerte- og karsykdom. For mange er hjertestans den aller første manifestasjonen av koronarsykdom. Plutselig hjertedød utgjør 40-70 % av alle dødsfall som skyldes koronarsykdom (Kannel et al., Demirovic et al.).
Som beskrevet av Myerburg et al. og Marijon et al., er langsiktig forebygging av hjertestans på befolkningsnivå svært vanskelig på grunn av den lave insidensen i den generelle befolkningen (Rose-paradokset). Fremtidig innsats kan være mer vellykket ved å fokusere på kortsiktig prediksjon ved hjelp av smarte enheter (wearables), kontinuerlig rytmeovervåking og kunstig intelligens som kan oppdage subtile fysiologiske endringer forut for en hendelse (Marijon et al.).
Forholdet mellom substrat og transiente triggere
Den stokastiske (tilfeldige) naturen til plutselig hjertestans ligner på noen måter patofysiologien ved akutt koronarsyndrom. Et akutt koronarsyndrom er resultatet av et «perfekt storm»-scenario, der ruptur eller erosjon av et aterosklerotisk plakk sammenfaller med et protrombogent miljø i blodet (trombocytter, koagulasjonsfaktorer, endotelfunksjon osv.). Den perfekte stormen innebærer at plakkforstyrrelser oppstår nøyaktig når protrombogene faktorer oppveier de endogene fibrinolytiske faktorene. Balansen mellom disse faktorene varierer fra minutt til minutt. Bare et mindretall av alle plakkforstyrrelser resulterer i okkluderende tromber og klinisk infarkt; flertallet av plakkrupturer er faktisk asymptomatiske og tilheles spontant (Arbab-Zadeh et al.).
Fremveksten av livstruende ventrikulære takyarytmier følger de samme prinsippene. Det kreves ofte et anatomisk eller elektrofysiologisk substrat (f.eks. arrvev etter infarkt, fibrose, eller ionekanalfeil) som gjøres ustabilt av transiente triggere. Her motvirkes proarytmogene faktorer av antiarytmogene forsvarsmekanismer. Eksempler på slike triggere er akutte endringer i elektrolyttkonsentrasjoner (spesielt kalium og magnesium), økt sympatisk tonus, akutt myokardiskemi, pH-endringer, medikamentpåvirkning (QT-forlengende legemidler) og hemodynamisk stress.
De multifaktorielle prosessene som kulminerer i plutselig hjertestans, krever vanligvis at man tilegner seg et arytmogent substrat som er i stand til å generere og opprettholde takyarytmier under spesifikke (ofte forbigående) forhold, som vist i figur 1.
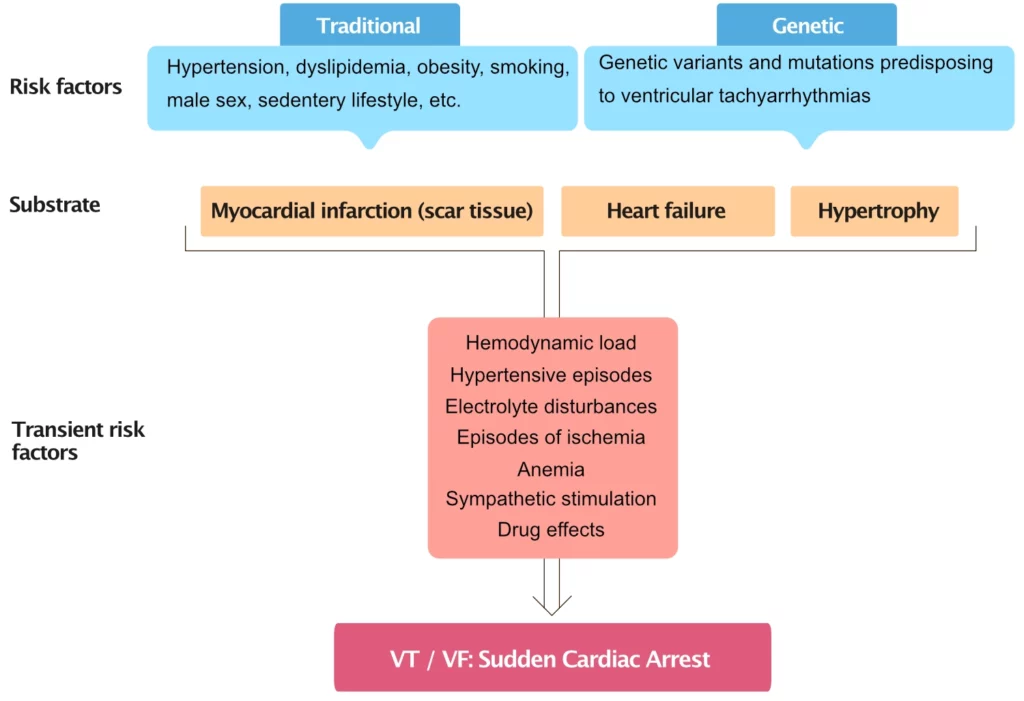
Tradisjonelle kardiovaskulære risikofaktorer
Tradisjonelle kardiovaskulære risikofaktorer (diabetes mellitus, arteriell hypertensjon, dyslipidemi, røyking, fysisk inaktivitet, abdominal fedme osv.) er også sterke risikofaktorer for plutselig hjertestans. Risikoen for plutselig hjertestans er klart assosiert med den totale byrden av risikofaktorer. Deltakere i høyrisikodecilen i Framingham-studien hadde 14 ganger økt risiko for plutselig hjertedød sammenlignet med lavrisikodecilen. Mekanismen er primært indirekte: disse risikofaktorene akselererer aterosklerose og remodeling av venstre ventrikkel, som igjen skaper de underliggende substratene for hjertestans (hjerteinfarkt, iskemi, hjertesvikt, hypertrofi og fibrose).
Disse risikofaktorene har med hell blitt målrettet gjennom primærforebygging (livsstilsendringer og medikamentell behandling), noe som sannsynligvis har bidratt til å redusere forekomsten av hjertestans i befolkningen ved å redusere insidensen av akutt hjerteinfarkt og hjertesvikt (Nabel et al.).
Uoverensstemmelse mellom relativ og absolutt risiko
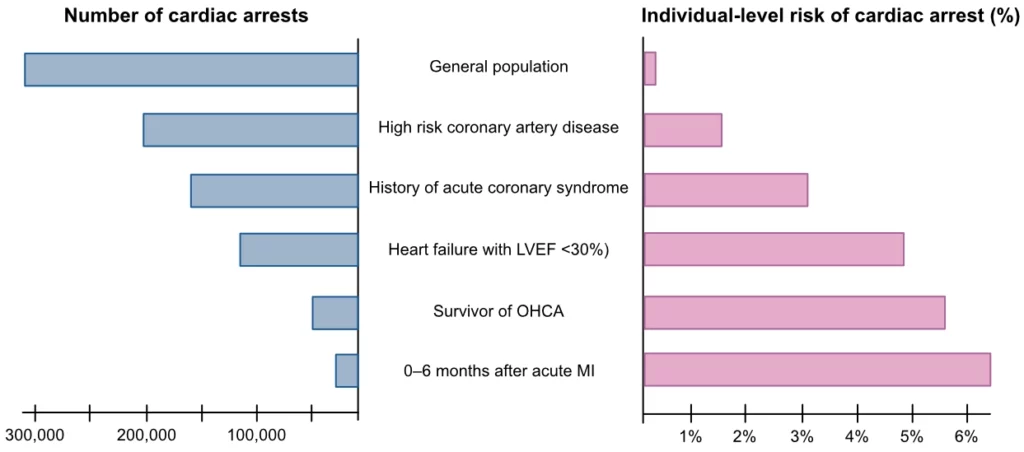
En av de største utfordringene med å identifisere personer med høy risiko er den markante uoverensstemmelsen mellom relativ risiko og populasjonstilskrivbar fraksjon (PAF). Dette er illustrert i figur 2 (tilpasset fra Myerburg et al.), som viser at det store flertallet av alle hjertestansene skjer i den generelle befolkningen, blant personer med lav til moderat individuell risiko for hjertestans. Den relative risikoen for hjertestans er svært lav i den generelle befolkningen (ca. 0,1 % per år), men siden denne gruppen er enormt stor, vil det totale antallet hjertestans her langt overstige antallet hendelser i de definerte høyrisikogruppene.
De sistnevnte, som først og fremst består av personer med kjent koronarsykdom, tidligere hjerteinfarkt og hjertesvikt med redusert ejeksjonsfraksjon, har en meget høy relativ risiko for hjertestans (opp mot 10-20 % over tid), men utgjør få absolutte tilfeller i et folkehelseperspektiv på grunn av den lille størrelsen på disse underpopulasjonene. Dette betyr at strategier som kun retter seg mot høyrisikopasienter (f.eks. med ICD) vil ha begrenset effekt på den totale forekomsten av plutselig død i samfunnet.
Oversikt over risikofaktorer for hjertestans
- Alder – Risikoen for hjertestans følger en bimodal fordeling; den er høyere i det første leveåret (krybbedød/SIDS), lav i barndommen, og øker deretter markant etter 45 års alder. Fra 35-årsalderen er koronarsykdom den desidert viktigste årsaken til hjertestans i vestlige land. Hos yngre (< 35 år) dominerer arvelige kardiomyopatier og kanalopatier.
- Mannlig kjønn – Menn har betydelig høyere risiko for hjertestans enn kvinner gjennom hele livet, en forskjell som delvis, men ikke fullt ut, forklares av høyere forekomst av koronarsykdom hos menn. Omtrent 65–70 % av alle hjertestanstilfeller inntreffer blant menn.
- Døgnvariasjon – Det er en tydelig døgnvariasjon med økt risiko for hjertestans om morgenen (etter oppvåkning), noe som sammenfaller med økt sympatisk aktivitet og plateaggregasjon. Risikoen er også høyere på mandager og i vintermånedene. Kaldt vær øker belastningen på hjertet, mens heteslag også representerer en risiko.
- Miljø og psyke – Luftforurensning (partikler) er assosiert med økt risiko for akutt hjerteinfarkt og hjertestans. I tillegg kan akutt, alvorlig psykososialt stress fungere som en trigger.
- Hjerte- og karsykdommer – Personer med etablert koronar hjertesykdom, hjertesvikt, kardiomyopati (dilatert, hypertrofisk, arytmogen) eller alvorlig hjerteklaffsykdom (spesielt aortastenose) har økt risiko. Ved akutt hjerteinfarkt er risikoen for ventrikulære arytmier (VF/VT) høyest i løpet av den første timen (prehospital fase), for deretter å avta raskt etter reperfusjon og stabilisering.
- Kardiovaskulære risikofaktorer – Hypertensjon (spesielt venstre ventrikkelhypertrofi), diabetes, røyking, obstruktiv søvnapné, fedme og dyslipidemi øker risikoen gjennom strukturelle endringer i hjertet og aterosklerose.
- Alkoholforbruk – Forholdet mellom alkohol og risiko følger sannsynligvis en J-kurve. Et moderat forbruk kan være nøytralt eller lett beskyttende (via iskemiredusksjon), mens høyt forbruk og «binge drinking» øker risikoen for arytmier («holiday heart», atrieflimmer som kan degenerere, samt alkoholisk kardiomyopati).
- Genetikk og syndromer – En familiehistorie med plutselig død i ung alder er en sterk risikofaktor. Spesifikke tilstander inkluderer Brugadas syndrom, Lang QT-tid-syndrom (LQTS), Kort QT-tid-syndrom, Tidlig repolariseringssyndrom (ERS) med maligne trekk, katekolaminerge polymorfe ventrikulære takykardier (CPVT) og arytmogen høyre ventrikkel-kardiomyopati (ARVC).
Ejeksjonsfraksjon i venstre ventrikkel
Den sterke sammenhengen mellom venstre ventrikkels ejeksjonsfraksjon (LVEF) og risikoen for plutselig hjertestans har vært kjent i flere tiår (Bigger et al.). LVEF er per i dag den viktigste parameteren for risikostratifisering i kliniske retningslinjer. MADIT II-studien og SCD-HeFT viste at implantasjon av en ICD hos personer med LVEF ≤ 30–35 % (både iskemisk og non-iskemisk etiologi) reduserte dødeligheten signifikant.
Dette har ført til gjeldende anbefalinger (f.eks. fra ESC) om at pasienter med symptomatisk hjertesvikt (NYHA-klasse II–III) og LVEF ≤ 35 %, til tross for optimal medisinsk behandling i minst 3 måneder, bør vurderes for ICD som primærforebygging. Slike brede anbefalinger øker uunngåelig antall pasienter som må behandles (Number Needed to Treat – NNT) for å redde ett liv, da mange med lav LVEF aldri utvikler arytmier.
Samtidig er LVEF en ufullkommen prediktor. Flertallet av pasienter som dør plutselig har faktisk en LVEF > 35 %. I DANISH-studien, som undersøkte effekten av ICD ved non-iskemisk kardiomyopati, fant man ingen signifikant reduksjon i totaldødelighet ved ICD-implantasjon hos alle pasienter, selv om risikoen for plutselig død ble redusert. Dette understreker behovet for bedre seleksjonskriterier utover bare LVEF, spesielt ved non-iskemisk sykdom. Dessuten er den dominerende metoden for måling av LVEF – ekkokardiografi – operatøravhengig og mindre reproduserbar enn hjerte-MR (CMR) eller hjerte-CT.
Betydningen av myokardfibrose (Scar)
Nyere forskning peker mot at påvisning av myokardfibrose ved hjelp av hjerte-MR og «Late Gadolinium Enhancement» (LGE) er en sterkere og mer spesifikk prediktor for ventrikulære arytmier enn LVEF alene. Omfanget og lokalisasjonen av arrvev (scar) gir substratet for re-entry-takykardier. Spesielt ved dilatert kardiomyopati og hypertrofisk kardiomyopati tillegges nå LGE stor vekt i risikovurderingen.
Andre risikofaktorer for hjertestans
- Treningskapasitet (målt som VO2 max) anses som en sterk prediktor for kardiovaskulær helse. Lav fysisk yteevne er assosiert med økt dødelighet.
- Fysisk aktivitet bør generelt ikke regnes som en risikofaktor for hjertestans, men snarere som beskyttende over tid. Risikoen for å få hjertestans under selve den fysiske aktiviteten er ekstremt liten (<1/1 000 000 treningstimer). Utrente personer som gjør plutselige, meget kraftige fysiske anstrengelser, har imidlertid en forbigående økt risiko (Albert et al.). Det anbefales derfor at inaktive personer øker treningsbelastningen gradvis over flere måneder.
- EKG-forandringer og ledningsdefekter: Intraventrikulære ledningsdefekter som venstre grenblokk (LBBB) og utvidet QRS-bredde (>120-150 ms) er markører for elektrisk dyssynkroni og strukturell sykdom, og er assosiert med økt risiko. Andre markører inkluderer fragmenterte QRS-komplekser, T-bølge alternans (sjelden brukt klinisk nå) og patologisk QT-tid.
- Størrelsen på hjerteinfarktet: Omfanget av nekrose påvirker risikoen for hjertestans i både den akutte, subakutte og kroniske fasen (Goldberger et al.). Store fremre veggs-infarkter som resulterer i hjertesvikt og aneurismer, er spesielt utsatt for å utvikle maligne arytmier.
- Monomorf ikke-vedvarende ventrikulær takykardi (nsVT) og ventrikulære ekstrasystoler (VES): Disse regnes ofte som godartede hvis pasienten har et strukturelt normalt hjerte. Hos pasienter med hjertesvikt eller etter infarkt kan imidlertid nsVT være en forløper til vedvarende VT/VF.
- Polymorf VT: Dette er en svært alvorlig arytmi som indikerer akutt iskemi, kanalopatier eller alvorlig elektrolyttforstyrrelse, og er en sterk risikofaktor for umiddelbar hjertestans.
- Ventrikulære ekstrasystoler under belastning: VES og ikke-vedvarende VT som induseres av fysisk anstrengelse (arbeids-EKG) indikerer økt risiko for hjertestans og mortalitet, i motsetning til VES som forsvinner ved belastning.
- Hyppige VES: En høy byrde av ventrikulære ekstrasystoler (>10/time eller >24% av totale hjerteslag) kan i seg selv indusere kardiomyopati, og etter hjerteinfarkt indikerer hyppige VES en elektrisk ustabilitet.
Referanser
Myerburg RJ, Junttila MJ. Plutselig hjertedød forårsaket av koronar hjertesykdom. Circulation. 2012.
Myerburg RJ, Castellanos A. Hjertestans og plutselig hjertedød. Man DL, Zipes DP, Libby P, Bonow RO. Braunwalds hjertesykdommer: En lærebok i kardiovaskulær medisin. 10th ed. Elsevier.
Myerburg RJ, Kessler KM, Castellanos A. Plutselig hjertedød: struktur, funksjon og tidsavhengighet av risiko. Circulation 1992;85 (suppl I):1-2,1-10.
Yoshinaga M, Kucho Y, Nishibatake M, et al. Sannsynligheten for å diagnostisere lang QT-syndrom hos barn og ungdom i henhold til kriteriene i HRS/EHRA/APHRS-ekspertkonsensusuttalelsen. Eur Heart J. 2016.
En fortelling om koronarsykdom og hjerteinfarkt Liste over forfattere. Elizabeth G. Nabel, M.D., og Eugene Braunwald, M.D. A Tale of Coronary Artery Disease and Myocardial Infarction Liste over forfattere. Elizabeth G. Nabel, M.D., og Eugene Braunwald, M.D.
Albert CM, Mittleman MA, Chae CU, et al. Utløsning av plutselig hjertedød ved kraftig anstrengelse. N Engl J Med. 2000.
Chugh SS, Reinier K, Singh T, et al. Determinanter for forlenget QT-intervall og deres bidrag til risikoen for plutselig død ved koronararteriesykdom: Oregon Sudden Unexpected Death Study. Circulation. 2009.
Towards better clinical prediction models: seven steps for development and an ABCD for validation Ewout W. Steyerberg, Yvonne Vergouwe European Heart Journal, Volume 35, Issue 29, 1 August 2014, Pages 1925-1931, https://doi.org/10.1093/eurheartj/ehu207
Demirovic J. Risikofaktorer i forekomsten av plutselig hjertedød og muligheter for forebygging. Doktoravhandling, University of Beograd Press, Beograd, YU. 1985.
Myerburg RJ. Implanterbare kardioverter-defibrillatorer etter hjerteinfarkt. N Engl J Med. 2008.
Goldberger JJ, Buxton AE, Cain M, et al. Risikostratifisering for arytmisk plutselig hjertedød: identifisering av veisperringene. Circulation. 2011.
Bigger JT, Fleiss JL, Kleiger R, Miller JP, Rolnitzky LM. Forholdet mellom ventrikulære arytmier, dysfunksjon i venstre ventrikkel og dødelighet i løpet av 2 år etter hjerteinfarkt. Sirkulasjon 1984;69:250-258. 46. Moss AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS, et al. Profylaktisk implantasjon av en defibrillator hos pasienter med hjerteinfarkt og redusert ejeksjonsfraksjon. N Engl J Med 2002;346:877-883.