Mekanismer for hjertearytmier: fra økt automatikk til re-entry
Mekanismer bak hjertearytmier: fra økt automatikk til re-entry
I denne delen presenteres de vanligste arytmiene som forekommer i klinisk praksis, med en innledende drøfting av de underliggende elektrofysiologiske mekanismene. For spesialister i indremedisin og kardiologi er en dypere forståelse av disse mekanismene avgjørende, ikke bare for diagnostikk, men også for å kunne velge rasjonell farmakologisk eller invasiv behandling. Selv om en detaljert molekylær forståelse ikke alltid er nødvendig i akuttmottaket, danner kunnskap om ionekanaler og ledningsprinsipper grunnlaget for moderne arytmibehandling. Mekanismer for arytmogenese omtales i dette kapittelet, etterfulgt av inngående drøftinger av spesifikke arytmier i de påfølgende kapitlene.
Hjertearytmier kan klassifiseres i følgende kategorier basert på frekvens og opprinnelse:
- Bradyarytmier (bradykardi) er arytmier som vanligvis skyldes dysfunksjon i pacemakercellenes automatiske aktivitet (f.eks. syk sinusknute) eller blokkering av impulser i ledningssystemet (f.eks. AV-blokk).
- Supraventrikulære takyarytmier (takykardier) er hurtige hjerterytmeforstyrrelser som oppstår som følge av impulser generert i atriene eller AV-knuten. Dette inkluderer tilstander som atrieflimmer, atrieflutter, atriale takykardier og AV-knute-avhengige takykardier (AVNRT/AVRT).
- Ventrikulære takyarytmier (ventrikulær takykardi) er hurtige og potensielt livstruende arytmier som oppstår som følge av elektriske impulser generert distalt for His-bunten, i ventrikkelmyokardiet eller His–Purkinje-systemet.
Denne klassifiseringen bidrar til å forenkle differensialdiagnostikken og den akutte behandlingen. Ettersom håndteringen av arytmier, særlig takyarytmier, ofte anses som utfordrende, er det viet egne kapitler til diagnostikk og behandling av disse. Anbefalingene som presenteres i dette avsnittet, er i samsvar med gjeldende retningslinjer fra European Society of Cardiology (ESC), American Heart Association (AHA) og American College of Cardiology (ACC), samt nasjonale faglige retningslinjer.
Definisjon av hjerterytme
En rytme defineres elektrokardiografisk som tre eller flere påfølgende hjerteslag med identiske bølgeformer på EKG, noe som indikerer at impulsene har samme opprinnelsessted og aktiveringsmønster. Sinusknuten (SA-knuten) fungerer som hjertets primære pacemaker under normale fysiologiske forhold, og den resulterende rytmen betegnes som sinusrytme. Sinusrytmen kjennetegnes ved positive P-bølger i avledningene I, II og aVF, noe som reflekterer at aktiveringen brer seg fra høyre atrium nedover og mot venstre.
En arytmi defineres som en unormal hjerterytme eller hjertefrekvens som ikke har en fysiologisk forklaring. Dette kriteriet er viktig, ettersom rytmer med fysiologisk årsak ikke bør klassifiseres som patologiske. Sinusbradykardi – en langsom rytme styrt av sinusknuten – er for eksempel et vanlig funn hos godt trente idrettsutøvere (økt vagal tonus) og under søvn, og bør i slike situasjoner ikke anses som unormal. Sinusbradykardi som oppstår under fysisk aktivitet (kronotrop inkompetanse) anses derimot som patologisk, ettersom hjertefrekvensen normalt skal øke under belastning for å møte kroppens metabolske behov.
Mekanismer bak hjertearytmier
Mekanismene som ligger til grunn for hjertearytmier, avdekkes i et stadig raskere tempo, noe som har gjort arytmologi til et felt med intensiv forskningsaktivitet. Denne utviklingen skyldes delvis fremveksten av avanserte hjerteavbildningsteknikker, 3D-mapping og invasive elektrofysiologiske metoder, som muliggjør detaljerte in vivo-studier av arytmier. Forståelsen av cellulære mekanismer, inkludert ionekanalopatier og kalsiumhåndtering i sarkoplasmatisk retikulum, har også vært avgjørende. Dette kapittelet fokuserer imidlertid på de kliniske aspektene ved arytmologi, med mål om å gi leseren en solid forståelse av de vanligste arytmiene. For en mer inngående drøfting av de underliggende molekylære mekanismene henvises det til spesialisert litteratur som Zipes et al.
Hovedårsaker til hjertearytmier
Arytmier oppstår når impulsdannelsen, impulsoverføringen (konduksjonen) eller begge disse prosessene er unormale. Disse forholdene omtales nedenfor i detalj.
Unormal impulsdannelse
Unormal impulsdannelse kan forårsake arytmier gjennom to hovedmekanismer, som skiller seg fra hverandre både elektrofysiologisk og med tanke på farmakologisk respons:
- Økt eller unormal automatikk (spontan depolarisering i fase 4)
- Utløst aktivitet (triggered activity)
Økt eller unormal automatikk
Som omtalt i kapittel 1 finnes det flere strukturer i hjertet med automatisk aktivitet (dvs. evne til spontan depolarisering). Grunnlaget for denne automatikken er en ustabil hvilemembranpotensial i fase 4 av aksjonspotensialet, hovedsakelig drevet av en innadgående strøm av natrium og kalium (funny current, $I_f$) via HCN-kanaler. Disse strukturene er:
- Sinoatrialknuten (SA-knuten) er hjertets primære pacemaker og initierer den elektriske impulsen som under normale fysiologiske forhold styrer hjerterytmen, kjent som sinusrytme.
- Deler av atrialt myokard: Rundt crista terminalis, ved inngangen til sinus coronarius og vena cava inferior, samt i lungeveneostiene, finnes det klynger av atriale myokardceller med evne til spontan depolarisering. Disse cellene er ofte opphavet til ektopiske atriale takykardier og initiering av atrieflimmer.
- Myokardiet som omgir atrioventrikulærknuten (AV-knuten): Det er en utbredt misforståelse at selve AV-knuten har egen automatikk, ettersom kompaktknuten primært forsinker impulsen. Det finnes imidlertid evidens som indikerer at celleklynger i overgangssonen rundt AV-knuten (junctional tissue) besitter automatikk. For enkelhets skyld vil denne automatikken – til tross for den presiseringen som er gitt – fortsatt bli omtalt som AV-knutens (eller junctional) automatikk.
- His–Purkinje-systemet: His-bunten og hele Purkinje-nettverket har egen automatisk pacemakeraktivitet, som fungerer som en siste skanse for å opprettholde ventrikkelaktivering.
Disse strukturene fungerer som hjertets naturlige pacemakere fordi de har automatisk aktivitet. Den iboende frekvensen av spontan depolarisering følger et tydelig hierarki:
- Sinoatrialknuten: cirka 60–100 depolarisasjoner per minutt.
- Atrialt myokard: Varierende, ofte rundt 60 depolariseringer per minutt.
- Celler i området rundt atrioventrikulærknuten: cirka 40–60 depolariseringer per minutt.
- His–Purkinje-nettverket: 20–40 depolarisasjoner per minutt.
Overdrive suppression og pacemakerhierarkiet
Hjerterytmen bestemmes av den raskeste pacemakeren, ettersom denne depolariserer før andre potensielle pacemakerceller og dermed nullstiller deres depolariseringssyklus før de kan generere et aksjonspotensial. Dette fenomenet kalles overdrive suppression. Den raske fyringen fra sinusknuten hyperpolariserer de latente pacemakerne (ved å drive den elektrogene Na+/K+-pumpen), noe som holder dem inaktive. Automatikken avtar gradvis med økende avstand fra sinoatrialknuten.
Sinoatrialknuten kan bli dysfunksjonell og unnlate å depolarisere (sinusarrest) eller impulsen kan blokkeres (sinusblokk). Ved fravær av sinoatriale impulser, opphører overdrive suppression, og en av de øvrige pacemakerstrukturene vil overta hjerterytmen etter en viss latenstid. Dette er bakgrunnen for at disse omtales som latente pacemakere. Enhver rytme som erstatter sinusrytmen betegnes som en fluktrytme (escape-rytme). En smal QRS-fluktrytme indikerer opprinnelse supraventrikulært eller høyt i His-bunten, mens en bred QRS-fluktrytme indikerer ventrikulær opprinnelse.
Patologisk automatikk
Automatikken i sinusknuten øker under fysisk anstrengelse via sympatisk stimulering av beta-adrenerge reseptorer. Dette er en normal fysiologisk respons. Under visse omstendigheter kan imidlertid automatikken øke unormalt:
- Forsterket normal automatikk: Latente pacemakere (f.eks. i Purkinje-fibre) øker sin egenfrekvens på grunn av adrenerg stimulering, hypokalemi eller acidose, slik at de «konkurrerer ut» sinusknuten. Dette kan gi opphav til akselerert idioventrikulær rytme.
- Abnormal automatikk: Celler som normalt ikke har pacemakerfunksjon (f.eks. vanlige atrie- eller ventrikkelmyocytter), kan oppnå spontan fase 4-depolarisering hvis hvilemembranpotensialet blir patologisk redusert (mot 0 mV), for eksempel ved alvorlig iskemi eller infarkt.
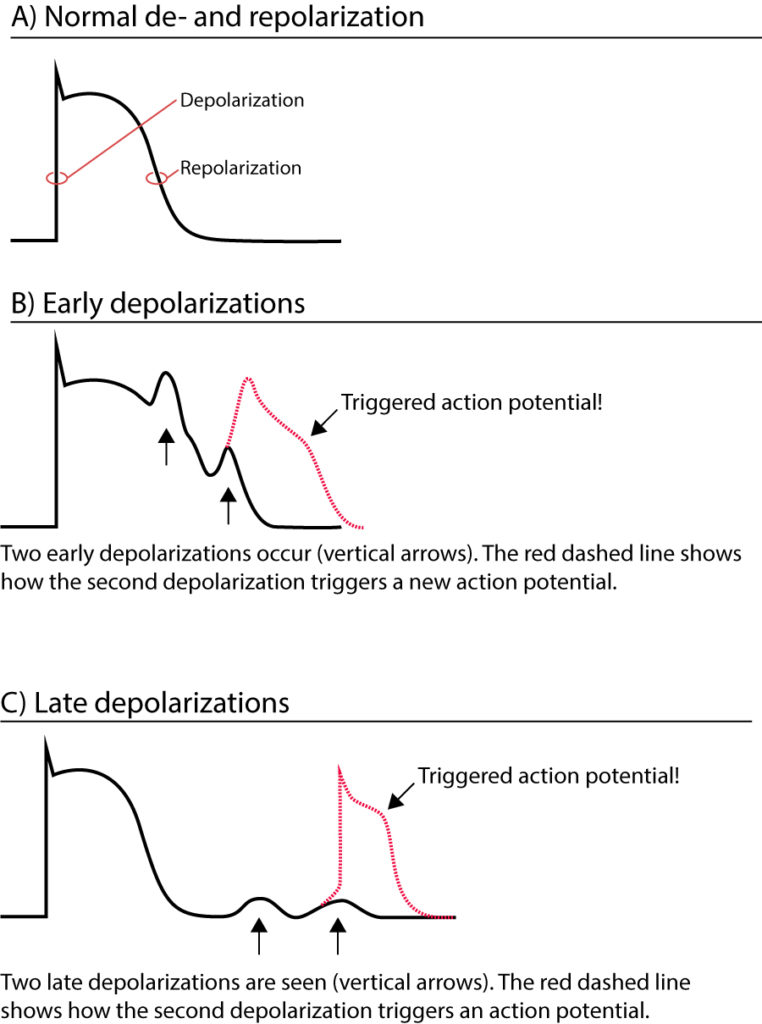
Utløst aktivitet (etterdepolariseringer)
Utløst aktivitet (triggered activity) skiller seg fra automatikk ved at den krever et forutgående aksjonspotensial for å oppstå. Et aksjonspotensial kan indusere en etterdepolarisering (afterdepolarization), som er svingninger i membranpotensialet. Dersom disse svingningene når terskelverdien, utløses et nytt, spontant aksjonspotensial. Dette klassifiseres basert på timingen i forhold til repolariseringen:
- Tidlige etterdepolariseringer (EADs – Early Afterdepolarizations): Oppstår i fase 2 (platåfasen) eller fase 3 av aksjonspotensialet, før repolariseringen er fullført.
- Sene etterdepolariseringer (DADs – Delayed Afterdepolarizations): Oppstår i fase 4, etter at repolariseringen er fullført.
Klinisk betydning av EADs:
Tidlige etterdepolariseringer er assosiert med forlenget aksjonspotensialvarighet. De oppstår typisk ved bradykardi, hypokalemi, hypomagnesemi og ved bruk av legemidler som forlenger QT-tiden (klasse Ia og III antiarytmika, visse antibiotika og psykofarmaka). EADs er den elektrofysiologiske mekanismen bak Torsades de Pointes ved Langt QT-tid-syndrom.
Klinisk betydning av DADs:
Sene etterdepolariseringer skyldes ofte en intracellulær overbelastning av kalsium. Når det sarkoplasmatiske retikulum (SR) blir overfylt med kalsium, kan det oppstå spontane lekkasjer via Ryanodin-reseptorer. Dette aktiverer Na+/Ca2+-bytteren (NCX), som genererer en innadgående strøm (transient inward current, $I_{ti}$) og depolariserer cellen. DADs observeres typisk ved digoksinforgiftning, ved katekolaminerg polymorf ventrikkeltakykardi (CPVT) og ved iskemi/reperfusjonsskade.
Det er viktig å merke seg at etterdepolariseringer kan utløse ekstrasystoler. Selv om de i seg selv kanskje kun gir enkeltslag, kan disse ekstrasystolene fungere som «triggeren» som initierer en vedvarende arytmi basert på re-entry.
Unormal impulsoverføring: re-entry
Normal impulsoverføring innebærer at den depolariserende bølgen sprer seg raskt, jevnt og uhindret gjennom myokard. Dette forutsetter at myokardiet er homogent elektrisk sett. Dersom impulsen møter celler som ikke er eksiterbare, eller områder med heterogen ledningsevne og refraktæritet, kan re-entry oppstå.
Re-entry er den desidert vanligste mekanismen for klinisk betydningsfulle takyarytmier. I motsetning til automatikk og trigget aktivitet, som er forstyrrelser i impulsdannelse, er re-entry en forstyrrelse i impulsledning. Som vist i figur 2 innebærer re-entry at den depolariserende bølgefronten sirkulerer rundt seg selv i en lukket bane.
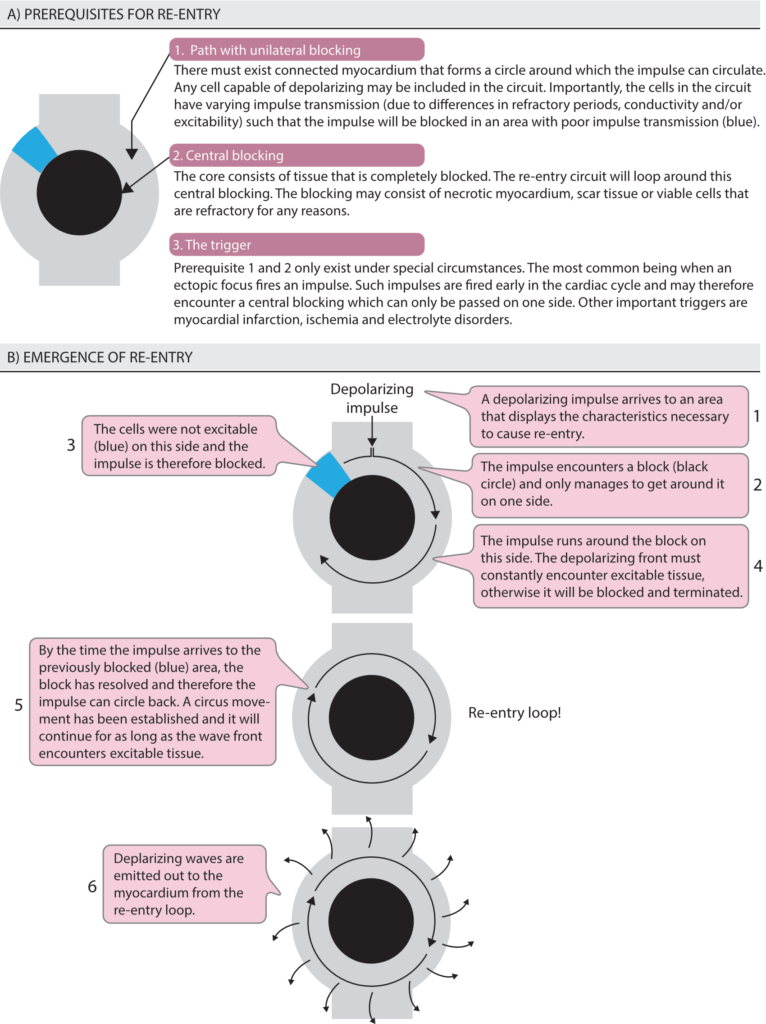
Forutsetninger for re-entry
For at en re-entry-krets skal kunne oppstå og vedlikeholdes, må tre absolutte kriterier være oppfylt (ofte kalt «re-entry-triangelet»):
- To parallelle ledningsbaner: Disse må være koblet sammen både proksimalt og distalt for å danne en lukket krets.
- Unidireksjonell blokk: En av banene må ha lengre refraktærperiode enn den andre. Ved et prematurt slag (ekstrasystole) vil impulsen blokkeres i den banen med lang refraktærtid (unidireksjonell blokk), men ledes nedover den andre banen.
- Langsom ledning: Impulsen må bevege seg så sakte gjennom den ledende banen at vevet i banen med blokk rekker å repolarisere (bli eksiterbart igjen) før impulsen kommer rundt («retrograd») og treffer det. Hvis ledningen er for rask, vil impulsen treffe refraktært vev, og kretsen dør ut.
Re-entry klassifiseres som enten anatomisk eller funksjonell, avhengig av hva som utgjør den sentrale hindringen.
Anatomisk re-entry
Ved anatomisk re-entry sirkulerer impulsen rundt en fast, ikke-ledende anatomisk struktur. Dette skaper en stabil krets med forutsigbar sykluslengde.
- Kliniske eksempler:
- Typisk atrieflutter: Impulsen roterer rundt trikuspidalklaffen og crista terminalis i høyre atrium.
- AVRT (WPW-syndrom): Kretsen bruker AV-knuten den ene veien og en aksessorisk ledningsbane (Kent-bunt) den andre veien.
- Arr-relatert ventrikkeltakykardi: Etter et hjerteinfarkt dannes det øyer av fibrose (arrvev). Overlevende myokardfibre snor seg gjennom arret og danner en langsom ledningsbane, mens selve arret utgjør den sentrale blokkeringen.
Det finnes et såkalt «excitable gap» (eksiterbart vindu) i kretsen – et tidsrom hvor vevet er ferdig repolarisert men venter på neste bølgefront. Dette gjør anatomisk re-entry sårbar for terminering via overdrive pacing eller presise ekstraslag.
Funksjonell re-entry
Funksjonell re-entry er mer kompleks og krever ingen makroskopisk anatomisk hindring. Her oppstår den sentrale blokkeringen dynamisk på grunn av elektrofysiologisk heterogenitet i vevet (spredning i refraktæritet). Impulsen roterer rundt en kjerne av vev som er refraktært, ikke fordi det er dødt, men fordi det kontinuerlig bombarderes av impulser.
En viktig modell for funksjonell re-entry er «leading circle»-konseptet, eller mer moderne teorier om «rotors» og spiralbølger. Slike kretser er ofte ustabile; de kan vandre i myokardiet (meandering), dele seg opp og danne nye kretser. Denne mekanismen er sentral i patogenesen ved atrieflimmer og ventrikkelflimmer, hvor kaoset av bølgefronter hindrer organisert kontraksjon.
Klinisk relevans og behandlingsprinsipper
Forståelsen av re-entry er direkte overførbar til klinisk behandling:
- Medikamentell behandling: Antiarytmika fungerer ved å endre ledningsevnen eller refraktæriteten i kretsen. Klasse I-antiarytmika (f.eks. flekainid) reduserer ledningshastigheten ytterligere, noe som teoretisk kan terminere arytmien ved å gjøre enveisblokk til toveisblokk. Klasse III-antiarytmika (f.eks. amiodaron) forlenger refraktærtiden, slik at den sirkulerende impulsen møter refraktært vev og stopper opp.
- Ablasjon: Ved kateterablasjon identifiserer man det kritiske «eidet» (isthmus) i re-entry-kretsen – ofte området med langsom ledning. Ved å brenne eller fryse dette vevet, brytes kretsen permanent. Dette er kurativ behandling for atrieflutter, AVNRT, AVRT og mange former for VT.
- Elektrokonvertering/Defibrillering: Formålet med å gi et elektrisk støt gjennom hjertet er å simultant depolarisere alle eksiterbare myokardceller. Når cellene repolariserer samtidig, finnes det ingen bølgefront som kan re-enterere, og sinusknuten får mulighet til å gjenoppta styringen.