Prinsipper for hjertets elektrofysiologi og elektrokardiografi (EKG)
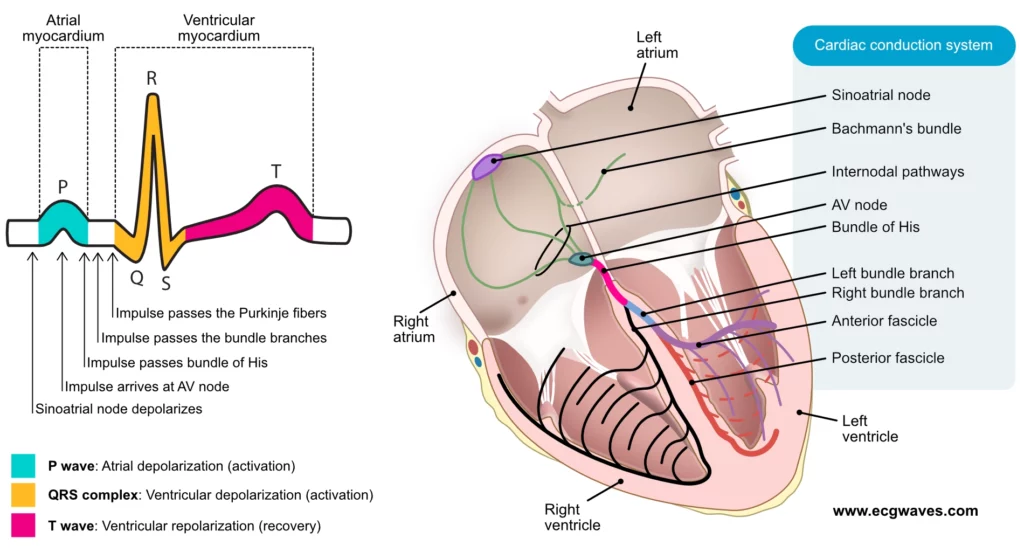
For å sikre en effektiv og hemodynamisk optimal pumpefunksjon må atriene og ventriklene aktiveres både raskt og i en strengt koordinert sekvens. Rask og synkron aktivering er avgjørende for å stimulere så store deler av ventrikkelmyokardiet som mulig simultant; jo større andel av myokard som kontraherer synkront, desto mer effektivt blir trykkoppbyggingen og tømmingen av ventriklene. Tap av denne synkroniseringen, som ved venstre grenblokk eller høyresidig ventrikkelpacing, kan medføre dyssynkroni og redusert minuttvolum. Sekvensiell aktivering innebærer at atriene aktiveres og kontraherer først, slik at de kan fylle ventriklene optimalt («atrial kick») før ventrikkelkontraksjonen starter. For å koordinere disse prosessene har hjertet et spesialisert elektrisk ledningssystem bestående av modifiserte myokardceller (ledningsceller). Disse cellene danner fiberbunter som fungerer som elektriske høyhastighetsbaner og leder aksjonspotensialet raskt og sekvensielt til det kontraktile myokardiet. Når det kontraktile myokardiet mottar aksjonspotensialet, aktiveres eksitasjons-kontraksjons-koblingen som resulterer i mekanisk sammentrekning. Figur 1 viser de relevante komponentene i ledningssystemet, hjertet og de klassiske EKG-bølgeformene.
Celletyper i elektrokardiologi
For å forstå EKG og hjertets funksjon, er det viktig å skille mellom to hovedtyper hjerteceller, som har ulike elektrofysiologiske egenskaper:
- Konduksjonscellene (ledningscellene): Disse danner fibernettverkene som sprer seg ut i myokardiet og distribuerer aksjonspotensialet raskt. Disse cellene har spesialisert seg på impulsdannelse (automatikk) og impulsledning, og har praktisk talt ingen kontraktil funksjon. De inneholder lite myofibriller.
- De kontraktile myokardcellene: Disse utgjør majoriteten av hjertets masse og utfører selve sammentrekningen (det mekaniske arbeidet). De er også i stand til å overføre aksjonspotensialet celle-til-celle, men med betydelig lavere hastighet (ca. 0,3–0,5 m/s) enn ledningscellene (opptil 4 m/s). Begrepene kontraktilt myokard, myokard eller bare myokardcelle refererer til denne celletypen, og disse begrepene brukes om hverandre i klinisk litteratur.
Hjertets cellearkitektur og intercellulær kommunikasjon
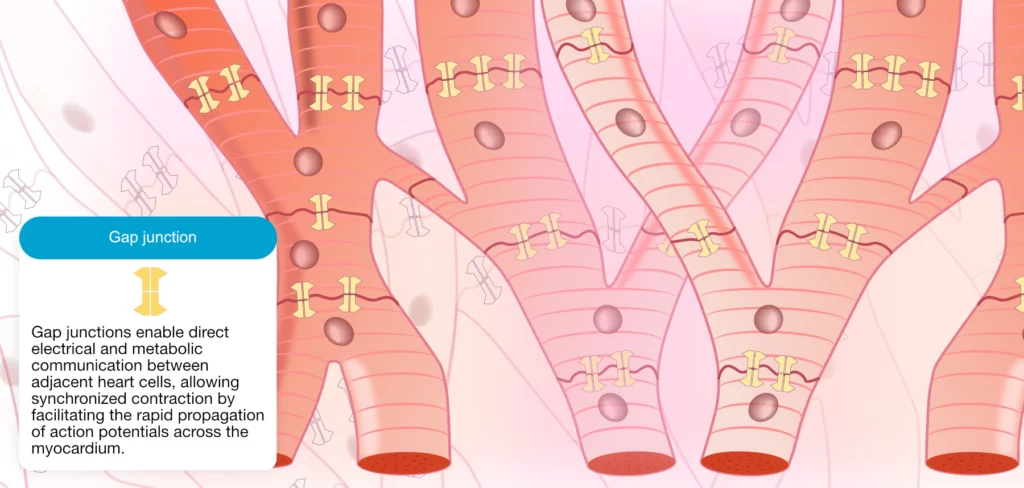
I motsetning til skjelettmuskulatur, der cellene er isolerte enheter, har hjertecellene en forgrenet morfologi og danner et komplekst nettverk. Som illustrert i figur 2 er alle hjertecellene koblet sammen både elektrisk og mekanisk langs sin lengdeakse. Denne cellearkitekturen betegnes som et funksjonelt syncytium. Dette innebærer at selv om cellene er anatomisk adskilte, fungerer hele nettverket elektrisk og mekanisk som én enhet. Når én celle i syncytiet aktiveres til terskelverdi, vil alle eksiterbare celler nedstrøms også aktiveres.
Forbindelsene mellom cellene kalles interkalerte skiver (innskuddsskiver). Den interkalerte skiven er en kompleks struktur bestående av cellemembranproteiner (desmosomer og adherens junctions) som kobler tilstøtende celler mekanisk, slik at de tåler strekk under kontraksjon. Den elektriske forbindelsen etableres via gap junctions, som er proteinkanaler dannet av connexiner. Disse kanalene forbinder cytoplasma i naboceller direkte (lav elektrisk motstand). Gjennom disse kan ioner med elektrisk ladning passere fritt, slik at aksjonspotensialet kan spre seg raskt fra én celle til den neste uten forsinkelse. Endringer i connexin-fordeling eller funksjon (f.eks. ved iskemi eller hypertrofi) kan redusere ledningshastigheten og disponere for arytmier.
Hjertets aksjonspotensial
Hjertets elektriske aktivitet er basert på aksjonspotensialer i hver enkelt celle. Aksjonspotensialet består av en depolarisering (aktivering) etterfulgt av en repolarisering (gjenoppretting). Hjertesyklusen starter når sinusknuten utløser det første aksjonspotensialet, som sprer seg gjennom myokardiet som en bølgefront. Under de- og repolariseringen åpnes og lukkes spesifikke ionekanaler i cellemembranene i en nøye orkestrert rekkefølge, slik at ioner (Na⁺ [natrium], K⁺ [kalium], Ca²⁺ [kalsium]) kan strømme drevet av elektrokjemiske gradienter mellom det intra- og ekstracellulære rommet. Aksjonspotensialet innebærer dermed bevegelse av ioner – ladede partikler – og genererer derfor en elektrisk strøm. Det er summen av disse strømmene som registreres på kroppsoverflaten som et EKG.
Begrepene «elektrisk impuls», «impuls» og «impulsbølge» brukes om hverandre for å beskrive den bølgelignende forplantningen av aksjonspotensialet i myokard.
Refraktærperioder og eksitabilitet
En avgjørende egenskap ved hjertemuskelceller er at de har en lang refraktærperiode sammenlignet med skjelettmuskulatur og nerveceller. Etter at en celle har depolarisert, går den inn i en fase hvor den ikke kan stimuleres til et nytt aksjonspotensial, uansett stimulusstyrke (absolutt refraktærperiode). Deretter følger en relativ refraktærperiode hvor kun en svært kraftig impuls kan utløse et nytt (men ofte svakt og langsomt ledende) aksjonspotensial. Dette beskytter hjertet mot tetanisk kontraksjon (krampe) og er en viktig sikkerhetsmekanisme mot dødelige arytmier. Forstyrrelser i refraktærperiodene er en sentral mekanisme ved sirkelstrømsarytmier (re-entry).
Hjertets elektromekaniske kobling
Depolarisering er det elektriske startskuddet som aktiverer hjertemuskelcellene og initierer kontraksjon. Spredningen av den elektriske impulsen er derfor direkte knyttet til en mekanisk hendelse, kjent som eksitasjons-kontraksjons-kobling. Når aksjonspotensialet depolariserer cellemembranen, strømmer kalsium inn i cellen via L-type kalsiumkanaler. Dette utløser en massiv frigjøring av lagret kalsium fra sarkoplasmatisk retikulum (Calcium-Induced Calcium Release), som igjen binder seg til troponin-komplekset og muliggjør sammentrekning av aktin- og myosinfilamentene.
På grunn av det høye innholdet av ioner i vevet og væskene som omgir hjertet – og i hele kroppen – fungerer kroppen som en volumleder. Dette betyr at de elektriske strømmene som genereres i hjertet, ledes helt ut til hudoverflaten, hvor de kan registreres ved hjelp av elektroder. Elektrokardiografi er metoden for å registrere og tolke de elektriske potensialene som oppstår i hjertemuskelen. Elektrokardiografen fremstiller disse elektriske hendelsene i et diagram kalt elektrokardiogram (EKG).
Det er viktig å presisere at EKG primært viser elektrisk aktivitet i masse. De elektriske potensialene som genereres av komponentene i det spesialiserte ledningssystemet (sinusknuten, atrioventrikulærknuten, His-bunten og Purkinje-fibrene) involverer for få celler til å skape spenningsforskjeller store nok til å registreres med overflateelektroder. EKG gjenspeiler derfor kun summen av aktiviteten i det kontraktile atriale og ventrikulære myokardiet (P-bølgen og QRS-komplekset). Dette innebærer at vi i et standard EKG ikke ser «streken» for His-bunte-aktivering, men vi kan slutte oss til funksjonen basert på tidsintervallene (f.eks. PQ-tiden). I spesialiserte situasjoner utføres invasive elektrofysiologiske undersøkelser der intrakardiale elektroder plasseres direkte mot His-bunten for å måle disse signalene nøyaktig.
Det elektriske ledningssystemet i hjertet
Sinoatrialknuten (SA-knuten)
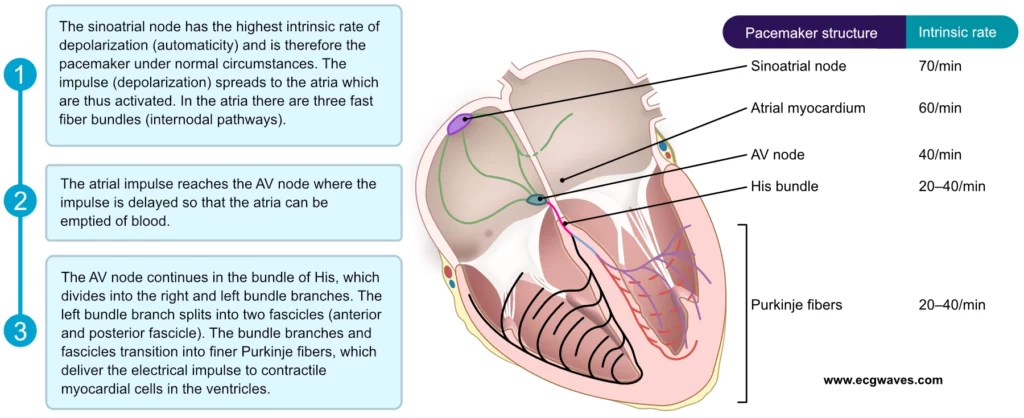
Sinoatrialknuten er en liten, halvmåneformet struktur lokalisert subepikardielt i sulcus terminalis, nær innmunningen av vena cava superior i høyre atrium (figur 1). Den blodforsynes oftest fra høyre koronararterie (ca. 60 % av befolkningen) eller venstre circumflex (ca. 40 %). Knuten består av høyt spesialiserte pacemakerceller i en fibrotisk matrise. Disse cellene har en unik egenskap: et ustabilt hvilemembranpotensial som gradvis depolariseres (pacemaker-potensialet) til terskelverdi nås, uten behov for ytre stimulering. Denne egenskapen kalles automatikk.
Cellene i sinusknuten har den raskeste iboende depolarisasjonsfrekvensen i hjertet, normalt mellom 60 og 100 slag per minutt i hvile. Sinoatrialknuten omtales derfor som hjertets primære pacemaker. Hastigheten på den spontane depolariseringen reguleres nøye av det autonome nervesystemet:
- Sympatisk stimulering (via noradrenalin og β1-reseptorer) øker stigningen på pacemaker-potensialet, noe som fører til at terskelverdien nås raskere og hjertefrekvensen øker (positiv kronotropi).
- Parasympatisk stimulering (via nervus vagus, acetylkolin og M2-reseptorer) hyperpolariserer cellene og reduserer stigningen på pacemaker-potensialet, noe som senker hjertefrekvensen (negativ kronotropi).
Under fysisk anstrengelse trekkes vagusaktiviteten tilbake samtidig som sympatisk aktivitet øker, noe som effektivt øker hjertefrekvensen.
Sekundære (latente) pacemakere og «Overdrive Suppression»
Selv om sinoatrialknuten er den dominerende pacemakeren, har flere andre strukturer i hjertet evnen til spontan depolarisering. Disse kalles latente pacemakere og fungerer som et sikkerhetsnett (backup-system) dersom sinusknuten svikter eller impulsen derfra blokkeres. Disse strukturene omfatter:
- Atriale pacemakere: Celler i crista terminalis, rundt åpningen av sinus coronarius, vena cava inferior, samt rundt atrioventrikulærklaffene. Disse har en frekvens som er litt lavere enn sinusknuten.
- Junksjonale pacemakere (AV-knute-området): Celler i overgangssonen rundt AV-knuten og i den proksimale delen av His-bunten har automatikk. (Selve den kompakte AV-knuten antas å ha liten eller ingen automatikk). En erstatningsrytme herfra (junksjonsrytme) har typisk en frekvens på 40–60 slag/min.
- Ventrikulære pacemakere (His-Purkinje-nettverket): His-bunten og Purkinje-fibrene har utpreget automatikk, men med svært lav frekvens, typisk 20–40 slag/min. Dette er hjertets siste skanse mot asystoli.
Overdrive suppression: Hvorfor konkurrerer ikke disse cellene med sinusknuten til vanlig? Årsaken er mekanismen «overdrive suppression». Når en latent pacemakercelle depolariseres av en ekstern impuls (fra sinusknuten) med høyere frekvens enn dens egenrytme, undertrykkes dens egen automatikk midlertidig (cellen hyperpolariseres). Hjerterytmen bestemmes derfor alltid av den strukturen som har høyest frekvens. Under normale forhold «overkjører» sinusknuten alle andre pacemakere.
Kliniske aspekter ved automatikk
Sinoatrialknuten kan bli dysfunksjonell (f.eks. ved syk sinus-syndrom) og unnlate å depolarisere, eller utgangsblokk kan hindre impulsen i å nå atriet. Dette fører til pauser i hjerterytmen. Normalt vil fraværet av sinusimpulser («overdrive suppression» opphører) tillate en latent pacemaker å fyre. Rytmen som da oppstår kalles en escape-rytme (erstatningsrytme).
Pacemakerhierarkiet sikrer overlevelse, men med redusert funksjon:
- Atrial escape: Nær normal frekvens og hemodynamikk.
- Junksjonal escape: Lavere frekvens (40-60), bevart QRS-bredde, men tap av AV-synkroni (atrial kick) hvis atriene ikke aktiveres retrograd.
- Ventrikulær escape: Lav frekvens (20-40), bredt QRS-kompleks og ofte hemodynamisk ustabilt.
Det er viktig å skille mellom normal automatikk (escape) og unormal automatikk. Unormal automatikk kan oppstå i skadet eller iskemisk vev (f.eks. i ventrikkelmyokardiet som normalt ikke har automatikk) og forårsake ekstrasystoler eller takykardier som konkurrerer med grunnrytmen, snarere enn å redde den.
Impulsoverføring (ledning, forplantning)
Ledningscellene utgjør et spesialisert «motorveinett» for elektriske impulser. Mens myokardcellene leder strøm relativt langsomt via gap junctions i de interkalerte skivene, sørger ledningssystemet for at impulsen når fjerne deler av hjertet raskt. Dette er kritisk for at store muskelmasser skal kunne trekke seg sammen samtidig.
Overføring av atrieimpulser
Når impulsen forlater sinusknuten, sprer den seg gjennom atriemyokardiet. Selv om det histologisk er vanskelig å påvise isolerte baner i atriene på samme måte som i ventriklene, har funksjonelle studier vist at impulsen brer seg raskest langs visse ruter, ofte kalt internodale baner (fremre, midtre og bakre). Viktigst er Bachmanns bunt, som leder impulsen raskt fra høyre til venstre atrium. Dette sikrer at venstre atrium aktiveres nesten samtidig med høyre atrium, til tross for avstanden fra sinusknuten. Forsinket ledning her kan sees som en bred P-bølge («P-mitrale») i EKG og disponerer for atrieflimmer.
Det atrioventrikulære ledningssystemet
Den atrioventrikulære knuten (AV-knuten)
Atrioventrikulærknuten (AV-knuten) ligger i nedre del av høyre atrium, like over septalbladet til trikuspidalklaffen, i det såkalte Kochs triangel. Under normale forhold er dette den eneste elektriske porten mellom atriene og ventriklene, da atrioventrikulær-ringen (annulus fibrosus) isolerer kamrene elektrisk.
AV-knuten har to kritiske funksjoner:
- Fysiologisk forsinkelse: Celler i AV-knuten har liten diameter og komplekse forbindelser som gir langsom ledning. Dette forsinker impulsen (sees som PQ-intervallet i EKG) og gir atriene tid til å tømme seg før ventriklene kontraherer.
- Beskyttende filter (dekremental ledning): Ved svært rask atrieaktivitet, som ved atrieflimmer eller atrieflutter, har AV-knuten egenskapen dekremental ledning. Jo raskere impulsene kommer, desto langsommere leder knuten, og til slutt blokkeres impulser. Dette hindrer at farlig høye frekvenser (f.eks. 300–600 i atriene) overføres 1:1 til ventriklene, noe som ville ført til sirkulasjonskollaps.
Bunten av His
Distalt for AV-knuten samles fibrene i His-bunten, som penetrerer gjennom annulus fibrosus og inn i det membranøse ventrikkelseptumet. His-bunten er normalt den eneste strukturen som leder strøm gjennom det isolerende bindevevsskjelettet. His-bunten deler seg raskt i høyre og venstre buntgren (grenblokk oppstår hvis ledningen i en av disse svikter).
Purkinjefibrene og ventrikkelaktivering
Buntgrenene forgrener seg videre til et finmasket nettverk av Purkinje-fibre. Venstre buntgren deler seg i en fremre (anterior) og en bakre (posterior) fascikkel, noe som er viktig for EKG-diagnostikk av hemiblokk. Purkinje-cellene er blant de største cellene i hjertet og har ekstremt rask ledningshastighet (ca. 4 m/s). Dette systemet kler innsiden av ventriklene (endokard).
Aktiveringen av ventriklene skjer i en spesifikk rekkefølge:
- Septum: Aktiveres først, fra venstre mot høyre side.
- Apex: Impulsen raser ned til hjertespissen.
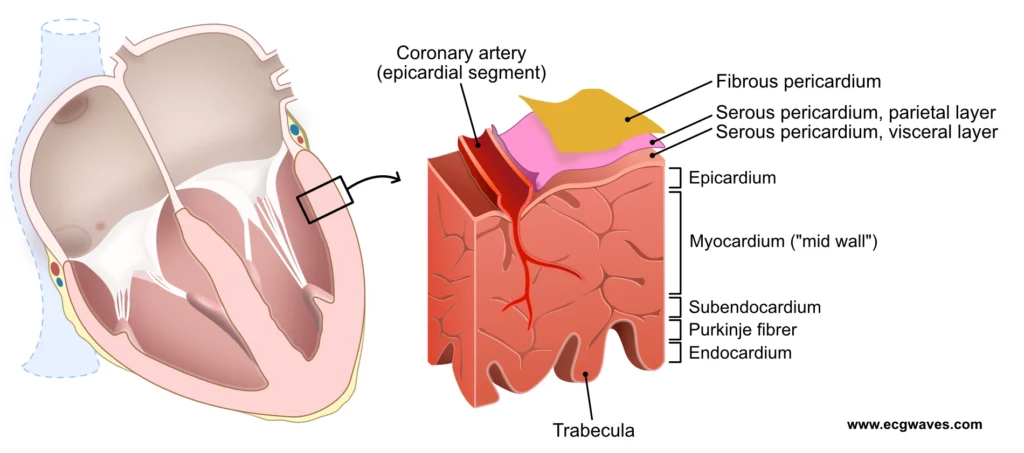
- Frie vegger: Aktiveringen sprer seg fra endokard (innsiden) og utover mot epikard (utsiden) i begge ventrikler simultant (figur 5).
- Basale deler: De øverste delene av ventriklene aktiveres sist.
Den raske spredningen sikrer at hele ventrikkelmassen kontraherer nesten samtidig, noe som gir et kraftig trykkstøt. Dersom Purkinje-systemet svikter (f.eks. ved ventrikulær escape-rytme eller grenblokk), må impulsen spre seg langsomt fra celle til celle. Dette gir et bredt QRS-kompleks i EKG og en mindre effektiv, «vuggende» kontraksjon.
Påvirkning fra det autonome nervesystemet
Hjertets funksjon finjusteres kontinuerlig av det autonome nervesystemet for å møte kroppens behov:
- Parasympatikus (Vagus): Vagusnerven innerverer primært supraventrikulære strukturer: sinusknuten, atriemyokard og AV-knuten. Effekten er i hovedsak hemmende («bremsen»). Økt vagal tonus reduserer automatikk i sinusknuten (bradykardi) og forlenger overledningstiden og refraktærtiden i AV-knuten. Kraftig vagal aktivitet (vasovagal reaksjon) kan gi sinusarrest eller totalblokk i AV-knuten, noe som kan medføre synkope.
- Sympatikus: Sympatiske nervefibre innerverer hele hjertet, inkludert atrier, ventrikler og ledningssystemet. Via frigjøring av noradrenalin økes eksitabiliteten og ledningshastigheten i alle hjertets celler, samt kontraktiliteten (inotropi) i muskelcellene. Sympatisk «storm» kan imidlertid også disponere for arytmier ved å øke automatikken i ektopiske foci.
Definisjon av hjerterytme og grunnleggende begreper
I klinisk praksis defineres en rytme som tre eller flere påfølgende hjerteslag med tilnærmet identisk opprinnelse og utseende på EKG.
- Sinusrytme: Normal rytme der sinusknuten styrer hjertet. Karakteriseres ved positive P-bølger i avledning II (indikerer aktivering fra høyre mot venstre/nedover) foran hvert QRS-kompleks.
- Ektopisk slag/rytme: Hvis en struktur utenfor sinusknuten depolariserer spontant og overtar kontrollen før sinusknuten rekker å fyre, kalles dette ektopisk aktivitet. Enkeltstående slag kalles ekstrasystoler.
- Escape-rytme: En «passiv» rytme som oppstår fordi sinusknuten er for langsom eller har sviktet. Dette er en bergingsmekanisme.
- Erstatningsrytme vs. akselerert rytme: En escape-rytme er langsommere enn den normale sinusrytmen. Hvis et ektopisk fokus fyrer raskere enn sinusrytmen (uten at sinusknuten har sviktet), kalles det en akselerert rytme eller takykardi.
Konklusjon
Hjertets elektrofysiologi danner grunnlaget for all EKG-tolkning. Hjertesyklusen er avhengig av en presis sekvens der sinusknuten initierer impulsen, atriene aktiveres, AV-knuten sørger for nødvendig forsinkelse, og His–Purkinje-systemet sørger for eksplosivt rask aktivering av ventriklene. Denne koordineringen sikrer optimal fylling og tømming av hjertet.
Aksjonspotensialet, drevet av ionestrømmer gjennom cellemembranen, er den fundamentale hendelsen. Summen av disse mikroskopiske strømmene i milliarder av celler skaper de makroskopiske signalene vi leser av som P, QRS og T i EKG. Forståelse av hvordan ledningssystemet fungerer – og hvordan det feiler (blokk, automatikk, re-entry) – er nøkkelen til å diagnostisere arytmier og ledningsforstyrrelser.
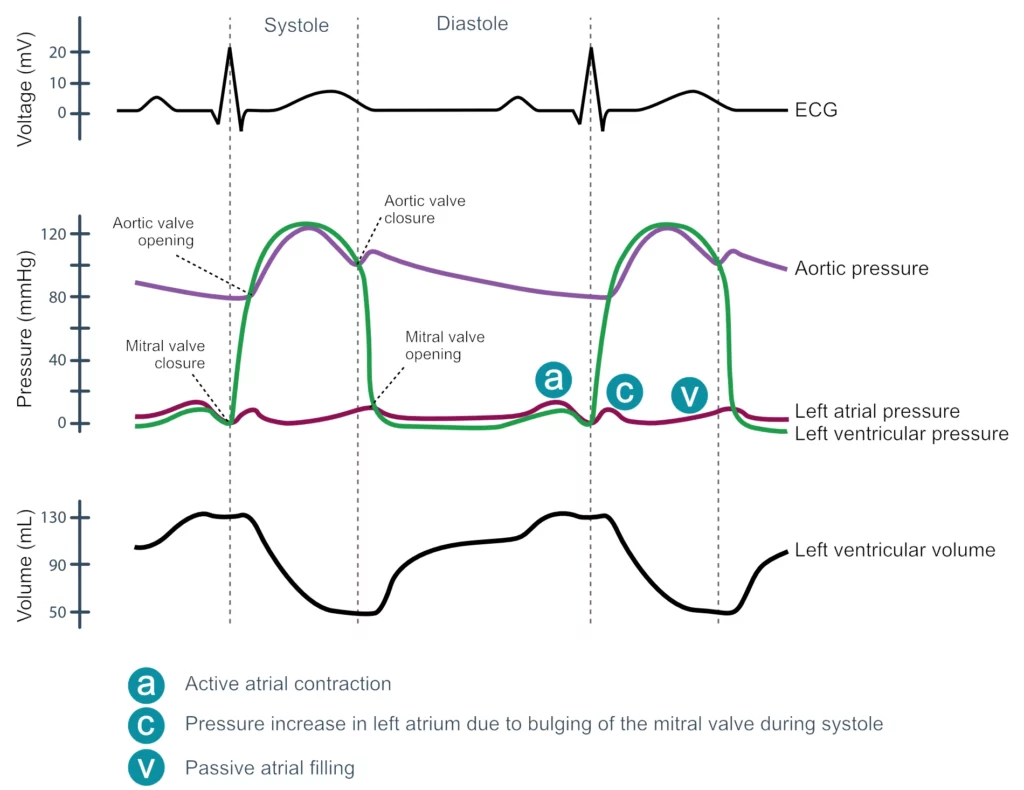
Interesserte lesere kan studere Wiggers-diagrammet (figur 6) nøye. Det integrerer elektrisk aktivitet (EKG) med mekaniske hendelser (trykk, volum, hjertelyder) og gir en komplett oversikt over hjertesyklusen.