Treningsfysiologi: fra normal respons til myokardiskemi og brystsmerter
Fysiologiske prinsipper for anstrengelsestesting, myokardiskemi og iskemiske symptomer
En grundig forståelse av anstrengelsesfysiologi er en forutsetning for å kunne gjennomføre, tolke og evaluere en anstrengelsestest (arbeids-EKG) på en klinisk forsvarlig måte. Fysisk belastning induserer komplekse fysiologiske endringer som inkluderer økt ventilasjon, systemisk vasokonstriksjon i ikke-aktive vev, koronar vasodilatasjon, samt endringer i hjertefrekvens og kontraktilitet. Hensikten med disse adaptasjonene er å optimalisere det kardiopulmonale systemets evne til å levere oksygen til arbeidende skjelettmuskulatur og myokard. Oksygenforbruket (MVO2) – og dermed oksygenbehovet – øker lineært med intensiteten på belastningen. De fysiologiske tilpasningene blir mer uttalte etter hvert som arbeidsbelastningen øker. Det autonome nervesystemet initierer responsen umiddelbart ved oppstart av aktivitet, primært gjennom vagalt bortfall (redusert parasympatisk tonus) etterfulgt av økt sympatisk aktivitet. Denne artikkelen omhandler treningsfysiologien med hovedvekt på myokardets oksygenforbruk, koronar fysiologi og patofysiologien bak myokardiskemi under belastning. EKG-forandringer omtales kort her, men behandles inngående i påfølgende artikler.
Fysiologiske effekter av trening
De kardiovaskulære responsene på fysisk aktivitet styres av et komplekst samspill mellom sentrale kommandoer fra hjernen og perifere reflekser. De viktigste fysiologiske effektene er oppsummert nedenfor.
Parasympatiske fibre (Nervus Vagus) innerverer både sinusknuten (SA-knuten) og atrioventrikulærknuten (AV-knuten). I hvile dominerer vagusnerven, noe som holder hjertefrekvensen lav ved å redusere automatikken i sinusknuten og redusere ledningshastigheten i AV-knuten. Ved oppstart av fysisk aktivitet er den primære mekanismen for frekvensøkning en tilbaketrekking av denne parasympatiske aktiviteten (vagalt bortfall), noe som alene kan øke hjertefrekvensen opp mot ca. 100 slag per minutt.
Sympatiske fibre innerverer hele hjertet, inkludert atrier, ledningssystemet og ventrikkelmyokardiet. Ved økende belastning aktiveres det sympatiske nervesystemet, som frigjør noradrenalin. Dette har fire hovedeffekter på hjertet:
- Positiv inotrop effekt: Økt kontraktilitet (kraft) i myokardiet.
- Positiv kronotrop effekt: Økt hjertefrekvens ved å øke automatikken i sinusknuten.
- Positiv dromotrop effekt: Økt ledningshastighet gjennom AV-knuten.
- Positiv lusitrop effekt: Raskere relaksasjon av myokard i diastolen, noe som er kritisk for å opprettholde fyllingstid ved høy hjertefrekvens.
Økt sympatikusaktivitet er ansvarlig for økningen i hjertefrekvens utover ca. 100 slag/min og for den kraftige økningen i slagvolum.
Fysisk trening øker den venøse returen til hjertet, noe som resulterer i økt endediastolisk volum og dermed økt forspenning (preload). Mekanismene for økt venøs retur er:
- Sympatisk aktivitet fører til venokonstriksjon (særlig i splanknikus-området), noe som mobiliserer blod fra venereservoaret til sentral sirkulasjon.
- Muskel-vene-pumpen: Kontraherende skjelettmuskulatur komprimerer vener og driver blodet mekanisk tilbake mot hjertet.
- Respirasjonspumpen: Respirasjonsdybden og -frekvensen øker, noe som skaper et mer negativt intrathorakalt trykk. Dette øker trykkgradienten mellom abdomen og thorax, og suger blod passivt tilbake til høyre atrium.
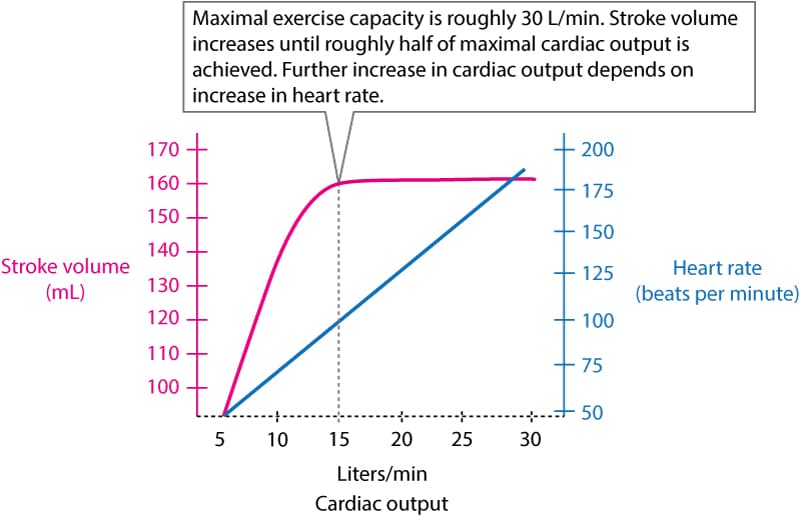
Økningen i preload vil føre til økt strekk i myokardfibrene, noe som ifølge Frank-Starling-mekanismen resulterer i kraftigere kontraksjon og økt slagvolum. Det er imidlertid viktig å merke seg at slagvolumet flater ut ved moderat intensitet (ca. 50-60 % av VO2max). Videre økning i hjerteminuttvolum (Cardiac Output) drives da primært av hjertefrekvensen.
Det systoliske blodtrykket øker som følge av økt hjerteminuttvolum. Det diastoliske blodtrykket avhenger hovedsakelig av total perifer motstand (TPR). Under dynamisk arbeid faller TPR grunnet massiv vasodilatasjon i arbeidende muskulatur. Derfor forblir det diastoliske trykket uendret eller faller lett. Det gjennomsnittlige arterielle trykket (MAP) øker moderat, drevet av det økte systoliske trykket.
Som illustrert i figur 1, kan hjerteminuttvolumet øke fra ca. 5 L/min i hvile til 20–30 L/min (eller mer hos eliteutøvere) under maksimal belastning. Dette er en funksjon av økt slagvolum og økt hjertefrekvens.
Redistribusjon av blodstrøm er essensielt. Vasokonstriksjon i nyrearterier, splanknikusområdet og inaktivt vev omdirigerer blodvolumet til aktiv skjelettmuskulatur, hjerte og hjerne. I arbeidende muskulatur overstyres den sympatiske vasokonstriksjonen av lokal metabolsk vasodilatasjon (adenosin, K+, H+, laktat, CO2 og NO), et fenomen kjent som funksjonell hyperemi. Totalt sett reduseres den perifere vaskulære motstanden betydelig under dynamisk arbeid.
Hjertefrekvensrespons og kronotrop inkompetanse
Hjertefrekvensen responderer umiddelbart ved oppstart av arbeid. Hos friske individer skal frekvensen øke tilnærmet lineært med arbeidsbelastningen (ca. 10 slag/min per MET). Maksimal estimert hjertefrekvens kan beregnes grovt som 220 minus alder, men spredningen er stor (standardavvik ±10–12 slag). Veltrente personer har lavere hvilepuls og en brattere stigning i slagvolum, mens pasienter på betablokkere vil ha en dempet frekvensrespons.
Kronotrop inkompetanse defineres som manglende evne til å øke hjertefrekvensen adekvat i forhold til metabolsk behov. Klinisk defineres dette ofte som manglende evne til å oppnå 85 % av aldersestimert makspuls ved maksimal belastning (hos pasienter som ikke bruker betablokkere). Kronotrop inkompetanse er en uavhengig prediktor for kardiovaskulær død og totalmortalitet, og er et viktig funn under arbeids-EKG.
Hjertefrekvensrestitusjon (Heart Rate Recovery – HRR): I restitusjonsfasen skal hjertefrekvensen synke raskt grunnet reaktivering av parasympatikus (vagus). En forsinket reduksjon i hjertefrekvens (f.eks. <12 slag fall første minutt) er assosiert med økt risiko for plutselig død og kardiovaskulære hendelser, da det indikerer autonom dysfunksjon.
Blodtrykksrespons under anstrengelsestesting
Det systoliske blodtrykket skal øke jevnt under trening, typisk med 10 mmHg per MET. En normal respons innebærer systoliske verdier mellom 160 og 200 mmHg ved maksimal belastning. Diastolisk blodtrykk forblir vanligvis uendret eller faller lett (opptil 10 mmHg) grunnet den reduserte perifere motstanden. Menn og eldre personer har ofte en mer uttalt økning i systolisk blodtrykk på grunn av stivere arterier (redusert compliance).
Klinisk viktige avvik inkluderer:
- Hypertensiv respons: Systolisk BT >210 mmHg hos menn (>190 mmHg hos kvinner) eller diastolisk BT >110 mmHg. Dette kan indikere økt risiko for fremtidig hypertensjon.
- Hypotensiv respons: Manglende stigning eller fall i systolisk BT (>10 mmHg) under økende belastning er et alvorlig prognostisk tegn. Det kan indikere alvorlig venstre ventrikkel dysfunksjon (pumpesvikt) eller alvorlig koronarsykdom (f.eks. hovedstamme- eller trekarssykdom), og er en indikasjon for å avbryte testen.
Når anstrengelsen opphører, faller blodtrykket jevnt. Det er ikke uvanlig at systolisk blodtrykk faller til under utgangsnivået i timene etter trening på grunn av vedvarende perifer vasodilatasjon.
Metabolske ekvivalenter (METs)
Arbeidskapasitet rapporteres ofte i metabolske ekvivalenter (METs). Én MET tilsvarer oksygenforbruket i hvile, som er ca. 3,5 ml O2/kg/min. Under en belastningstest er antall oppnådde METs et av de sterkeste prognostiske målene vi har:
- < 5 METs: Dårlig prognose. Assosiert med høyere perioperativ risiko og redusert overlevelse.
- > 10 METs: God prognose. Medisinsk behandling er ofte likeverdig med revaskularisering hos pasienter med stabil koronarsykdom som har denne kapasiteten.
Myokardets metabolisme, koronarflussreserve og iskemi
Hjertet er et aerobt organ som er fullstendig avhengig av kontinuerlig oksygentilførsel. I hvile ekstraherer myokardiet nesten maksimalt med oksygen fra blodet (60–80 % ekstraksjon), i motsetning til skjelettmuskulatur som kun ekstraherer 20–30 %. Dette betyr at hjertet har liten «ekstraksjonsreserve». Derfor kan økt oksygenbehov i myokardiet kun dekkes gjennom økt koronar blodgjennomstrømning.
Myokardiskemi oppstår når myokardets oksygenbehov (MVO2) overstiger oksygentilførselen. De viktigste determinantene for myokardets oksygenforbruk er:
- Hjertefrekvens (viktigste faktor)
- Kontraktilitet (inotropi)
- Veggspenning (bestemt av intraventrikulært trykk og volum, jf. Laplace lov)
Ettersom direkte måling av MVO2 er invasivt, bruker vi surrogatmål i klinikken. Produktet av hjertefrekvens og systolisk blodtrykk gir et utmerket estimat på myokardets arbeid og oksygenforbruk. Dette kalles dobbeltproduktet eller Rate Pressure Product (RPP):
RPP = hjertefrekvens (slag/min) × systolisk blodtrykk (mmHg)
Målet ved anstrengelsestesting er ofte å oppnå et dobbeltprodukt på > 25 000 (f.eks. puls 150 x BT 170 = 25 500), som indikerer tilstrekkelig hemodynamisk stress for å kunne avdekke iskemi.
| Hemodynamisk respons (arbeidsbelastning) | Rate Pressure Product (RPP) |
|---|---|
| Høyt | >30000 |
| Høyt mellomliggende | 25000 – 30000 |
| Mellomliggende | 20000 – 25000 |
| Lavt middels | 15000 – 20000 |
| Lavt | 10000 – 15000 |
Koronarflussreserve (CFR) og betydningen av stenoser
Koronarflussreserve (CFR) er forholdet mellom maksimal koronar blodstrøm (under hyperemi/belastning) og blodstrøm i hvile. Hos friske kan koronarkarene øke blodstrømmen 4–5 ganger hvilenivået.
Ved aterosklerose vil koronararteriene distalt for en stenose dilatere for å opprettholde normal blodstrøm i hvile (autoregulering). Denne kompensasjonsmekanismen «spiser» imidlertid av reserven. Når en stenose overstiger ca. 70 % av lumen, er autoreguleringen utnyttet maksimalt allerede i hvile. Ved belastning kan ikke blodstrømmen øke ytterligere, og pasienten utvikler iskemi. Dette forklarer hvorfor pasienter med stabil angina pectoris er symptomfrie i hvile, men får brystsmerter ved et spesifikt og repeterbart nivå av anstrengelse (fast anginaterskel).
RPP ved debut av symptomer (anginaterskelen) er vanligvis konstant hos en pasient med stabil koronarsykdom. Hvis pasienten får symptomer ved et lavere RPP enn tidligere, kan det tyde på progresjon av sykdommen eller ustabilitet.
Teorier om myokardiskemi: Tilbud/etterspørsel vs. metabolsk tilpasning
Det har historisk vært debatt rundt mekanismene for iskemi. To hovedteorier dominerer, der den første er mest relevant for klinisk anstrengelsestesting:
- Tilbud- og etterspørselsteorien: Iskemi oppstår når metabolsk etterspørsel overstiger tilbudet av oksygenert blod. Dette er den klassiske mekanismen ved stabil angina pectoris, hvor en fast stenose begrenser flowøkningen under trening.
- Teorien om metabolsk nedregulering («Hibernation/Stunning»): Denne teorien postulerer at myokardiet kan tilpasse sitt oksygenforbruk til redusert tilførsel ved å redusere kontraktiliteten. Ved akutt iskemi (f.eks. okklusjon) slutter myokardiet å trekke seg sammen nesten umiddelbart. Hvis blodstrømmen gjenopprettes raskt, kan vevet være «stunned» (bedøvet) med nedsatt funksjon i en periode før det restitueres. Ved kronisk nedsatt blodstrøm kan vevet gå inn i en dvaletilstand («hibernation») for å overleve.
Interesserte lesere henvises til:
– G. Heusch, Myocardial Ischemia. Circ Res, 2016
– E Braunwald, Limitation of Infarct Size and the Open Artery Theory. Circulation, 2016.
Klinisk vurdering av stenoser modifiseres av flere faktorer:
- Kollateral sirkulasjon: Gradvis utvikling av stenoser stimulerer dannelse av naturlige «omveier» (kollateraler). Disse kan være svært effektive; en pasient med kronisk total okklusjon (CTO) av en hovedarterie kan ha bevart myokardfunksjon og lite symptomer hvis kollateralene er velutviklede.
- Lokalisering: Proksimale stenoser truer større myokardmasse enn distale, og gir ofte uttalte EKG-utslag og symptomer.
- Vasomotorisk tonus: Endoteldysfunksjon ved aterosklerose kan føre til paradoksal vasokonstriksjon under stress, noe som forverrer en eksisterende stenose.
Den iskemiske kaskaden: Fra metabolsk endring til brystsmerter
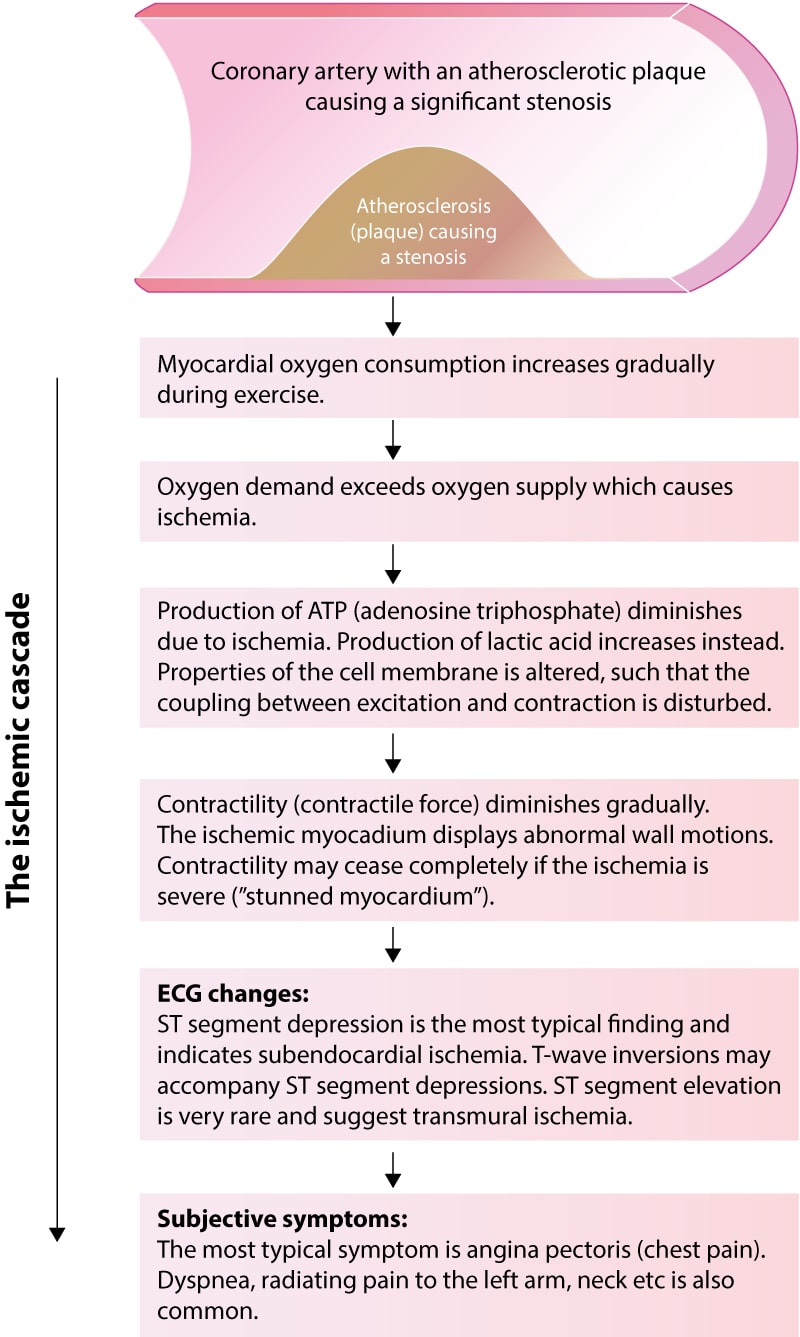
Forståelsen av den iskemiske kaskaden er essensiell for kardiologisk diagnostikk. Kaskaden beskriver den tidsmessige rekkefølgen av patofysiologiske hendelser som inntreffer når oksygentilførselen blir utilstrekkelig. Figur 2 illustrerer dette forløpet.
Sekvensen er som følger:
- Metabolsk endring: Overgang fra aerob til anaerob metabolisme. Produksjon av laktat og fall i pH intracellulært.
- Diastolisk dysfunksjon: Relaksasjonen av venstre ventrikkel er en energikrevende prosess (ATP-avhengig). Ved iskemi blir ventrikkelen stivere («stiff ventricle»), noe som fører til økt endediastolisk trykk (LVEDP).
- Systolisk dysfunksjon: Redusert kontraktilitet og regional veggbevegelsesforstyrrelse (hypokinesi). Dette kan visualiseres med stress-ekkokardiografi.
- EKG-forandringer: Endringer i repolariseringen, typisk manifestert som ST-segmentdepresjoner eller T-bølgeinversjoner.
- Angina Pectoris: Kliniske symptomer (brystsmerter/dyspné) er det siste trinnet i kaskaden.
Dette har viktige kliniske implikasjoner:
- Stum iskemi: Ettersom smerte kommer sist, kan pasienten ha betydelig iskemi (med veggbevegelsesutfall og EKG-forandringer) uten å føle smerte. Dette er spesielt hyppig hos diabetikere og eldre. Ca. 60 % av iskemiske episoder ved langtids-EKG er asymptomatiske.
- Diagnostisk sensitivitet: Metoder som stress-ekkokardiografi eller stress-MR (som ser veggbevegelse) kan teoretisk oppdage iskemi på et tidligere stadium eller med høyere sensitivitet enn pasientens symptomer eller EKG alene.
Når iskemi vedvarer, vil den reduserte ATP-produksjonen påvirke funksjonen til ionepumpene (spesielt Na+/K+-ATPasen). Dette fører til endret transmembranpotensial og strømning av ioner, som til slutt manifesterer seg som de ST-T-endringene vi ser på arbeids-EKG. Fravær av EKG-forandringer under uttalte brystsmerter taler sterkt imot, men utelukker ikke fullstendig, myokardiskemi (særlig ved iskemi i områder som er «stumme» på EKG, som f.eks. circumflexus-gebetet).