De hemodynamiske kreftene som driver koronar- og cerebral perfusjon samt ventilasjon av lungene under hjerte-lungeredning (HLR), skiller seg vesentlig fra fysiologien under spontan sirkulasjon. Formålet med HLR er å erstatte hjertets pumpefunksjon ved å skape store variasjoner i det intrathorakale trykket gjennom brystkompresjoner, dekompresjon og ventilasjon. Disse manøvrene tvinger arterielt blod gjennom lunge-, koronar- og hjernesirkulasjonen, samtidig som en viss gassutveksling i lungene opprettholdes. Det er gjennomført et stort antall eksperimentelle og observasjonelle studier for å optimalisere effektiviteten av HLR, men fremdeles er det betydelige kunnskapshull. Noen av de mest kritiske komponentene i gjeldende retningslinjer er primært basert på observasjonsdata (f.eks. kompresjonshastighet og -dybde) snarere enn store randomiserte kontrollerte studier. Med dagens strategier kan optimale kompresjoner og ventilasjoner generere et minuttvolum (Cardiac Output) som tilsvarer 15–25 % av normal verdi (Duggal et al.). Selv om dette representerer en «low-flow»-tilstand, er det, sammen med tidlig defibrillering, ofte tilstrekkelig til å opprettholde vital organperfusjon frem til gjenoppliving av 10–15 % av pasientene med hjertestans utenfor sykehus (OHCA) og 30–40 % av hjertestansene på sykehus (IHCA; Jerkeman et al.).
Mekanismer for blodstrøm: Thoraxpumpe vs. Hjertepumpe
For å forstå fysiologien er det nyttig å kjenne til de to rådende teoriene for hvordan blodstrøm genereres under HLR. Ved hjertepumpeteorien antas det at hjertet klemmes direkte mellom sternum og columna, noe som tvinger blod ut i aorta. Ved thoraxpumpeteorien antas det at kompresjon øker det generelle trykket i hele brysthulen. Siden arteriene motstår kollaps bedre enn venene, og fordi hjerteklaffene forhindrer retrograd strømning, presses blodet ut i periferien. Sannsynligvis bidrar begge mekanismene i ulik grad avhengig av pasientens anatomi, brystkassens compliance og kompresjonsteknikk.
Gjeldende retningslinjer anbefaler en kompresjonsdybde på 5–6 cm med en hastighet på 100–120 kompresjoner per minutt (figur 1). Disse anbefalingene representerer et kompromiss for å maksimere flow uten å påføre pasienten unødvendige skader eller redusere den diastoliske fyllingen som skjer ved for høy frekvens. Anbefalingene er basert på observasjonsdata (Stiell et al., Idris et al., Duval et al.). Randomiserte kliniske studier som isolerer disse variablene mangler i stor grad.
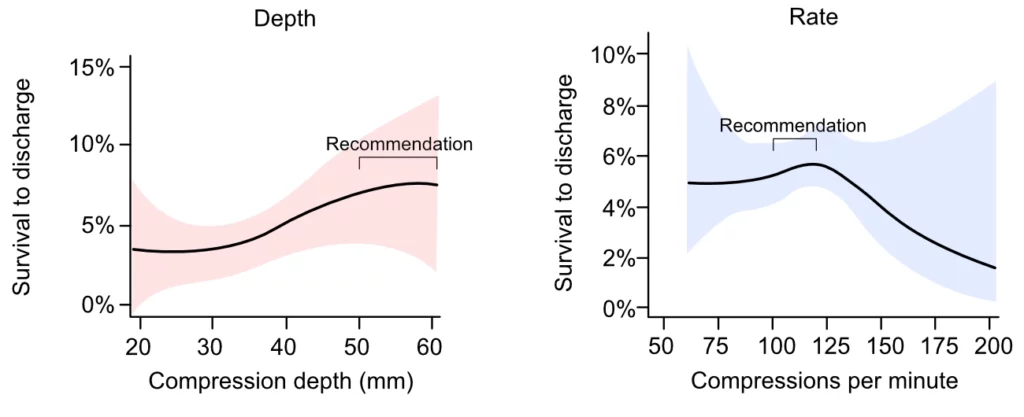
Duval et al. studerte 3 643 tilfeller av hjertestans utenfor sykehus i ROC PRIMED-studien. Disse pasientene ble inkludert i en randomisert studie som evaluerte effekten av et HLR-tilleggsutstyr (Impedance Threshold Device – ITD) og registrerte samtidig kompresjonshastighet og -dybde nøyaktig. De rapporterte at den ideelle kombinasjonen for overlevelse var 107 kompresjoner per minutt med en dybde på 4,7 cm. Denne kombinasjonen var konsistent på tvers av alder, kjønn, initialrytme og bruk av mekaniske hjelpemidler.
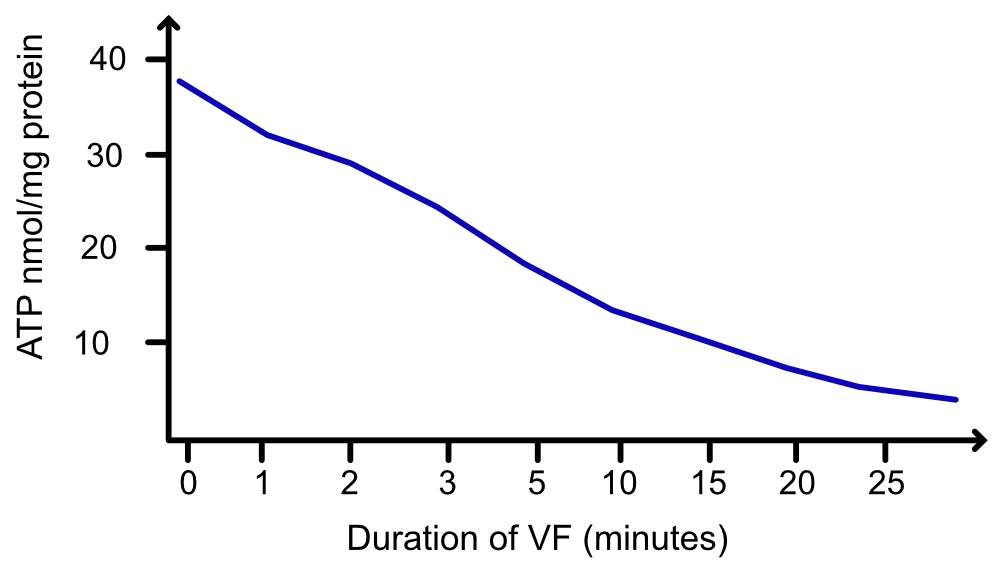
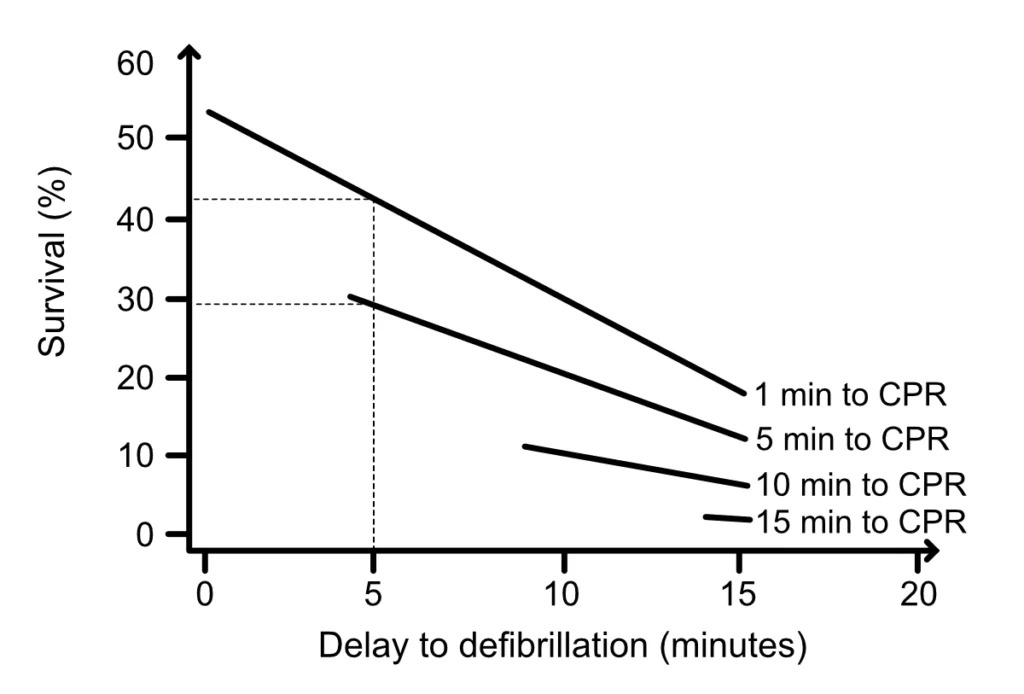
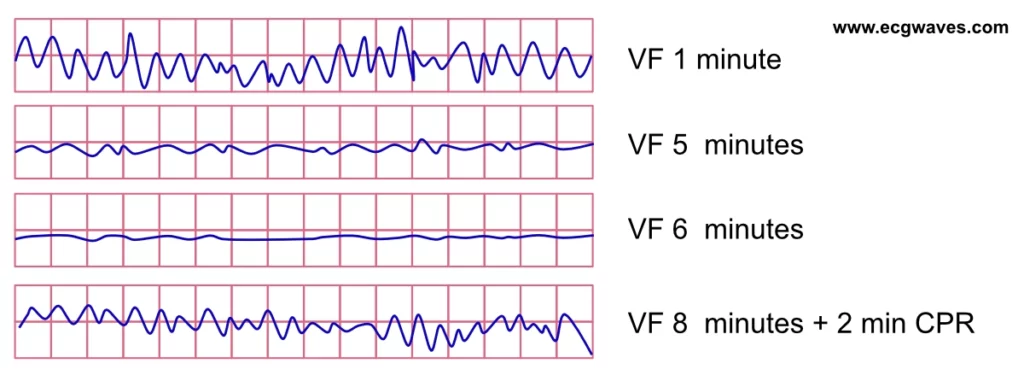
Defibrillering er den absolutt viktigste intervensjonen hvis rytmen er sjokkbar (ventrikkelflimmer [VF], pulsløs ventrikkeltakykardi [VT]). VF-bølgeformen er initialt grov (dvs. fibrillatoriske bølger har store amplituder), noe som indikerer relativt høye energilagre i myokard. Etter hvert som varigheten av VF forlenges uten effektiv HLR, reduseres amplituden gradvis, og fin VF (små fibrillatoriske amplituder) degenererer til slutt til asystole. Denne fysiologiske forverringen gjenspeiler hjertets metabolske tilstand. Den gradvise utviklingen fra grov VF til fin VF og til slutt asystoli er et direkte resultat av synkende ATP-konsentrasjon i myokardiet. ATP-depletering fører til svikt i ionepumpene, cellulær dysfunksjon og acidose, noe som gjør defibrillering ineffektiv. Sannsynligheten for vellykket defibrillering – definert som gjenopprettelse av en organisert rytme med puls (ROSC) – er høy ved grov VF (den tidlige, elektriske fasen), men avtar raskt etter hvert som bølgeformen blir finere (den metabolske fasen) (figur 2, 3 og 4).
I tilfeller med ikke-sjokkbar rytme eller med langvarige perioder med VF (fin VF som er resistent mot defibrillering), er hovedformålet med HLR å forsyne myokard med oksygenrikt blod for å gjenoppbygge energilagrene og muliggjøre elektrisk aktivitet. Dette krever et tilstrekkelig koronar perfusjonstrykk (CPP). Myokardaktivitet er en forutsetning for å redde hjernen, og er derfor av største betydning i den akutte fasen. Dette oppnås ved å utføre effektive brystkompresjoner og dekompresjoner som resulterer i perfusjon av hjerte-, hjerne- og lungevev.
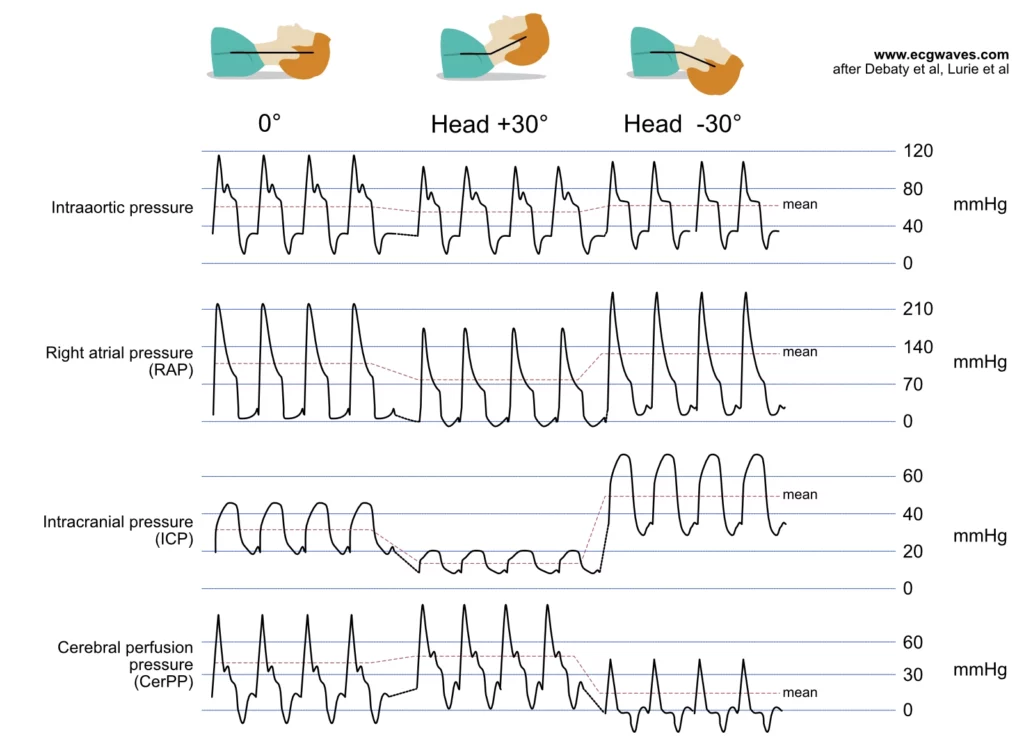
Brystkompresjoner gir perfusjon av vitale organer ved å øke trykket i forkamre, hjertekamre og store blodårer. Dette fører til at blodet presses fremover (anterograd flow), forutsatt at klaffefunksjonen er normal. En utfordring er at kompresjonene også øker trykket i thoraxvenene (paravertebrale vener, epiduralvener) som drenerer hjernen, ettersom disse mangler klaffer ved inngangen til thorax. Det økte trykket i disse venene forplanter seg til hjernen og motvirker den cerebrale arterielle blodstrømmen (den cerebrale blodstrømmen bestemmes av gradienten [forskjellen] mellom det cerebrale arterielle og venøse trykket/intrakranielt trykk). Dette fenomenet reduserer netto cerebral perfusjon. Dette er en av de største utfordringene når det gjelder å forbedre nevrologiske resultater ved gjenopplivning. Ulike eksperimenter (f.eks. hodeleie/head-up CPR, passiv benheving, bruk av ITD osv.) har blitt forsøkt for å optimalisere den venøse drenasjen fra hodet og forbedre den cerebrale perfusjonen under HLR (Debaty et al., Youcef et al.).
Kompresjonsfasen
Brystkompresjoner reduserer thoraxvolumet og øker thoraxtrykket. Dette fører til kompresjon av alle strukturer, inkludert atriene, ventriklene, luftveiene og de store karene. Hjertet presses sammen mellom brystbenet og ryggsøylen, og blodet tvinges i anterograd retning. Forutsatt at klaffeapparatet fungerer normalt (mitral- og tricuspidalklaffen lukkes), presses blodet ut i aorta og pulmonalarterien. Dette er den «systoliske» fasen av HLR.
Koronar perfusjonstrykk (CPP)
Koronar perfusjon er avgjørende for å gjenopprette og opprettholde hjertets elektriske aktivitet og oppnå ROSC (Return of Spontaneous Circulation). Studier viser at et koronarperfusjonstrykk (CPP) på minimum 15 mmHg er nødvendig for å indusere elektrisk aktivitet i myokardiet hos mennesker, selv om høyere trykk er assosiert med bedre utfall (Paradis et al.). Koronarperfusjonstrykket (CPP) defineres som drivtrykket over koronarkaret og beregnes på følgende måte:
CPP = Paorta, diastole – RAPdiastole
Paorta, diastole er det intra-aortale trykket i dekompresjonsfasen
RAPdiastole er trykket i høyre atrium i dekompresjonsfasen
Det er viktig å merke seg at CPP er tilnærmet 0 mmHg (dvs. ingen netto koronar blodstrøm) under selve kompresjonsfasen (systolen). Dette skyldes at trykkøkningen i thorax påvirker både aorta og høyre atrium omtrent likt, slik at trykkgradienten uteblir. Effektiv koronar blodstrøm oppstår derfor nesten utelukkende under dekompresjonsfasen («HLR-diastole»). Thoraxvolumet ekspanderer raskt under dekompresjonen, noe som skaper et negativt intrathorakalt trykk. Trykket i høyre atrium, høyre ventrikkel og venstre ventrikkel faller brått. Imidlertid sørger lukkingen av aortaklaffen for at det intra-aortale trykket forblir relativt høyt (takket være arteriell compliance og systemisk vaskulær motstand). Den resulterende trykkforskjellen mellom aorta og høyre atrium utgjør CPP.
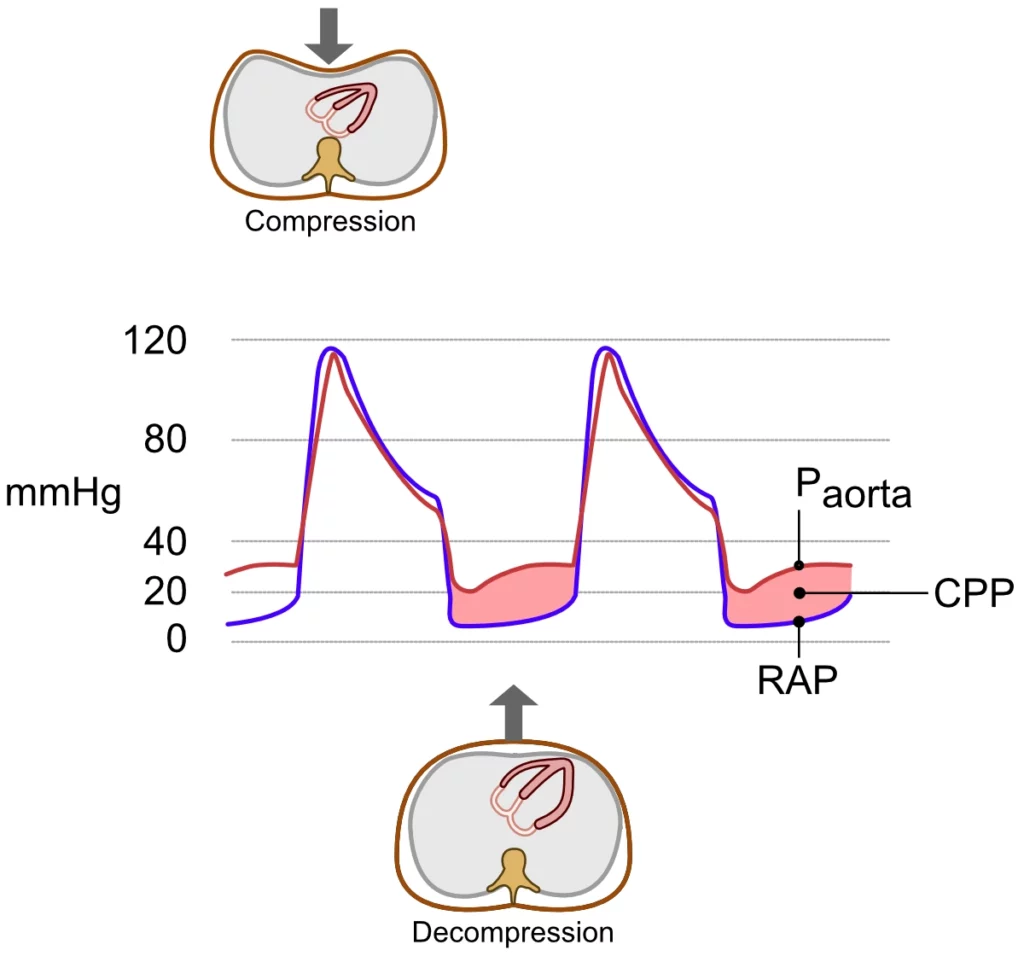
CPP er svært følsomt for avbrudd i kompresjonene («hands-off time»). Korte avbrudd (sekunder) får det aortale trykket til å kollapse nesten umiddelbart, og dermed oppheves CPP helt. Studier viser at det kan ta opptil 15 kompresjoner å gjenoppbygge CPP til et effektivt nivå etter et avbrudd (Steet et al., Berg et al.). Dette fenomenet understreker viktigheten av kontinuerlige kompresjoner og minimering av pauser («charging pre-shock»). Dette gjenspeiles i dyrestudier som viser at overlevelsen reduseres med så mye som 7 % for hvert 5. sekunds pause før defibrillering (Cheskes et al.).
Fordi koronar perfusjon er et diastolisk fenomen, er effektiv dekompresjon (full rekyl) like kritisk som selve kompresjonen for å generere høy CPP (Niemann et al.).
Vasoaktive legemidlers rolle for CPP
For å optimalisere CPP, gis adrenalin rutinemessig ved avansert HLR. Adrenalin er en potent vasopressor med både alfa- og beta-adrenerg effekt. Under hjertestans er det den alfa-adrenerge effekten (vasokonstriksjon) som er ønsket. Ved å øke den systemiske vaskulære motstanden (SVR), forhindres avrenning av blod fra arterier til vener i periferien under dekompresjonsfasen. Dette holder trykket i aorta (Paorta) oppe, noe som direkte øker CPP. Uten vasopressorer vil aorta-trykket ofte falle gradvis under langvarig HLR, noe som gjør ROSC mindre sannsynlig.
Kompresjonene fører også til økt trykk i venene i thorax (paravertebrale vener, epiduralvener) og spinalvæsken. Dessverre forplanter denne trykkøkningen seg til hjernen og fører til en økning i det venøse trykket intrakranielt, og dermed til økt intrakranielt trykk (ICP). Høyt ICP motvirker det cerebrale perfusjonstrykket (CerPP = Mean Arterial Pressure – ICP). Kompresjoner fører dermed paradoksalt nok til økt intrakranielt trykk (ICP), som kan redusere cerebral gjennomblødning. Likevel er det viktig å generere et høyt systemisk trykk for å sikre CPP, ettersom et fungerende hjerte er en forutsetning for å redde hjernen.
Under kompresjonsfasen skjer det en passiv ekspirasjon når lungevevet komprimeres. Dette muliggjør en viss, men minimal gassutveksling. Effektiviteten av denne gassutvekslingen avtar gradvis, med mindre det gis ventilasjon med positivt trykk (PPV). Dette forklares med at PPV utvider lungevevet – inkludert bronkioler, arterier og vener – og dermed senker motstanden i lungekretsløpet, noe som letter blodstrømmen gjennom lungene.
Dekompresjonsfasen
Under dekompresjonen skjer det en passiv rekyl (elastisk utvidelse) av thorax. Dette fører til en rask reduksjon av det intrathorakale trykket. Det resulterende relative vakuumet i brysthulen er motoren for venøs retur: Luft trekkes inn i alveolene, og blod suges mot hjertet. Høyre og venstre ventrikkel fylles passivt med blod (hovedsakelig fordi lavt trykk på høyre side øker gradienten for venøs retur fra vena cava til høyre atrium). Dekompresjonen reduserer også ICP (ved at trykket i de intrathorakale venene som drenerer hodet, reduseres) og letter dermed cerebral perfusjon i overgangen til neste kompresjon.
Tiltak som forsterker rekylen (ekspansjon av thorax), vil føre til forbedret preload (ventrikkelfylling) og dermed større slagvolum i neste kompresjonsfase (Frank-Starling-mekanismen, selv om den er begrenset under HLR). CPP vil også øke som følge av lavere trykk i høyre atrium. Det foregår en kontinuerlig utvikling av utstyr som forbedrer rekylen på ulike måter. Aktiv dekompresjon ved hjelp av sugeanordninger (f.eks. sugekoppen på mekaniske brystkompresjonsmaskiner som LUCAS) er allerede i bruk og har vist seg å kunne senke det intrathorakale trykket under nullpunktet, noe som potensielt øker venøs retur ytterligere (figur 9).

Det kan være livsfarlig å lene seg på brystet («leaning») under dekompresjon. Selv en liten vekt på brystkassen forhindrer fullstendig rekyl, noe som holder det intrathorakale trykket kunstig høyt i diastolen. Dette reduserer den venøse returen og øker trykket i høyre atrium, noe som direkte reduserer CPP. Dyrestudier viser at en rekyl på 75 % (sammenlignet med 100 %) reduserer CPP med ca. 30 % og CerPP med 50 % (Yannopoulos et al.). Observasjonsstudier viser at leaning forekommer i over 90 % av tilfellene i klinisk praksis, ofte uten at utøveren er klar over det (Fried et al.).
Ventilasjonsfasen
Ventilasjon under HLR utføres med overtrykksventilasjon (PPV), som tvinger luft inn i lungene (både ved munn-til-munn og bag-maske/tube). Dette skiller seg vesentlig fra normal fysiologisk respirasjon, der brystveggen og diafragma utvides aktivt. Sistnevnte skaper et negativt intrathorakalt trykk, og det resulterende vakuumet trekker luft inn i alveolene. Siden respirasjonsmuskulaturen er lammet under hjertestans, er PPV nødvendig for å opprettholde oksygenering over tid.
Det finnes imidlertid sterke bevis for at ventilasjon er sekundært til kompresjoner i den aller tidligste fasen av hjertestans (de første minuttene), spesielt ved sjokkbar rytme der blodet fortsatt er relativt oksygenert. Overlevelse er praktisk talt umulig uten kompresjoner som genererer et CPP over 15 mmHg. Ventilasjon er mindre kritisk i løpet av de første 4–5 minuttene («electrical phase»). Flere studier har testet HLR med kun kompresjoner (Hands-Only CPR), som innebærer å utsette ventilasjonen initialt. I en stor svensk randomisert studie var det ingen forskjell i overlevelse når tilstedeværende utførte HLR med kun kompresjon sammenlignet med standard HLR ved hjertestans utenfor sykehus (Svensson et al.). Lignende resultater ble rapportert i en stor observasjonsstudie (Jerkeman et al.). Som nevnt ovenfor resulterer kompresjoner i seg selv i en viss ventilasjon ved at luft presses ut og suges inn passivt (McDannold et al.).
Likevel anbefales overtrykksventilasjon så snart som mulig (spesielt ved 30:2 eller ved sikret luftvei), og det er helt avgjørende ved hypoksisk hjertestans (f.eks. drukning, kvelning) og hos barn. Effekten av ren kompresjons-HLR avtar etter noen minutter fordi lungekarene og bronkiolene gradvis kollapser (atelektaser) og oksygenreservene i blodet tømmes (Dunnham-Snary et al.). For å rekruttere lungevev og redusere pulmonal vaskulær motstand må det utføres overtrykksventilasjon (Markstaller et al.).
Hyperventilering er en vanlig feil under HLR og må alltid unngås. For hyppige eller for kraftige innbåsninger øker det gjennomsnittlige intrathorakale trykket betydelig. Dette forhindrer venøs retur til hjertet (preload-svikt). Hyperventilering fører også til økt trykk i høyre atrium under diastolen, noe som direkte reduserer CPP. I en dyrestudie ble CPP redusert med 28 % under hyperventilering, noe som resulterte i drastisk lavere overlevelse (Aufderheide et al.). I tillegg fører hyperventilering til hypokapni, som kan gi cerebral vasokonstriksjon og redusert blodstrøm til hjernen. Fordi hjertets minuttvolum er lavt under HLR (ca. 20-25 % av normalt), er behovet for CO2-eliminasjon redusert, og små tidevannsvolumer (500-600 ml) med lav frekvens (10/min) er tilstrekkelig.
Overvåkning av HLR-kvalitet: Kapnografi (EtCO2)
End-tidal CO2 (EtCO2) er kanskje den viktigste fysiologiske parameteren vi kan overvåke under pågående HLR (gitt at pasienten er intubert eller har supraglottisk luftvei). EtCO2-verdien korrelerer sterkt med lungeblodstrømmen og dermed hjertets minuttvolum (Cardiac Output) generert av kompresjonene. En lav EtCO2 (< 1,33 kPa / 10 mmHg) indikerer ineffektive kompresjoner og dårlig prognose, mens en verdi > 2,7 kPa (20 mmHg) tyder på adekvat perfusjon. En brå stigning i EtCO2 er ofte det første tegnet på ROSC, da spontan sirkulasjon vasker ut opphopet CO2 fra vevet.
Referanser
Keith G. Lurie, MD, Edward C. Nemergut, MD, Demetris Yannopoulos, MD, og Michael Sweeney, MD. Fysiologien ved hjerte-lungeredning. Anestesi og analgesi (2015).
Duggal C, Weil MH, Gazmuri RJ, Tang W, Sun S, O’Connell F, Ali M. Regional blodstrøm under hjertelungeredning med lukket brystkasse hos rotter. J Appl Physiol 1993;74:147-52.
Matilda Jerkeman, Peter Lundgren, Elmir Omerovic, Anneli Strömsöe, Gabriel Riva, Jacob Hollenberg, Per Nivedahl, Johan Herlitz, Araz Rawshani. Sammenhengen mellom type hjerte-lungeredning og overlevelse ved hjertestans utenfor sykehus: En maskinlæringsstudieResuscitation Plus. 2022 14. juni juni; 10: 100245.
Debaty G, Shin SD, Metzger A, Kim T, Ryu HH, Rees J, McKnite S, Matsuura T, Lick M, Yannopoulos D, Lurie K. Tilting for perfusion: head-up position during cardiopulmonary resuscitation improves brain flow in a porcine model of cardiac arrest. Gjenopplivning 2015;87:38-43.
Stiell IG, Brown SP, Christenson J, Cheskes S, Nichol G, Powell J, Bigham B, Morrison LJ, Larsen J, Hess E, Vaillancourt C, Davis DP, Callaway CW; Resuscitation Outcomes Consortium (ROC) Investigators. Hvilken rolle spiller brystkompresjonsdybden under gjenoppliving ved hjertestans utenfor sykehus? Crit Care Med 2012;40:1192-8 8.
Idris AH, Guffey D, Aufderheide TP, Brown S, Morrison LJ, Nichols P, Powell J, Daya M, Bigham BL, Atkins DL, Berg R, Davis D, Stiell I, Sopko G, Nichol G; Resuscitation Outcomes Consortium (ROC) Investigators. Sammenhengen mellom brystkompresjonsrater og utfall etter hjertestans. Sirkulasjon 2012;125:3004-12
Sue Duval, Paul E. Pepe, MD, MPH2,3,4,5,6; Tom P. Aufderheide, MD, MS7; et alJeffrey M. Goodloe, MD8; Guillaume Debaty, MD, PhD9,10; José Labarère, MD, PhD9,10; Atsushi Sugiyama, MD, PhD11; Demetris Yannopoulos, MD1 Optimal kombinasjon av kompresjonshastighet og -dybde under hjerte-lungeredning for funksjonelt gunstig overlevelse. JAMA Cardiol. 2019;4 (9):900-908. doi:10.1001/jamacardio.2019.2717
Bobrow BJ, Spaite DW, Berg RA, et al. HLR med kun brystkompresjon utført av lekmannsreddere og overlevelse etter hjertestans utenfor sykehus. JAMA. 2010;304 (13):1447-1454.
Markstaller K, Rudolph A, Karmrodt J, et al. Effekt av kun brystkompresjoner under eksperimentell grunnleggende livredning på alveolær kollaps og rekruttering. Resuscitation. 2008;79 (1):125-132.
McDannold R, Bobrow BJ, Chikani V, Silver A, Spaite DW, Vadeboncoeur T. Kvantifisering av ventilasjonsvolum produsert av kompresjoner under hjerte-lunge-redning på akuttmottak. Am J Emerg Med. 2018;36 (9):1640-1644.
Dunham-Snary KJ, Wu D, Sykes EA, et al. Hypoksisk pulmonal vasokonstriksjon: Fra molekylære mekanismer til medisin. Chest. 2017;151 (1):181-192.
Liste over forfattere. Leif Svensson, M.D., Ph.D., Katarina Bohm, R.N., Ph.D., Maaret Castrèn, M.D., Ph.D., Hans Pettersson, Ph.D., Lars Engerström, M.D., Johan Herlitz, M.D., Ph.D., og Mårten Rosenqvist, M.D., Ph.D. Compression-Only CPR or Standard CPR in Out-of-Hospital Cardiac Arrest. New England Journal of Medicine (2018).
Youcef Azeli, Alfredo Bardají, Eneko Barbería, Vanesa Lopez-Madrid, Jordi Bladé-Creixenti, Laura Fernández-Sender, Gil Bone, Elena Rica Susana Álvarez 11, Alberto Fernández, Christer Axelsson, Maria F Jiménez-Herrera. Kliniske resultater og sikkerhet ved passiv benheving ved hjertestans utenfor sykehus: en randomisert kontrollert studie. Critical Care (2021).
Duggal C, Weil MH, Gazmuri RJ, Tang W, Sun S, O’Connell F, Ali M. Regional blodstrøm under hjertelungeredning med lukket brystkasse hos rotter. J Appl Physiol 1993;74:147-52
Aufderheide TP, Sigurdsson G, Pirrallo RG, et al. Hyperventilasjonsindusert hypotensjon under hjerte-lunge-redning. Circulation 2004;109:1960-5.
Debaty G, Shin SD, Metzger A, Kim T, Ryu HH, Rees J, McKnite S, Matsuura T, Lick M, Yannopoulos D, Lurie K. Tilting for perfusion: head-up position during cardiopulmonary resuscitation improves brain flow in a porcine model of cardiac arrest. Gjenopplivning 2015;87:38-43
Niemann JT. Forskjeller i cerebral og myokardial perfusjon under gjenopplivning med lukket brystkasse. Ann Emerg Med 1984;13:849-53
Halperin HR, Tsitlik JE, Guerci AD, et al. Determinanter for blodstrøm til vitale organer under hjerte-lunge-redning hos hunder. Circulation 1986;73:539-50.
Paradis NA, Martin GB, Rivers EP, et al. Coronary perfusion pressure and the return of spontaneous circulation in human cardiopulmonary resuscitation. JAMA 1990;263:1106-13.
Stiell IG, Brown SP, Christenson J, Cheskes S, Nichol G, Powell J, Bigham B, Morrison LJ, Larsen J, Hess E, Vaillancourt C, Davis DP, Callaway CW; Resuscitation Outcomes Consortium (ROC) Investigators. Hvilken rolle spiller brystkompresjonsdybden under gjenoppliving ved hjertestans utenfor sykehus? Crit Care Med 2012;40:1192-8 8.
Idris AH, Guffey D, Aufderheide TP, Brown S, Morrison LJ, Nichols P, Powell J, Daya M, Bigham BL, Atkins DL, Berg R, Davis D, Stiell I, Sopko G, Nichol G; Resuscitation Outcomes Consortium (ROC) Investigators. Sammenhengen mellom brystkompresjonsrater og utfall etter hjertestans. Sirkulasjon 2012;125:3004-12
Cheskes S, Schmicker RH, Verbeek PR, et al. Effekten av peri-sjokkpause på overlevelse fra sjokkbar hjertestans utenfor sykehus under PRIMED-studien fra Resuscitation Outcomes Consortium. Gjenopplivning 2014;85:336-42.
Bobrow BJ, Spaite DW, Berg RA, et al. HLR med kun brystkompresjon utført av lekmannsreddere og overlevelse ved hjertestans utenfor sykehus. JAMA – J Am Med Assoc. 2010;304 (13):1447-1454.
Markstaller K, Rudolph A, Karmrodt J, et al. Effekt av kun brystkompresjoner under eksperimentell grunnleggende livsstøtte på alveolær kollaps og rekruttering. Resuscitation. 2008;79 (1):125-132.
McDannold R, Bobrow BJ, Chikani V, Silver A, Spaite DW, Vadeboncoeur T. Kvantifisering av ventilasjonsvolum produsert av kompresjoner under hjerte-lunge-redning på akuttmottak. Am J Emerg Med. 2018;36 (9):1640-1644.
Dunham-Snary KJ, Wu D, Sykes EA, et al. Hypoksisk pulmonal vasokonstriksjon: Fra molekylære mekanismer til medisin. Chest. 2017;151 (1):181-192.
Kun kompresjons-HLR eller standard HLR ved hjertestans utenfor sykehus Liste over forfattere. Leif Svensson, M.D., Ph.D., Katarina Bohm, R.N., Ph.D., Maaret Castrèn, M.D., Ph.D., Hans Pettersson, Ph.D., Lars Engerström, M.D., Johan Herlitz, M.D., Ph.D., og Mårten Rosenqvist, M.D., Ph.D
Steen S, Liao Q, Pierre L, et al. Den kritiske betydningen av minimal forsinkelse mellom brystkompresjoner og påfølgende defibrillering: en hemodynamisk forklaring. Gjenopplivning 2003;58:249-58. 19
Berg RA, Sanders AB, Kern KB, et al. Negative hemodynamiske effekter av å avbryte brystkompresjoner for gjenopplivningspusting under hjerte-lunge-redning ved hjertestans med ventrikkelflimmer. Circulation 2001;104:2465-70.
Yannopoulos D, McKnite S, Aufderheide TP, et al. Effekter av ufullstendig dekompresjon av brystveggen under hjerte-lungeredning på koronar- og cerebralt perfusjonstrykk i en svinemodell for hjertestans. Resuscitation 2005;64:363-72.
Fried DA, Leary M, Smith DA, et al. Utbredelsen av brystkompresjon som lener seg under hjerte-lungeredning på sykehus. Resuscitation 2011;82:1019-24.