Diagnostiske kriterier for akutt hjerteinfarkt: Hjertetroponiner, EKG og symptomer
Akutt hjerteinfarkt: Definisjon og kriterier
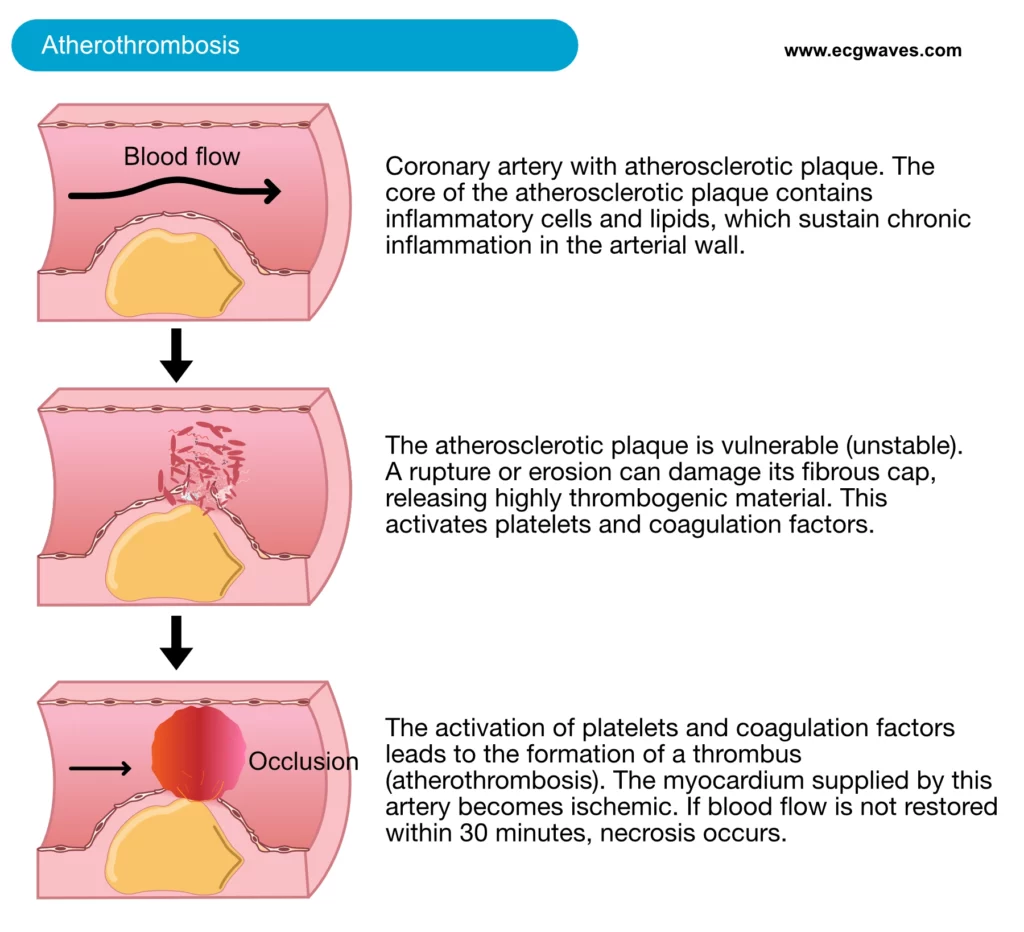
Akutt hjerteinfarkt er den alvorligste manifestasjonen av iskemisk hjertesykdom og representerer en akutt medisinsk nødssituasjon. Den patofysiologiske hovedmekanismen er oftest ruptur eller erosjon av et sårbart (ustabilt) aterosklerotisk koronarplakk. Ved en slik hendelse eksponeres subendotelialt vev og svært trombogene materialer, spesielt vevsfaktor, for blodstrømmen. Dette initierer umiddelbar aktivering av sirkulerende blodplater og koagulasjonskaskaden, noe som resulterer i intraluminal trombedannelse (figur 1).
Når et aterosklerotisk plakk rupturerer, kan det også frigjøre ateromatøst debris distalt, som kan forårsake mikrovaskulær embolisering og obstruksjon av kapillærnettverket («no-reflow»-fenomenet). Trombosen fører til akutt okklusjon eller subtotal stenose av arterien, slik at blodstrømmen blir kritisk redusert. Følgelig blir myokardiet som forsynes av den aktuelle arterien, iskemisk. Dersom perfusjonen ikke gjenopprettes raskt, progredierer iskemien til irreversibel myokardnekrose (død av myocytter). Omfanget av nekrosen avhenger av okklusjonens varighet, karestørrelse og tilstedeværelsen av kollateral sirkulasjon.
Diagnostiske kriterier for akutt hjerteinfarkt
I henhold til den fjerde universelle definisjonen av hjerteinfarkt (2018), krever diagnosen påvisning av akutt myokardskade med kliniske tegn på akutt myokardiskemi. Diagnosen baseres på en integrering av følgende tre komponenter:
- Hjertetroponiner (Biomarkører) – Deteksjon av stigning og/eller fall i hjertetroponiner (cTn), med minst én verdi over 99-persentilen av øvre referansegrense (URL). Dette er obligatorisk for å stille diagnosen hjerteinfarkt, gitt at det foreligger iskemiske tegn.
- EKG-forandringer – Nye iskemiske EKG-forandringer, inkludert nye ST-elevasjoner, signifikante ST-depresjoner, T-bølgeinversjoner, eller utvikling av patologiske Q-bølger. Også nyoppstått venstre grenblokk (LBBB) kan i visse kliniske settinger betraktes som iskemiequivalent.
- Kliniske symptomer – Pasienter med akutt hjerteinfarkt presenterer seg typisk med iskemiske brystsmerter. Det er imidlertid viktig å være oppmerksom på atypiske symptomer som dyspné, kvalme, epigastriske smerter, uforklarlig utmattelse eller synkope, spesielt hos kvinner, eldre og diabetikere.
Diagnosen akutt hjerteinfarkt skiller seg fra akutt myokardskade ved at det må foreligge bevis for iskemi. Myokardskade er definert kun ved forhøyet troponin, mens infarkt krever myokardskade i en klinisk setting av iskemi (symptomer, EKG, eller bildediagnostikk som viser tap av levedyktig myokard eller nye regionale veggbevegelsesforstyrrelser).
Troponiner og andre biomarkører for myokardnekrose
Hjertemuskelceller tåler omtrent 20 minutter med fullstendig iskemi før irreversibel skade inntreffer. Etter dette tidspunktet kollapser cellemembranene, og intracellulære proteiner lekker ut i interstitiet og videre til sirkulasjonen. Det er mulig å påvise stigning i myokardspesifikke proteiner i blodet allerede 1–3 timer etter symptomdebut, avhengig av analysens sensitivitet. Hjertetroponin T (cTnT) og troponin I (cTnI) er de foretrukne biomarkørene og gullstandarden for diagnostikk, da de har overlegen vevsspesifisitet og sensitivitet sammenlignet med eldre markører som CK-MB.
Innføringen av høysensitive troponinanalyser (hs-cTn) har revolusjonert diagnostikken. Disse analysene kan detektere troponinkonsentrasjoner langt ned i det normale referanseområdet hos friske individer. Dette gjør det mulig å oppdage mikroskopiske infarkter som tidligere gikk under radaren. Økt sensitivitet har ført til en diagnostisk glidning («troponin shift») hvor tilstander som tidligere ble klassifisert som ustabil angina, nå diagnostiseres som små NSTEMI (Non-ST-Elevation Myocardial Infarction). Dette forklarer reduksjonen i insidensen av ustabil angina og den tilsvarende økningen i NSTEMI de siste tiårene. For en dypere forståelse anbefales E. Braunwald: Unstable Angina: Is It Time for a Requiem? Circulation, 2013.
Referansegrense for troponiner
Diagnostisk grenseverdi (cut-off) er definert som 99-persentilen (øvre referansegrense, URL) i en frisk referansepopulasjon. Enhver verdi over denne grensen indikerer myokardskade. Det er viktig å merke seg at troponinnivåer kan variere mellom ulike analysemetoder og mellom kjønn (kvinner har ofte lavere normale fysiologiske verdier enn menn), og mange laboratorier opererer nå med kjønnsspesifikke grenser.
Troponindynamikk: Nøkkelen til diagnose
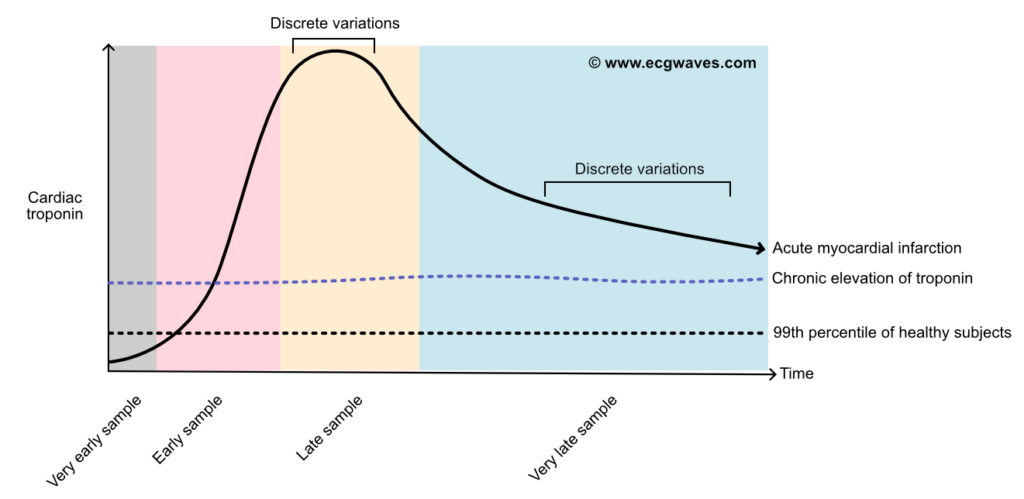
En enkelt forhøyet troponinverdi er ikke tilstrekkelig for å diagnostisere et akutt infarkt, da dette kan skyldes kronisk myokardskade (f.eks. ved hjertesvikt eller nyresvikt). Kriteriet for akutt hjerteinfarkt krever en signifikant endring (dynamikk) i form av stigning eller fall mellom to prøver. Ved bruk av høysensitive analyser har ESC (European Society of Cardiology) introdusert raske algoritmer for utredning:
- 0t/1t-algoritme (Anbefalt): Blodprøve ved innleggelse (0t) og etter 1 time (1t).
- 0t/2t-algoritme: Blodprøve ved innleggelse og etter 2 timer.
Disse algoritmene baserer seg på absolutte endringer i troponinkonsentrasjonen (ng/L) og tillater rask «rule-in» eller «rule-out» av hjerteinfarkt. Tradisjonell praksis med kontrollprøve etter 6 timer benyttes nå primært dersom de raske algoritmene ikke gir konklusivt svar, eller hs-cTn ikke er tilgjengelig.
Troponinnivåene begynner å stige 2–3 timer etter skaden, når en topp (peak) etter 24–48 timer, og kan forbli forhøyet i 7–14 dager (se figur 2). Den langsomme utvaskingen skyldes nedbrytning av det kontraktile apparatet i myocyttene. Vedvarende forhøyet troponin uten dynamikk taler for kronisk myokardskade heller enn akutt infarkt.
Differensialdiagnoser ved forhøyet troponin
Selv om troponin er organspesifikt for hjertet, er det ikke sykdomsspesifikt for hjerteinfarkt (koronarokklusjon). Enhver fysiologisk eller patologisk prosess som stresser myokard eller skader myocytter kan gi troponinslipp. Klinikerens oppgave er å skille Type 1 infarkt (aterotrombose) fra andre årsaker, ofte kalt Type 2 infarkt eller myokardskade. Viktige differensialdiagnoser inkluderer:
- Kardiale årsaker (ikke-koronare):
- Akutt og kronisk hjertesvikt (veggstress og subendokardiell iskemi)
- Myokarditt og perimyokarditt
- Takotsubo kardiomyopati («Broken heart syndrome»)
- Hjertekontusjon, ablasjon, elektrisk kardioversjon
- Takyarytmier og bradyarytmier
- Aortadisseksjon
- Systemiske årsaker:
- Lungeemboli (høyresidig belastning)
- Sepsis og septisk sjokk
- Nyresvikt (redusert utskillelse og kronisk metabolsk stress)
- Hjerneslag (nevrogen «stunning»)
- Rabdomyolyse med myokardaffeksjon
- Kjemoterapi-indusert kardiotoksisitet
- Ekstrem fysisk anstrengelse
Andre biomarkører for myokardnekrose
Før troponinets æra var CK-MB, total CK og Myoglobin standard. Disse har i dag begrenset diagnostisk verdi i den akutte fasen når hs-cTn er tilgjengelig. Figur 2 illustrerer frigjøringskinetikken for disse proteinene.
CK-MB og Myoglobin
CK-MB (Kreatin Kinase-MB isoenzym) brukes nå primært i to situasjoner: 1) Når troponinanalyser ikke er tilgjengelige, eller 2) For å diagnostisere re-infarkt. Siden troponin forblir forhøyet i opptil 2 uker, vil en ny stigning være vanskelig å tolke. CK-MB normaliseres derimot raskt (innen 48–72 timer). En ny stigning i CK-MB hos en pasient som nylig har hatt infarkt, er derfor en sterk indikator på et nytt iskemisk event. Myoglobin stiger svært raskt (1–2 timer), men har lav spesifisitet da det også finnes i skjelettmuskulatur, og brukes sjelden rutinemessig i dag.
EKG-kriterier for iskemi og infarkt
EKG ved myokardiskemi
Elektrokardiogrammet (EKG) er fortsatt det viktigste verktøyet for umiddelbar risikostratifisering. Akutt myokardiskemi endrer repolariseringen, noe som viser seg som endringer i ST-segmentet og T-bølgen (ST-T-forandringer). ST-elevasjon indikerer oftest transmural iskemi (fullveggsskade) grunnet total okklusjon, mens ST-depresjon indikerer subendokardiell iskemi (delvis okklusjon eller økt oksygenbehov).
- ST-segmentet: Signifikante ST-elevasjoner eller horisontale/nedadgående ST-depresjoner er sterke markører for iskemi.
- T-bølger:
- Hyperakutte T-bølger: Brede, høye og symmetriske T-bølger kan være det aller tidligste tegnet på total okklusjon (før ST-elevasjon oppstår).
- T-bølgeinversjon: Dype, symmetriske, negative T-bølger oppstår ofte i evolusjonen av et infarkt eller ved reperfusjon (post-iskemiske forandringer). Isolert T-inversjon uten klinikk eller troponinutslag er mindre spesifikt.
EKG ved hjerteinfarkt (Q-bølgeinfarkt)
Når iskemien har ført til nekrose, mister myokardiet sin elektriske aktivitet. Dette manifesterer seg som patologiske Q-bølger (dype og brede negative utslag i starten av QRS-komplekset) eller redusert R-bølgeamplitude (tap av R-progresjon). Fragmenterte QRS-komplekser kan også være tegn på arrvev i myokard.
Lokalisasjon og resiprokale endringer
For å diagnostisere infarkt må EKG-forandringene være til stede i minst to anatomisk tilstøtende avledninger. Lokalisasjonen av forandringene gir informasjon om hvilken koronararterie som er affisert:
- Anterior (V1–V4): Venstre fremre nedadgående arterie (LAD).
- Inferior (II, III, aVF): Høyre koronararterie (RCA) eller venstre cirkumfleks (CX).
- Lateral (I, aVL, V5–V6): CX eller diagonalen fra LAD.
Ved STEMI ser man ofte resiprokale (speilvendte) ST-depresjoner i de motsatte avledningene. For eksempel vil et inferiort infarkt (ST-elevasjon i II, III, aVF) ofte gi ST-depresjoner i I og aVL. Dette styrker diagnosen og skiller ofte STEMI fra perikarditt.
Risikostratifisering og spesielle mønstre
Blant pasienter med brystsmerter er EKG avgjørende for triage. Tabell 1 viser alvorlighetsgraden av ulike funn. Det er verdt å merke seg at spesifikke mønstre som Wellens’ syndrom (bifasiske eller dypt inverterte T-bølger i V2-V3) eller de Winter-mønster (ST-depresjon med høye symmetriske T-bølger) er ekvivalenter til LAD-stenose og krever rask intervensjon, selv uten klassisk ST-elevasjon.
Tabell 1. Risikostratifisering ved hjelp av EKG
| EKG | KLASSIFISERING AV INFARKT | |
| 1 | Normalt eller inkonklusivt EKG | NSTEMI (hvis troponin er positiv) |
| 2 | Isolerte T-bølgeinversjoner | NSTEMI |
| 3 | ST-senkninger | NSTEMI |
| 4 | ST-depresjon og T-bølgeinversjon | NSTEMI / Høyrisiko ustabil angina |
| 5 | Venstre grenblokk (LBBB) | Pasienter med venstre grenblokk (LBBB) utgjør en utfordring da blokket kan maskere iskemiske forandringer. Tidligere ble ny LBBB automatisk behandlet som STEMI. I henhold til gjeldende ESC-retningslinjer (2017/2020) skal pasienter med LBBB og klinisk mistanke om iskemi (hemodynamisk ustabilitet eller akutt hjertesvikt) vurderes for akutt angiografi, uavhengig av om blokket er nytt eller gammelt. Sgarbossa-kriteriene kan brukes til å identifisere infarkt ved LBBB. |
| 6 | ST-elevasjon | STEMI |
| 7 | ST-elevasjon og ST-depresjon | STEMI (ST-depresjonene er ofte resiprokale) |
Sammenhengen mellom EKG-forandringer og dødelighet hos pasienter med akutt koronarsyndrom er undersøkt i flere studier. Figur 3 viser resultater fra GUSTO-II-studien. Selv om STEMI har høyest mortalitet i akuttfasen, har NSTEMI-pasienter ofte høyere langtidssykelighet og mortalitet grunnet høyere alder og komorbiditet. I tillegg til EKG benyttes kliniske risikoskårer som GRACE og TIMI-score for å beregne risiko for død eller re-infarkt, noe som styrer tidspunktet for invasiv utredning (koronar angiografi).
Symptomer på akutt hjerteinfarkt og iskemi
Angina pectoris er kardinalsymptomet på myokardiskemi. Typisk beskrives dette som et retrosternalt ubehag – en følelse av trykk, tyngde, klemming eller svie. Smerteutstråling til venstre skulder, arm, hals/kjeve eller rygg (mellom skulderbladene) øker sannsynligheten for kardiell årsak. Varighet over 20 minutter til tross for hvile eller bruk av nitroglyserin er sterkt suspekt på infarkt.
Ledsagende autonome symptomer inkluderer kvalme, oppkast, kaldsvette (diaforese), blekhet og angst (dødsangst). Det er avgjørende å gjenkjenne atypiske symptomer. Kvinner, eldre og pasienter med diabetes presenterer seg oftere med dyspné (åndenød), uttalt slapphet eller akutt forvirring uten typiske brystsmerter. Hos diabetikere kan «stumme infarkter» forekomme grunnet autonom nevropati.
Differensialdiagnoser
Akutte brystsmerter krever bred differensialdiagnostisk tankegang. Livstruende tilstander må utelukkes først:
- Kardiovaskulære (Kritiske): Akutt koronarsyndrom (STEMI/NSTEMI/Ustabil angina), aortadisseksjon (tyngre, rivende smerte mot rygg), lungeemboli, tamponade.
- Andre hjerteårsaker: Perimyokarditt (stillingsavhengig smerte), arytmier, aortastenose, Prinzmetals angina (koronarspasme), Takotsubo.
- Lungesykdom: Pneumothorax (ensidig, pleurittisk smerte), lungebetennelse, pleuritt.
- Gastrointestinal: GERD (refluks), ulcus ventriculi, øsofagusspasme/ruptur (Boerhaaves syndrom), akutt kolecystitt eller pankreatitt.
- Muskel- og skjelett: Tietzes syndrom (kostokondritt), ribbeinsbrudd, myalgi.
- Nevrologisk/Psykiatrisk: Herpes zoster (smerter før utslett), angst/panikkanfall.
Klassifisering av hjerteinfarkt (Kliniske typer)
Tradisjonelt deles hjerteinfarkt inn i STEMI og NSTEMI basert på EKG for å styre akuttbehandlingen (reperfusjon). For å forstå patofysiologien og velge riktig langtidsbehandling, benyttes den universelle inndelingen i fem typer:
Klinisk klassifisering
Type 1: Spontant hjerteinfarkt (Aterotrombose) – Dette er det klassiske hjerteinfarktet forårsaket av plakkruptur, sårdannelse eller erosjon med påfølgende trombedannelse som okkluderer lumen. Pasienten har som regel underliggende koronarsykdom. Behandlingen retter seg mot platehemming, antikoagulasjon og revaskularisering (PCI/CABG).
Type 2: Hjerteinfarkt grunnet mismatch mellom tilbud og etterspørsel – Her er det ikke primært en akutt trombe, men en ubalanse mellom myokardets oksygenbehov og tilførsel. Årsaker kan være koronarspasme, koronar emboli, anemi, arytmi, hypotensjon (sjokk) eller alvorlig hypertensjon. Behandlingen må rettes mot den underliggende årsaken (f.eks. korrigere anemi eller arytmi) i tillegg til hjertebeskyttelse.
Type 3: Hjerteinfarkt med dødelig utgang uten biomarkører – Plutselig hjertedød med symptomer på iskemi og antatt nye EKG-forandringer (eller ventrikkelflimmer), men der døden inntraff før blodprøver kunne tas eller analyseres.
Type 4a: PCI-relatert hjerteinfarkt: Infarkt som komplikasjon til perkutan koronar intervensjon (PCI). Defineres ved en stigning av cTn-verdier > 5 x 99-prosentil URL hos pasienter med normale utgangsverdier, kombinert med tegn på iskemi (EKG, angiografisk okklusjon eller billeddiagnostikk).
Type 4b: Stenttrombose – Infarkt forårsaket av trombose i en tidligere implantert stent/scaffold, dokumentert ved angiografi eller obduksjon.
Type 5: CABG-relatert hjerteinfarkt – Infarkt i forbindelse med koronar bypass-kirurgi. Definert ved cTn-verdier >10 x 99-prosentil URL kombinert med nye patologiske Q-bølger, angiografisk okklusjon av graft/kar, eller billeddiagnostisk tap av myokard.
MINOCA (Myocardial Infarction with Non-Obstructive Coronary Arteries)
Et viktig begrep i moderne kardiologi er MINOCA. Dette betegner pasienter som oppfyller kriteriene for hjerteinfarkt (symptomer + troponin + EKG/bilde), men hvor koronar angiografi ikke viser signifikant stenose (≥50 % okklusjon) i noen hovedkar. MINOCA utgjør ca. 6–8 % av alle hjerteinfarkt og er vanligere hos kvinner. Årsakene kan være sammensatte og inkluderer:
- Plakkruptur i små sidegrener eller eksentriske plakk som ikke sees godt på angiografi.
- Koronar vasospasme (Prinzmetals).
- Koronar mikrovaskulær dysfunksjon.
- Spontan koronararteriedisseksjon (SCAD).
- Koronar emboli/trombose med spontan lyse.
Utredning av MINOCA krever ofte avansert billeddiagnostikk som intravaskulær ultralyd (IVUS), OCT eller hjerte-MR for å skille det fra myokarditt eller Takotsubo.
