Avansert hjerte-lungeredning (HLR) – Avansert hjerte-lungeredning (ACLS)
Dette kapittelet tar for seg intervensjoner og evalueringer som utføres under avansert hjerte- og lungeredning (ACLS). Mens grunnleggende hjerte- og lungeredning (BLS) kan utføres av legfolk, utføres avansert hjerte- og lungeredning (ACLS) av helsepersonell med spesialiserte ferdigheter og avansert utstyr. Selv om ACLS er mer ressurskrevende enn BLS, er den absolutte risikoreduksjonen for mange ACLS-spesifikke tiltak lavere sammenlignet med tidlig defibrillering og høykvalitets brystkompresjoner. De største mulighetene for overlevelse finnes i løpet av de første minuttene etter kollaps gjennom rask iverksettelse av kjeden som redder liv. Tabell 1 viser NNT (number needed to treat) for ulike intervensjoner som inngår i BLS og ACLS, og illustrerer viktigheten av de basale tiltakene.
| Intervensjon | BLS eller ACLS | NNT for å redde 1 person | Referanse |
|---|---|---|---|
| Tidlig oppdagelse av hjertestans | BLS | 11 | Berdowski et al |
| HLR av tilskuere | BLS | 15 | Hasselqvist et al |
| Tidlig defibrillering | BLS (hvis AED er tilgjengelig) | 5 | Kitamura et al |
| Adrenalin (epinefrin) | ACLS | 112 | Perkins et al |
| Avansert luftvei | ACLS | Uklar nytteverdi | Panchal et al |
| Trakeal intubasjon vs. bag-maske-ventilasjon | ACLS | Uklar fordel | Jabre et al |
| Mekaniske kompresjoner | ACLS | Ingen nytte (rutinemessig bruk) | Rubertsson og medarbeidere |
| Amiodaron, Lidokain | ACLS | Uklar nytte | Kudenchuk og medarbeidere |
| ECMO | ACLS | Ingen fordel (uselektert populasjon) | Suverein et al |
| Målrettet temperaturstyring | ACLS | Ingen fordel (vs. normotermi) | Dankiewicz og medarbeidere |
| Ekkokardiografi | ACLS | Ingen fordel (rutinemessig bruk) | Panchal og medarbeidere |
Number Needed to Treat (NNT) er antall pasienter som må behandles for å redde én til utskrivelse eller gunstig nevrologisk utfall. Lave tall indikerer høy effekt. Merk at manglende evidens for ACLS-tiltak ikke betyr at de er uten verdi, men at effekten er vanskeligere å isolere i studier sammenlignet med tidlig sjokk og kompresjoner.
AED = automatisk ekstern defibrillator. ECMO = ekstrakorporeal membranoksygenering. ALS = avansert hjerte- og lungeredning.
Avansert hjerte-lunge-redning (ACLS) bør iverksettes så tidlig som mulig, parallelt med høykvalitets BLS. Ved hjertestans utenfor sykehus (OHCA) utføres ACLS av ambulansepersonell, anestesisykepleiere eller leger (f.eks. luftambulanse), avhengig av det lokale prehospitale systemet. ACLS er en systematisk tilnærming som inkluderer etablering av avansert luftvei, defibrillering av sjokkbare rytmer, administrering av vasopressorer og antiarytmika, samt identifikasjon og behandling av reversible årsaker (H-er og T-er). Kontinuerlig revurdering av prognose og respons på behandling er essensielt.
Retningslinjene for hjertestans på sykehus anbefaler at HLR skal startes umiddelbart, og at defibrillering skal utføres innen 3 minutter (helst raskere) ved bekreftet sjokkbar rytme (VF/pVT).
Effektiv HLR krever et fast underlag. Hvis pasienten ligger i en myk seng, bør man bruke «CPR-modus» på sengen (hvis tilgjengelig) eller raskt plassere et ryggbrett under pasientens thorax, evt. flytte pasienten til gulvet dersom dette kan gjøres uten betydelige avbrudd.
Luftveier
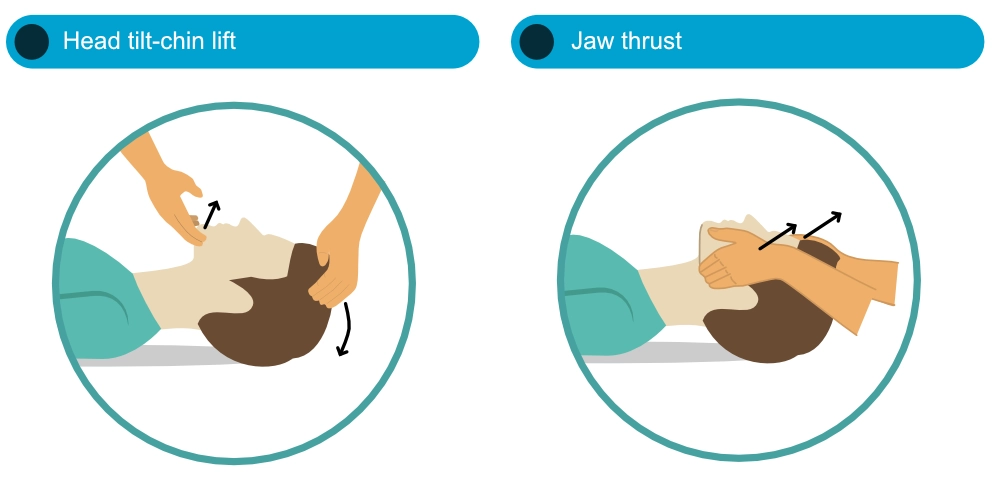
Håndtering av luftveier under hjertestans må balanseres mot behovet for kontinuerlige brystkompresjoner. Metoden med å vippe hodet og løfte haken er effektiv for å åpne luftveiene hos de fleste. Det er imidlertid fortsatt debatt om hvilken metode som er optimal for å sikre luftveiene i den tidlige fasen (Guildner et al.). Kjevepress (jaw thrust) er å foretrekke hvis det er mistanke om skade på halsryggen (f.eks. ved traume), og i så fall bør hodeleieendringer minimeres.
Ingen store studier har entydig vist overlegenhet for endotrakeal intubasjon sammenlignet med supraglottiske luftveier (SGA) når det gjelder overlevelse med godt nevrologisk utfall ved OHCA, spesielt når intubasjon utføres av personell med lav eksponering. Endotrakeal (trakeal) intubasjon anses som gullstandarden for luftveissikring fordi den beskytter mot aspirasjon, men kun forutsatt at den plasseres av erfarent personale med høy suksessrate. En supraglottisk luftvei (f.eks. i-gel, larynxmaske) er et utmerket alternativ som er raskere å legge inn og krever mindre opplæring. Nasofaryngeale luftveier kan forårsake komplikasjoner hos pasienter med kraniebrudd (risiko for intrakraniell feilplassering av tuben) eller koagulopati (risiko for blødning).
- En avansert luftvei (trakealtube, supraglottisk luftvei) bør vurderes etter initielle HLR-sykluser, men må ikke forsinke defibrillering.
- Luftveishåndtering bør ikke avbryte kompresjoner i mer enn 5 sekunder. Videolaryngoskopi anbefales der det er tilgjengelig for å øke suksessraten ved første forsøk.
- Effekten av cricoidtrykk (Sellicks manøver) for å forhindre aspirasjon er ikke dokumentert og kan vanskeliggjøre ventilasjon; rutinemessig bruk frarådes (Panchal et al.).
- Nasofaryngeale luftveier («trompeter») bør settes inn med forsiktighet. Risikoen for epistaxis (neseblødning) er betydelig, spesielt ved antitrombotisk behandling, og kan kompromittere luftveien.
Kapnografi (Bølgeformet kapnografi)
Bruk av bølgeformet kapnografi (ETCO2) er en klasse I-anbefaling ved ACLS. Det tjener flere kritiske formål:
- Bekreftelse av tubeposisjon: Den mest pålitelige metoden for å bekrefte at tuben ligger i trakea og ikke i øsofagus.
- Overvåking av HLR-kvalitet: ETCO2 korrelerer med hjerteminuttvolum (cardiac output) generert av kompresjoner. Verdier under 10 mmHg indikerer ineffektive kompresjoner, og man bør forsøke å forbedre kompresjonsteknikken eller bytte personell. Målet er ETCO2 > 20 mmHg.
- Deteksjon av ROSC: En plutselig, vedvarende stigning i ETCO2 (ofte til > 40 mmHg) er ofte det første tegnet på at spontan sirkulasjon er gjenopprettet, før pulsen er palpabel.
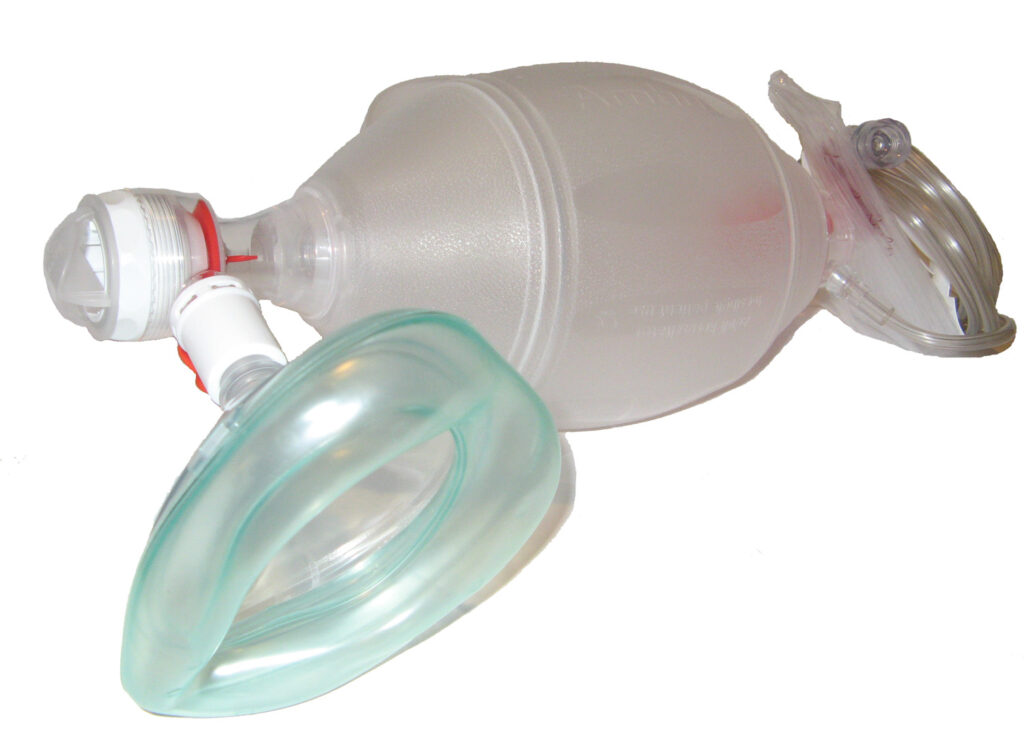

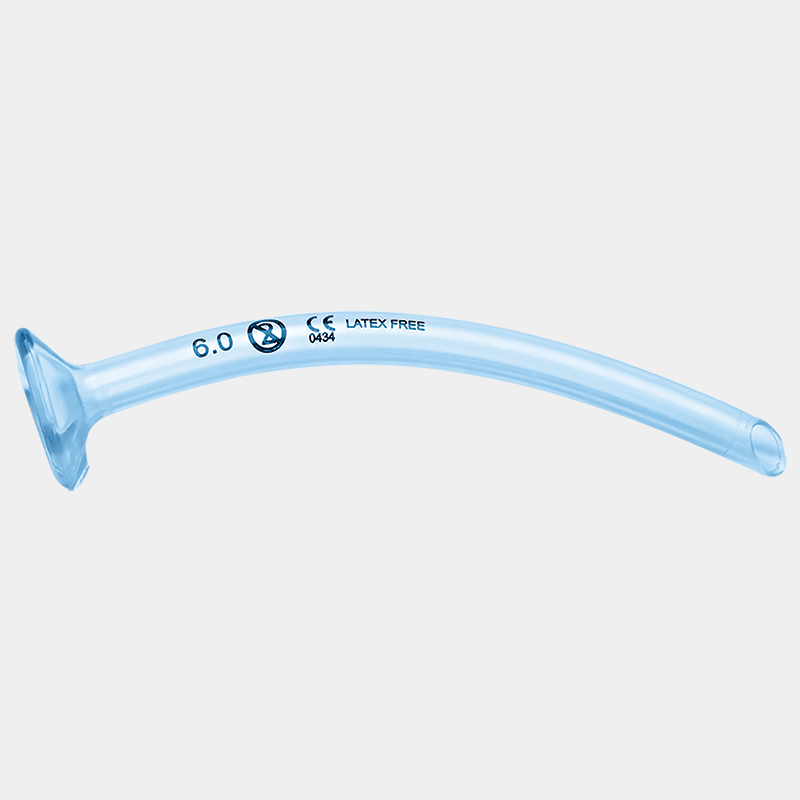
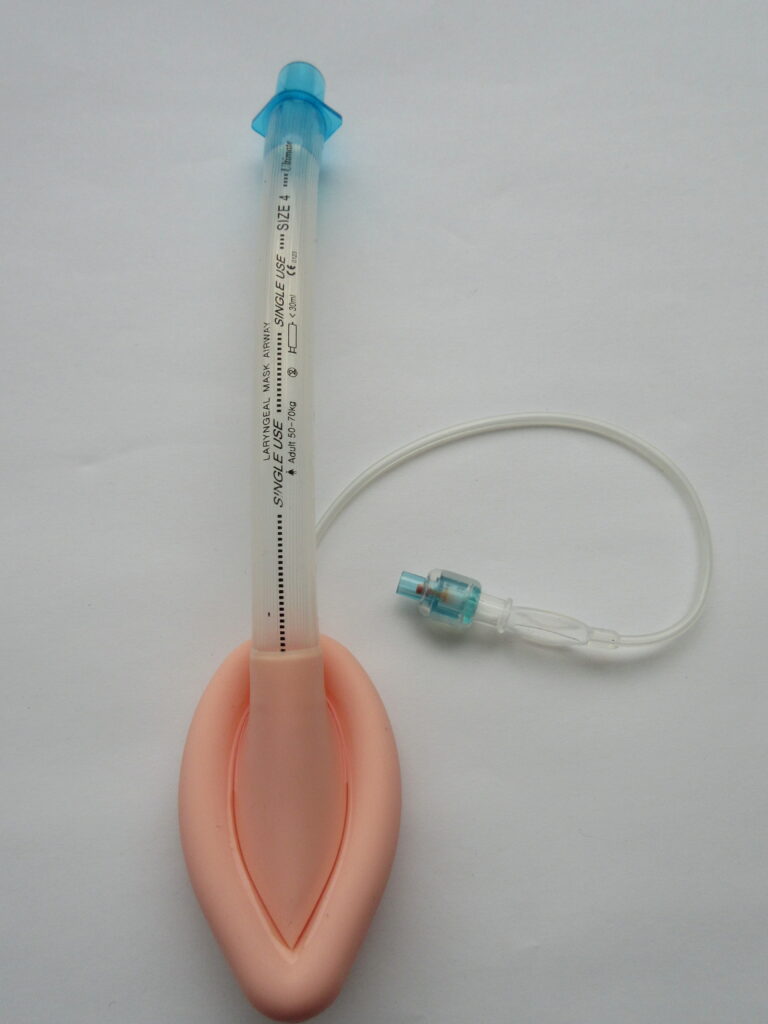

Ventilasjon
Ventilasjon kan utføres ved hjelp av munn-til-munn-innblåsninger (vanligvis kun i BLS), bag-maske-ventilasjon eller respirator. I en ACLS-setting med team er bag-maske standard inntil avansert luftvei er sikret. Effektiv ventilasjon er utfordrende og kan kreve to behandlere (én som holder masken med to hender for tetthet, og én som klemmer bagen).
Etter at en avansert luftvei er etablert (intubert eller SGA), fortsetter ventilasjon og kompresjon asynkront (dvs. at kompresjoner ikke avbrytes av ventilasjoner). Dette er en nøkkelkomponent i høykvalitets HLR.
- Ventiler med 10 innblåsninger/min (1 innblåsning per 6 sekunder). Det er viktig å ikke overstige dette, da hyperventilasjon er skadelig.
- Det brukes 100 % oksygen (O2) under pågående hjertestans. Etter ROSC titreres oksygenet for å unngå hyperoksi (se avsnitt om ROSC).
- Hvert pust gis over 1 sekund.
- Tidalvolumet skal være 500-600 ml og gi synlige brysthevninger. Unngå kraftig innblåsning.
- Posisjonen til en trakealtube kan bekreftes ved hjelp av kapnografi (kapittelet Kapnografi (ETCO2) ved hjertestans og gjenopplivning).
- Luftveiene må kontinuerlig revurderes for å sikre at de er åpne og at tuben ikke har dislokert.
Hvis det ikke er mulig å legge inn en avansert luftvei (trakealtube, supraglottisk luftvei), kan man bruke bag-mask-ventilasjon med ratio 30:2.
Overdreven ventilasjon (hyperventilasjon) er en svært vanlig feil. Dette fører til økt intrathorakalt trykk, som hemmer venøs retur til hjertet. Resultatet er redusert hjerteminuttvolum under kompresjoner og redusert sjanse for ROSC (Aufderheide et al.).
Brystkompresjoner
Kompresjonsfraksjon
Kompresjonsfraksjonen, dvs. den totale andelen av HLR-tiden som brukes til å utføre kompresjoner, bør være så høy som mulig, helst minst 60 %, med et mål om >80 %. Studier viser at en høyere kompresjonsfraksjon er forbundet med bedre utfall ved OHCA, uavhengig av initial rytme (Vaillancourt et al., Talikowska et al.). Hvert sekund med pause i kompresjoner fører til fall i koronarperfusjonstrykket. Observasjonsdata fra Resuscitation Outcomes Consortium Investigators viste en tre ganger høyere sannsynlighet for å bli utskrevet i live for pasienter i den høyeste kvintilen (for kompresjonsfraksjon) sammenlignet med den laveste (Christenson et al.).
Kompresjonsfraksjonen bør være minst 60 %. «Hands-on» tid er kritisk for organperfusjon.
Offerets posisjon
Den skadde må ligge i ryggleie på et fast underlag under HLR. Hvis pasienten befinner seg i en sykeseng, bør luftmadrasser tømmes («CPR-mode») og ryggbrett brukes for å sikre at kraften fra kompresjonene overføres til pasientens brystkasse og ikke absorberes av underlaget. En systematisk oversikt av Paganini et al. viste at ryggbrett kan marginalt øke kompresjonsdybden, men hovedfokuset må være på teknikk og kroppsstilling hos den som komprimerer.
Utføre manuelle brystkompresjoner
Høykvalitets brystkompresjoner er hjørnesteinen i gjenopplivning.
- Håndflaten (håndroten) på den ene hånden plasseres på nedre halvdel av brystbenet (midt på brystet), og den andre hånden plasseres på oversiden av den første hånden. Flett fingrene.
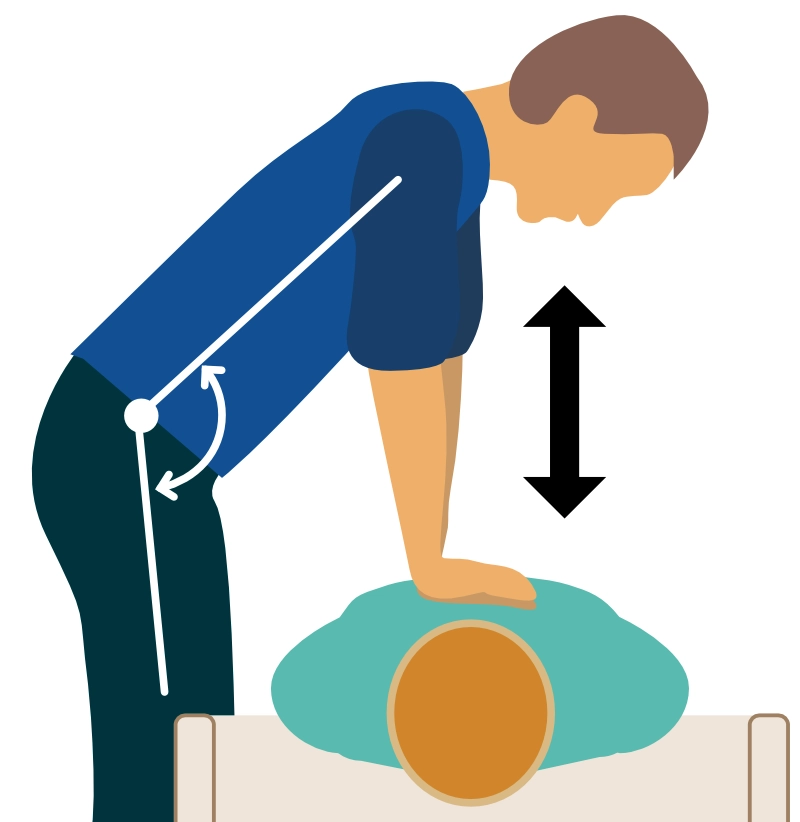
- Kompressoren bør bruke rygg- og overkroppsmuskulaturen til å utføre kompresjonsarbeidet (figur 3). Brystbenet trykkes ned med strake armer, og skuldrene skal være vertikalt over pasientens brystbein.
- Kompresjonshastigheten bør være 100 til 120 kompresjoner per minutt. Dette frekvensområdet optimaliserer hemodynamikken.
- Brystbenet skal trykkes ned 5,0-6,0 cm (2,0-2,4 tommer) hos voksne.
- Fullstendig rekyl: Brystkassen må slippes raskt og fullstendig opp etter hver kompresjon. Ikke len deg på brystkassen. Det er i rekylfasen (diastole) at hjertemuskelen får blodforsyning. Hvis brystkassen ikke får full rekyl, reduseres koronarperfusjonstrykket dramatisk.
- Bytt kompressor hvert 2. minutt, eller oftere ved tretthet, for å opprettholde kvalitet. Tretthet inntrer ofte før kompressoren selv merker det, noe som fører til redusert dybde (Sugerman et al.).
Bruk av tilbakemeldingsutstyr (f.eks. puck eller innebygd i defibrillator) som måler frekvens og dybde i sanntid anbefales for å sikre kvaliteten.
Forholdet mellom kompresjon og ventilasjon
Kompresjons-ventilasjonsratioen er forholdet mellom kompresjoner og ventilasjoner. Kompresjons-ventilasjonsforholdet i grunnleggende livreddende behandling (BLS) og innledende ACLS er som følger (Kleinman et al.):
- Voksne: 30:2 (30 kompresjoner etterfulgt av 2 ventilasjoner).
- Spedbarn og barn med én redningsmann: 30:2.
- Spedbarn og barn med to redningsmenn: 15:2 (helsepersonell).
Kompresjoner settes på pause for å gi innblåsninger i BLS. Etter at en avansert luftvei er etablert (supraglottisk luftvei [SGA] eller endotrakeal tube), går man over til kontinuerlige kompresjoner uten pauser for ventilasjon (Jabre et al.).
Kompresjonene fortsetter uavbrutt i ACLS etter at en avansert luftvei er lagt inn.
Pause før og etter sjokk
Peri-sjokk pauser (forsinkelser i kompresjoner rett før og etter defibrillering) er en sterk prediktor for mislykket sjokk. Pauser i HLR er assosiert med lavere frekvens av ROSC og overlevelse (Tang et al., Steen et al.).
- Pausen før og etter defibrillering må være minimal («Hands-off time» < 5 sekunder).
- Rytmesjekk bør være rask. Ved organisert rytme sjekkes puls (maks 10 sekunder), ellers gjenopptas kompresjoner umiddelbart.
- Kompresjonene gjenopptas alltid umiddelbart etter defibrillering, uten å sjekke rytme eller puls først. Hjertet er ofte «stunned» (mekanisk ineffektivt) rett etter et sjokk, selv om elektrisk normalrytme er gjenopprettet.
I ACLS er målet å redusere «no-flow time». Lad defibrillatoren mens kompresjoner pågår (pre-charging) for å minimere pausen ved sjokk.
Mekanismer som driver hjertets minuttvolum
Det er to hovedteorier for blodstrøm under HLR: «Cardiac pump theory» (direkte kompresjon av hjertet mellom sternum og ryggsøyle) og «Thoracic pump theory» (økning av intrathorakalt trykk driver blod ut av thorax). I praksis bidrar begge. Det kritiske målet er å oppnå et Koronarperfusjonstrykk (CPP) på minst 15 mmHg. CPP er differansen mellom aortisk diastolisk trykk og høyre atries diastoliske trykk. Uten tilstrekkelig CPP vil ikke myokardiet få nok oksygen til å gjenvinne spontan elektrisk aktivitet, og defibrillering vil ofte mislykkes (Ewy et al.). Å avbryte kompresjonene får CPP til å falle mot null umiddelbart, og det tar flere kompresjoner å bygge det opp igjen.
HLR med kun kompresjoner (håndholdt HLR)
HLR med kun kompresjoner (Hands-only CPR) er et konsept for lekfolk/innringere ved 113-sentralen for å senke terskelen for å starte HLR. I profesjonell ACLS skal pasienten alltid ventileres, da hypoksi og acidose utvikler seg over tid og blir begrensende faktorer for overlevelse, spesielt ved ikke-kardiale årsaker (asfyksi, druking, barn).
Mekaniske kompresjoner (MCPR, mekanisk HLR)
Mekanisk HLR krever utstyr som utfører kompresjoner automatisk. Eksempler på slike apparater er LUCAS, AutoPulse, Lifeline ARM og CorPuls (figur 4A-3D). Resultatstudier har ikke vist at rutinemessig bruk av disse apparatene gir bedre overlevelse enn god manuell HLR. Tvert imot kan pauser ved påmontering være skadelige.
Mekanisk HLR har imidlertid en viktig plass i spesifikke situasjoner:
- Transport: Når HLR må pågå under transport i ambulanse eller helikopter (der manuell HLR er ineffektivt eller farlig for mannskapet).
- PCI: Under perkutan koronar intervensjon i kateterlab.
- Forlenget HLR: Ved hypotermi, forgiftninger eller som bro til ECMO (ECPR).
Når det gjelder effekten av disse apparatene, kan følgende studier nevnes:
- AutoPulse (belte-system) viste blandede resultater i tidlige studier, men nyere data indikerer at det er trygt ved korrekt bruk.
- LUCAS (stempel-system) påvirket ikke overlevelsen i store randomiserte studier (LINC, PARAMEDIC), men viste seg likeverdig med manuell HLR.
- Systematiske oversikter konkluderer med at mekaniske kompresjoner er et godt alternativ når manuell HLR er vanskelig eller umulig å opprettholde med høy kvalitet.



Nedenfor følger videoinstruksjoner for LUCAS, AutoPulse, Lifeline ARM og CorPuls. Merk at disse videoene er produsert av produsentene.
- Corpuls 3 og Corpuls HLR
- AutoPulse
- Physio-Control LUCAS 3 brystkompresjonssystem
- Defibtech Lifeline ARM
Defibrillering
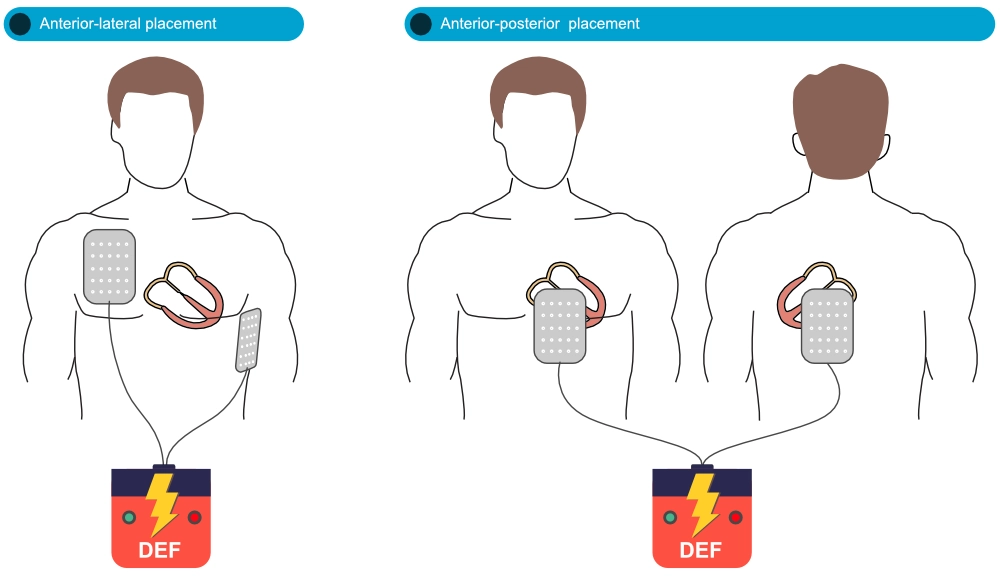
Tidlig defibrillering ved sjokkbar rytme (ventrikkelflimmer [VF] eller pulsløs ventrikkeltakykardi [pVT]) er den viktigste enkeltfaktoren for overlevelse. Defibrilleringselektrodene («pads») må plasseres for å maksimere strømvektoren gjennom ventriklene (Tung et al.). Ved anterior-lateral (sternal-apikal) posisjonering plasseres én elektrode til høyre for brystbenet (under kragebeinet) og én i venstre midtaksillærlinje (ca. V6-posisjon). Dette er standardplassering. Ved anterior-posterior posisjonering plasseres én elektrode på venstre precordium og én på venstre rygg (under scapula). Sistnevnte kan vurderes ved refraktær VF.
Moderne defibrillatorer bruker bifasiske støt, som er mer effektive og krever mindre energi enn de gamle monofasiske. Defibrillatoren måler impedansen i brystkassen og justerer strømmen deretter. Produsentens anbefalte energinivå (ofte 120-150 J start, deretter eskalerende til 200 J eller 360 J avhengig av merke) bør følges. Maksimal energi er ofte å foretrekke fremfor gjentatte sjokk med lav energi som mislykkes.
For å minimere tiden uten kompresjoner kan man bruke teknikken med pre-charging: Defibrillatoren lades mens brystkompresjoner pågår (f.eks. ved 1 minutt og 50 sekunder i syklusen). Når kompresjonene stanser, analyseres rytmen umiddelbart. Er den sjokkbar, avgis sjokket umiddelbart («Sjokk!»), og kompresjoner gjenopptas. Er den ikke sjokkbar, tømmes ladningen (dump charge) og kompresjoner fortsetter.
Artefaktfiltrering (som hos noen produsenter som Corpuls eller Zoll) gjør det mulig å se underliggende rytme under kompresjoner, men en formell stans for bekreftelse er ofte nødvendig for å unngå feiltolkning.


Risikoen for skade på pasientens hjerte ved defibrillering opp til 360 J er minimal sammenlignet med risikoen ved vedvarende hjertestans. Sikkerhet for personalet er viktig; unngå direkte kontakt med pasienten under sjokk, men bruk av isolerende hansker og «brystkompresjon under lading» er trygge prosedyrer i trente hender.
Hovedregelen er 1 sjokk etterfulgt av umiddelbar HLR i 2 minutter. Unntaket er bevist, monitorert VF/VT (f.eks. på intensivavdeling eller under kateterisering) hvor man kan gi inntil 3 sjokk på rad (stacked shocks) hvis defibrillatoren er umiddelbart klar, før man starter brystkompresjoner.
Eskalering av energinivå
Hvis et sjokk mislykkes, bør neste sjokk gis med samme eller høyere energi. Eskalerende energistrategi (f.eks. 200J -> 300J -> 360J) maksimerer sjansen for konvertering ved refraktær VF (Soar et al.).
Refribrillering og sjokkrefraktær ventrikkelflimmer
Omtrent 50 % av alle tilfeller av OHCA med sjokkbar rytme krever flere sjokk. VF/VT som vedvarer etter 3 defibrilleringsforsøk, kalles refraktær VF (også kalt elektrisk storm hvis det vedvarer over tid). Ved slike tilfeller må man vurdere:
- Er elektrodeplasseringen optimal? (Vurder å flytte pads).
- Er det reversible årsaker (H-er og T-er, se eget avsnitt) som iskemi eller elektrolyttforstyrrelser?
- Vurder antiarytmika (amiodaron/lidokain).
Cheskes et al. publiserte i 2022 en viktig studie (DOSE VF) som sammenlignet strategier ved refraktær VF:
- Standard defibrillering (fortsette som før).
- Vektorendring (VC)-defibrillering (bytte elektroder fra anterior-lateral til anterior-posterior).
- Dobbel sekvensiell ekstern defibrillering (DSED): To defibrillatorer kobles til pasienten, og sjokkene avgis raskt etter hverandre (mindre enn 1 sekunds mellomrom).
Studien viste at både DSED og vektorendring ga bedre overlevelse enn standardbehandling. DSED antas å senke defibrilleringsterskelen og dekke mer av myokardmassen. Dette er en avansert teknikk som krever opplæring og utstyr.
Pasienter med implanterbar kardioverterdefibrillator (ICD)
Ved hjertestans hos pasienter med pacemaker eller ICD skal man unngå å plassere defibrillator-pads direkte over enheten (kjennes som en hard klump under huden, ofte under venstre kragebein). Plasser elektroden minst 8 cm unna, gjerne i anterior-posterior posisjon. ICD-ens egne sjokk (ca 40 J) er sjelden kraftige nok til å konvertere en grov VF som krever ekstern defibrillering, og man skal ikke vente på at enheten skal virke. Redningsmannskap kan kjenne en liten kribling hvis de tar på pasienten når ICD-en slår, men det er ikke farlig.
Elektrisk konvertering av ventrikulær takykardi (VT)
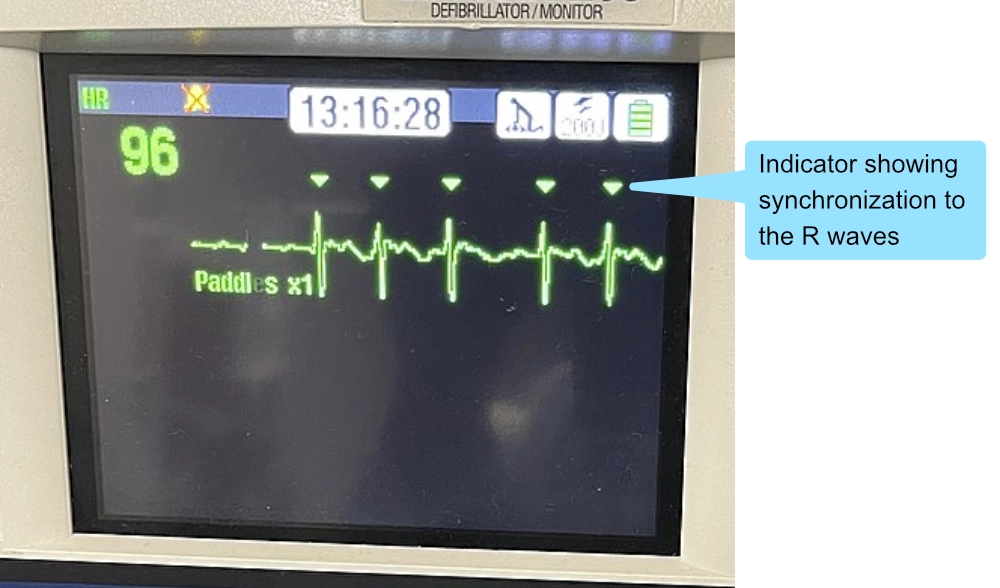
Pulsgivende VT hos en ustabil pasient krever synkronisert kardioversjon. Dette skiller seg fra defibrillering ved at sjokket times til R-takken i EKG for å unngå å treffe T-bølgen (sårbar fase), noe som kan utløse VF (R-på-T fenomenet).
Alle manuelle defibrillatorer har en «SYNC»-knapp. Når denne aktiveres, markerer apparatet R-takkene med prikker eller piler. Operatøren må holde «sjokk»-knappen inne til sjokket avgis (det kan være en liten forsinkelse mens maskinen venter på neste R-takk).
Defibrillering og kardioversjon er trygt for gravide og skal ikke utsettes av hensyn til fosteret. Mors overlevelse er forutsetningen for fosterets overlevelse.
Vellykket defibrillering (ROSC)
Etter et vellykket sjokk som gir ROSC, vil hjertet ofte være «stunned» (bedøvet). Det betyr at selv om det er elektrisk aktivitet (f.eks. sinusrytme på skjermen), kan pumpefunksjonen være for svak til å gi palpabel puls de første minuttene. Derfor fortsetter man HLR i 2 minutter etter sjokk før man sjekker puls, med mindre pasienten viser tydelige livstegn (våkner, beveger seg, hoster).
Takyarytmi med forestående hjertestans
Dette gjelder den ustabile pasienten som har puls, men tegn på alvorlig sirkulasjonssvikt (lavt BT, brystsmerter, hjertesvikt, redusert bevissthet) grunnet takykardi. Her er behandlingen umiddelbar synkronisert kardioversjon.
Kardioversjon er smertefullt. Hvis pasienten er våken og tid tillater det, gi sedasjon/analgesi:
- Midazolam: 1-2,5 mg i.v. titrert til effekt. Vær forsiktig med blodtrykksfall.
- Morfin/Fentanyl: For smertelindring.
- Ketamin: 0,5-1 mg/kg kan være et godt alternativ da det opprettholder blodtrykket bedre enn midazolam.
Startenergier:
- Atrieflimmer: 120-150 J (krever ofte høy energi).
- Atrieflutter/SVT: 70-100 J (konverterer ofte lett).
- Monomorf VT: 100-150 J.
Midlertidig pacing ved hjertestans
Transkutan pacing (TCP) er en midlertidig løsning ved symptomgivende bradykardi eller asystoli med p-bølger som ikke responderer på atropin/adrenalin. Ved asystoli er effekten dessverre svært begrenset, men det kan forsøkes tidlig.
Transkutan pacemaker
Evidens: Klasse IIa/I-anbefaling
- En pacemaker er den definitive behandlingen for høygradig blokk.
- Transkutan pacemaker bør etableres umiddelbart dersom pasienten er hemodynamisk ustabil og ikke responderer på medikamenter (atropin 0,5-1 mg, isoprenalin).
Slik utfører du transkutan pacing
- Forklar pasienten at det vil føles som rytmiske slag i brystet (hvis våken).
- Administrer sedasjon/analgesi rikelig, da pacing er smertefullt (muskelkontraksjoner).
- Plasser elektrodeputene i anterior-posterior retning for best effekt («sandwich»-prinsippet).
- Aktiver pacemakerfunksjonen på defibrillatoren.
- Still inn frekvens (Rate) til 60-70 slag/min.
- Øk strømmen (Current/Output) gradvis (start med 0-30 mA).
- Se etter pace-spikes på skjermen.
- Øk strømmen til du ser et bredt QRS-kompleks etter hver spike (elektrisk capture).
- Sjekk puls i femoralis (ikke carotis, da muskelrykninger kan forveksles med puls) for å bekrefte mekanisk capture.
- Når capture er oppnådd (f.eks. ved 70 mA), øk med ytterligere 10 % (f.eks. til 80 mA) for sikkerhetsmargin.
Legemidler ved hjertestans
Intravenøs tilgang
Perifer vene (PVK) i albuebøyen er førstevalg. Hvis dette mislykkes etter kort tid (f.eks. 60 sekunder), skal intraossøs (IO) tilgang etableres umiddelbart (f.eks. tibia eller humerus). IO er likeverdig med IV for medikamentadministrering under HLR.
Adrenalin (epinefrin) ved hjertestans
Doser og indikasjoner
- Ikke-sjokkbar rytme (PEA/Asystoli): Adrenalin 1 mg gis så snart som mulig. Dette er prioritert behandling.
- Sjokkbar rytme (VF/pVT): Adrenalin 1 mg administreres etter 3. sjokk (hvis rytmen vedvarer).
- Dosering gjentas hvert 3.-5. minutt (annenhver sløyfe).
Adrenalin virker primært via alfa-adrenerge reseptorer som gir vasokonstriksjon. Dette øker systemisk vaskulær motstand og dermed koronarperfusjonstrykket (CPP), som er avgjørende for å få hjertet i gang igjen. Ulempen er at det også kan redusere mikrosirkulasjonen i hjernen, noe som forklarer hvorfor adrenalin øker overlevelsen (flere hjerter starter), men ikke nødvendigvis fører til bedre nevrologisk utfall (PARAMEDIC2-studien).
Antiarytmika: amiodaron og lidokain
Brukes ved sjokkrefraktær VF/pVT for å øke sjansen for vellykket defibrillering.
- Amiodaron: Første dose 300 mg i.v./i.o. etter 3. sjokk. Andre dose 150 mg etter 5. sjokk.
- Lidokain: Kan brukes hvis amiodaron ikke er tilgjengelig (eller som foretrukket middel i noen systemer). Dose 100 mg (1-1,5 mg/kg) først, deretter 50 mg.
Andre medikamenter
- Magnesiumsulfat: 2 g i.v. ved Torsades de Pointes (polymorf VT med forlenget QT) eller ved mistanke om hypomagnesemi.
- Kalsium (Klorid/Glukonat): Ved hyperkalemi, hypokalsemi eller overdose av kalsiumblokkere. Ikke rutine.
- Natriumbikarbonat (Buffer): Ved hyperkalemi, trisyklisk antidepressiva-overdose eller alvorlig metabolsk acidose (kontroversielt rutinemessig).
- Trombolyse: Ved mistenkt lungeemboli som årsak til stans. Ved bruk av trombolyse bør HLR fortsette i 60-90 minutter for å gi medikamentet tid til å virke.
Reversible årsaker (H-er og T-er)
For å lykkes med gjenopplivning, spesielt ved PEA og asystoli, må man identifisere og behandle den underliggende årsaken. Huskeregelen er 4 H-er og 4 T-er:
- Hypoksi: Sikre frie luftveier, verifiser tubeplassering, gi 100 % O2.
- Hypovolemi: Væskebehandling, blodtransfusjon ved traume/blødning.
- Hypotermi: Oppvarming (varm væske, tepper), unngå å erklære død før pasienten er varm.
- Hyper-/hypokalemi (og metabolske forstyrrelser): Juster elektrolytter, gi kalsium/insulin-glukose ved høy kalium.
- Tromboemboli (koronar eller pulmonal): PCI ved hjerteinfarkt, trombolyse ved lungeemboli.
- Trykkpneumothorax (Tension pneumothorax): Nåle-dekompresjon eller thorakostomi.
- Tamponade (hjerte): Perikardiocentese eller akutt thoracotomi (traume).
- Toksiner (forgiftning): Spesifikke motgifter (f.eks. nalokson, digibind).
Ultralyd (POCUS) er et verdifullt verktøy for å diagnostisere H-er og T-er (spesielt tamponade, pneumothorax og lungeemboli), men undersøkelsen må ikke forsinke kompresjoner.
Tegn på ROSC og Post-resusciteringsomsorg
Return of Spontaneous Circulation (ROSC) kjennetegnes ved:
- Plutselig stigning i ETCO2 (ofte > 40 mmHg).
- Palpabel puls og målbart blodtrykk.
- Spontane bevegelser eller oppvåkning.
Når ROSC inntreffer, starter den kritiske fasen med post-resusciteringsbehandling for å minimere hjerneskade og behandle årsaken:
- Luftvei/Pust: Unngå hypoksi, men unngå også hyperoksi (mål SpO2 94-98 %). Unngå hyperventilasjon (mål normal PaCO2).
- Sirkulasjon: Stabiliser hemodynamikken. Mål systolisk BT > 100 mmHg eller MAP > 65 mmHg. Vurder noradrenalin. Ta 12-avlednings EKG umiddelbart for å se etter STEMI (indikasjon for akutt PCI).
- Temperaturkontroll: Forhindre feber (>37,7°C) i minst 72 timer. Aktiv kjøling til 33-36°C er ikke lenger rutine for alle (TTM2-studien), men streng normotermi er viktig.
Spesielle hensyn: Graviditet
Ved hjertestans hos gravide (> 20 uker) er det viktig å flytte livmoren til venstre (manuelt venstreforskyvning av uterus) for å oppheve trykket på vena cava inferior og aorta. Hvis ROSC ikke oppnås innen 4 minutter, skal man utføre akutt keisersnitt (perimortem sectio) for å redde barnet og forbedre mors sjanse for overlevelse ved å tømme uterus.
Referanser
Tung L, Sliz N, Mulligan MR. Influence of electrical axis of stimulation on excitation of cardiac muscle cells.Circ Res. 1991; 69:722-730. doi: 10.1161/01.res.69.3.722
Steen S, Liao Q, Pierre L, Paskevicius A, Sjoberg T. Den kritiske betydningen av minimal forsinkelse mellom brystkompresjoner og påfølgende defibrillering: en hemodynamisk forklaring. Resuscitation. 2003; 58: 249-258.
Tang W, Snyder D, Wang J, Huang L, Chang YT, Sun S, Weil MH. Defibrilleringsprotokoll med ett støt versus tre støt forbedrer utfallet betydelig i en svinemodell av langvarig ventrikkelflimmer-hjertestans. Circulation. 2006; 113: 2683-2689.
Redberg. Sham Controls in Medical Device Trials Liste over forfattere. N Engl J Med 2014; 371:892-893 DOI: 10.1056/NEJMp1406388
Talikowska M, Tohira H, Finn J. Kvaliteten på hjerte-lungeredning og pasientens overlevelsesutfall ved hjertestans: En systematisk gjennomgang og metaanalyse. Resuscitation. 2015;96:66-77. doi: 10.1016/j. resuscitation.2015.07.036
Christenson J, Andrusiek D, Everson-Stewart S, Kudenchuk P, Hostler D, Powell J, Callaway CW, Bishop D, Vaillancourt C, Davis D, Aufderheide TP, Idris A, Stouffer JA, Stiell I, Berg R; Resuscitation Outcomes Consortium Investigators. Brystkompresjonsfraksjon avgjør overlevelse hos pasienter med ventrikkelflimmer utenfor sykehus. Circulation. 2009;120:12411247. doi: 10.1161/CIRCULATIONAHA.109.852202
Vaillancourt C, Everson-Stewart S, Christenson J, Andrusiek D, Powell J, Nichol G, Cheskes S, Aufderheide TP, Berg R, Stiell IG; Resuscitation Outcomes Consortium Investigators. Virkningen av økt brystkompresjonsfraksjon på tilbakeføring av spontan sirkulasjon for pasienter med hjertestans utenfor sykehus som ikke har ventrikkelflimmer. Resuscitation. 2011;82:1501-1507. doi: 10.1016/j.resuscitation.2011.07.011
Sugerman NT, Edelson DP, Leary M, Weidman EK, Herzberg DL, Vanden Hoek TL, Becker LB, Abella BS. Redningsmannens tretthet under faktisk hjerte-lungeredning på sykehus med audiovisuell tilbakemelding: en prospektiv multisenterstudie. Resuscitation. 2009;80:981-984. doi: 10.1016/j.resuscitation.2009.06.002
Mekaniske brystkompresjoner og samtidig defibrillering vs. konvensjonell hjerte-lungeredning ved hjertestans utenfor sykehus The LINC Randomized Trial Sten Rubertsson, MD, PhD1; Erik Lindgren, MD1; David Smekal, MD, PhD1; et alOllie Östlund, PhD2; Johan Silfverstolpe, MD3; Robert A. Lichtveld, MD, PhD4; Rene Boomars, MPA4; Björn Ahlstedt, MD5; Gunnar Skoog, MD6; Robert Kastberg, MD6; David Halliwell, RN7; Martyn Box, RN7; Johan Herlitz, MD, PhD8; Rolf Karlsten, MD, PhD1 Author Affiliations Article Information JAMA. 2014;311 (1):53-61. doi:10.1001/jama.2013.282538
Bruk av ryggbrett ved hjerte-lungeredning: en systematisk oversikt og metaanalyse Matteo Paganini 1, Giulia Mormando 2, Fabio Carfagna 3, Pier Luigi Ingrassia 3 Affiliations expand PMID: 33417354 DOI: 10.1097/MEJ.0000000000000784
Guildner CW. Gjenopplivning – åpning av luftveiene: en sammenlignende studie av teknikker for å åpne en luftvei som er blokkert av tungen. JACEP. 1976;5:588-590. doi: 10.1016/s0361-1124 (76)80217-1
Lin S, Callaway CW, Shah PS, et al. Adrenalin for gjenoppliving av hjertestans utenfor sykehus: en systematisk gjennomgang og metaanalyse av randomiserte kontrollerte studier. Resuscitation 2014;85:732-740.
Retningslinjer 2000 for hjerte-lungeredning og akutt hjerte- og karsykepleie. 6. Avansert kardiovaskulær livshjelp: seksjon 6: farmakologi II: midler for å optimalisere hjertets minuttvolum og blodtrykk. Circulation 2000;102:Suppl:I-129–I-135.
Link MS, Atkins DL, Passman RS, et al. Electrical therapies: automated external defibrillators, defibrillation, cardioversion, and pacing: 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2010;122:Suppl 3:S706-S719.
Kudenchuk PJ, Brown SP, Daya M, et al. Amiodarone, lidocaine, or placebo in out-of-hospital cardiac arrest. N Engl J Med 2016;374:1711-1722.
Morrison LJ, Dorian P, Long J, et al. Out-of-hospital cardiac arrest rectilinear biphasic to monophasic damped sinus defibrillation waveforms with advanced life support intervention trial (ORBIT). Resuscitation 2005;66:149-157.
Spies DM, Kiekenap J, Rupp D, Betz S, Kill C, Sassen MC. På tide å endre tidene? Tidspunkt for tilbakefall av ventrikkelflimmer under OHCA. Resuscitation 2020;157:219-224.
Holmén J, Hollenberg J, Claesson A, et al. Overlevelse ved ventrikkelflimmer med vekt på antall defibrilleringer i forhold til andre faktorer ved gjenopplivning. Resuscitation 2017;113:33-38.
Aufderheide TP, Sigurdsson G, Pirrallo RG, Yannopoulos D, McKnite S, von Briesen C, Sparks CW, Conrad CJ, Provo TA, Lurie KG. Hyperventilasjonsindusert hypotensjon under hjerte-lungeredning. Circulation. 2004;109:1960-1965. doi: 10.1161/01.CIR.0000126594.79136.61
Hypotermi versus normotermi etter hjertestans utenfor sykehus Liste over forfattere. Josef Dankiewicz, M.D., Ph.D., Tobias Cronberg, M.D., Ph.D., Gisela Lilja, O.T., Ph.D., Janus C. Jakobsen, M.D., Ph.D., Helena Levin, M.Sc., Susann Ullén, Ph.D., Christian Rylander, M.D., Matt P. Wise, M.B., B.Ch., D.Phil., Mauro Oddo, M.D., Alain Cariou, M.D., Ph.D., Jan Bělohlávek, M.D., Ph.D., Jan Hovdenes, M.D., Ph.D., et al. for TTM2 Trial Investigators. N Engl J Med 2021; 384:2283-2294 DOI: 10.1056/NEJMoa2100591
Jabre P, Penaloza A, Pinero D, Duchateau FX, Borron SW, Javaudin F, Richard O, de Longueville D, Bouilleau G, Devaud ML, Heidet M, Lejeune C, Fauroux S, Greingor JL, Manara A, Hubert JC, Guihard B, Vermylen O, Lievens P, Auffret Y, Maisondieu C, Huet S, Claessens B, Lapostolle F, Javaud N, Reuter PG, Baker E, Vicaut E, Adnet F. Effekten av bag-maske-ventilasjon vs. endotrakeal intubasjon under hjerte-lunge-redning på nevrologisk utfall etter hjertestans utenfor sykehus: En randomisert klinisk studie. JAMA. 2018;319:779-787. doi: 10.1001/jama.2018.0156
Kleinman ME, Goldberger ZD, Rea T, Swor RA, Bobrow BJ, Brennan EE, Terry M, Hemphill R, Gazmuri RJ, Hazinski MF, Travers AH. 2017 American Heart Association Focused Update on Adult Basic Life Support and Cardiopulmonary Resuscitation Quality: En oppdatering av American Heart Associations retningslinjer for hjerte-lungeredning og akutt kardiovaskulær behandling. Circulation. 2018;137:e7-e13. doi: 10.1161/CIR.0000000000000539
Tidlig ekstrakorporeal HLR ved refraktær hjertestans utenfor sykehus Liste over forfattere. Martje M. Suverein, M.D., Thijs S.R. Delnoij, M.D., Roberto Lorusso, M.D., Ph.D., George J. Brandon Bravo Bruinsma, M.D., Ph.D, Luuk Otterspoor, M.D., Ph.D., Carlos V. Elzo Kraemer, M.D., Alexander P.J. Vlaar, M.D., Ph.D., Joris J. van der Heijden, M.D., Erik Scholten, M.D., Corstiaan den Uil, M.D., Ph.D., Tim Jansen, M.D., Ph.D., Bas van den Bogaard, M.D., Ph.D., Marijn Kuijpers, M.D., Ka Yan Lam, M.D., José M. Montero Cabezas, M.D., Antoine H.G. Driessen, M.D., Ph.D., Saskia Z.H. Rittersma, M.D., Ph.D., Bram G. Heijnen, M.D., Dinis Dos Reis Miranda, M.D., Ph.D., Gabe Bleeker, M.D., Ph.D., Jesse de Metz, M.D., Ph.D., Renicus S. Hermanides, M.D., Ph.D., Jorge Lopez Matta, M.D., Susanne Eberl, M.D., Dirk W. Donker, M.D., Ph.D., Robert J. van Thiel, M.D., Sakir Akin, M.D., Ph.D., Oene van Meer, M.D., José Henriques, M.D., Ph.D, Karen C. Bokhoven, M.D., Loes Mandigers, M.D., Jeroen J.H. Bunge, M.D., Martine E. Bol, M.Sc., Bjorn Winkens, Ph.D., Brigitte Essers, Ph.D., Patrick W. Weerwind, Ph.D., Jos G. Maessen, M.D., Ph.D., og Marcel C.G. van de Poll, M.D., Ph.D. 26. januar 2023 N Engl J Med 2023; 388:299-309. N Engl J Med 2023; 388:299-309 DOI: 10.1056/NEJMoa2204511