Evaluering og behandling av stabil koronarsykdom
Kroniske koronarsyndromer (CCS)
Stabil koronarsykdom, ofte omtalt som stabil angina pectoris, har tradisjonelt blitt definert og behandlet som en egen, statisk klinisk enhet. Kjennetegnet på stabil koronarsykdom er anstrengelsesrelatert angina pectoris (brystsmerter); symptomer på iskemi oppstår under omstendigheter med økt belastning på myokardiet, vanligvis under trening eller emosjonelt stress, og forsvinner i hvile.
Nyere retningslinjer fra European Society for Cardiology (ESC) markerte et paradigmeskifte ved å introdusere klassifiseringen kroniske koronarsyndromer (CCS) (Knuuti et al., 2019/2020). Denne terminologien understreker at koronarsykdom er en dynamisk prosess preget av aterosklerotisk plakkprogresjon, stabilisering og potensiell ruptur. CCS omfatter seks kliniske manifestasjoner av koronarsykdom (omtalt nedenfor), som dekker hele spekteret fra asymptomatisk sykdom til stabil angina og post-akutte faser. I tillegg har prognostisering, valg av diagnostiske tester og behandlingsstrategier blitt betydelig oppdatert. For eksempel anbefales ikke lenger anstrengelsestesting (arbeids-EKG) som rutinemessig førstelinjeundersøkelse for å bekrefte eller avkrefte koronarsykdom på grunn av lav diagnostisk treffsikkerhet, men snarere for å vurdere funksjonsnivå og arytmirisiko.
De nye retningslinjene er basert på omfattende data fra studier utført i Nord-Amerika og Europa. Retningslinjekomiteen inkluderte representanter fra både ESC og nordamerikanske fagmiljøer, noe som sikrer harmonisering med retningslinjer fra American Heart Association (AHA) og American College of Cardiology (ACC). I dette kapittelet presenteres den nyeste dokumentasjonen og de gjeldende anbefalingene for evaluering og behandling av kronisk koronarsyndrom (CCS) tilpasset norsk klinisk praksis.
Begrepsavklaring: Iskemisk hjertesykdom, koronar hjertesykdom og koronararteriesykdom brukes ofte om hverandre. I klinisk praksis refererer disse begrepene til patofysiologiske tilstander forårsaket av koronar aterosklerose som begrenser blodstrømmen til myokard.
Tradisjonell klassifisering av koronararteriesykdom
Tradisjonelt har koronarsykdom blitt inndelt i følgende syndromer, basert på symptomstabilitet og akutt risiko:
- Stabil angina pectoris: Symptomene oppstår først og fremst under trening eller andre situasjoner med økt myokardialt oksygenbehov (f.eks. kulde, stress, postprandialt). Symptomene er reproduserbare ved et gitt belastningsnivå og lindres ved hvile eller nitroglyserin. Tilstanden reflekterer en stabil stenose som begrenser flowreserven, men uten akutt trombedannelse.
- NSTE-ACS (akutt koronarsyndrom uten ST-elevasjon): NSTE-ACS er en akutt tilstand utløst av plakkruptur eller erosjon, som fører til aterotrombose og delvis okklusjon eller distal embolisering i koronararterien. NSTE-ACS omfatter:
- Myokardinfarkt uten ST-elevasjon (NSTEMI): Diagnostiseres ved tilstedeværelse av myokardskade, verifisert ved stigning og/eller fall i høysensitive troponiner (hs-cTn) med minst én verdi over 99-persentilen.
- Ustabil angina pectoris (UA): Karakteriseres av iskemiske symptomer i hvile eller crescendo-angina, men uten biokjemiske tegn til myokardnekrose (normale troponiner). Med innføringen av høysensitive troponiner har prevalensen av UA sunket betraktelig, da flere pasienter nå klassifiseres som små NSTEMI.
- STE-ACS (akutt koronarsyndrom med ST-elevasjon): STE-ACS oppstår ved en brå og fullstendig trombotisk okklusjon av en epikardial koronararterie. Iskemi er transmural, noe som resulterer i vedvarende ST-elevasjoner på EKG (eller ekvivalenter som venstre grenblokk). Dette krever umiddelbar revaskularisering (primær PCI eller trombolyse) for å begrense infarktstørrelsen. Diagnosen er ST-elevasjonsinfarkt (STEMI).
Kroniske koronarsyndromer (CCS) – En utvidet forståelse
Koronarsykdom er en progressiv, men dynamisk sykdom. Selv om aterosklerose utvikles over tiår, kan den kliniske tilstanden endres raskt. De fleste mennesker i høyinntektsland har en viss grad av koronar aterosklerose. Modifiserbare risikofaktorer (f.eks. røyking, hypertensjon, diabetes, dyslipidemi [særlig høyt LDL-kolesterol], inaktivitet) og ikke-modifiserbare faktorer (alder, kjønn, genetikk) driver plakkvekst og inflammasjon.
Den første kliniske manifestasjonen av koronarsykdom er ofte stabil angina, men en betydelig andel pasienter debuterer med et akutt koronarsyndrom uten forvarsel. Etter en akutt hendelse går pasienten over i en kronisk fase som krever livslang sekundærforebygging. For å fange opp denne kompleksiteten, definerer ESC seks kliniske scenarioer som faller inn under CCS:
- Mistenkt CAD: Pasienter med stabile symptomer på angina pectoris og/eller dyspné.
- Nyoppstått hjertesvikt: Pasienter med mistenkt koronar hjertesykdom og nyoppstått hjertesvikt eller venstre ventrikkel-dysfunksjon (LV-dysfunksjon), hvor iskemisk etiologi må utelukkes.
- Stabilisert etter ACS < 1 år: Pasienter med stabiliserte symptomer <12 måneder etter akutt koronarsyndrom eller revaskularisering. Denne gruppen har fortsatt forhøyet risiko for nye hendelser.
- Stabilisert etter ACS > 1 år: Pasienter med stabiliserte symptomer >12 måneder etter diagnose eller revaskularisering.
- Angina uten obstruktiv sykdom: Pasienter med angina pectoris og mistanke om vasospastisk eller mikrovaskulær sykdom (INOCA/MINOCA).
- Asymptomatisk screening: Asymptomatiske pasienter der koronar hjertesykdom påvises tilfeldig eller under screening (f.eks. preoperativ vurdering).
Det naturlige forløpet ved koronarsykdom
Aterosklerose er en kronisk inflammatorisk sykdom i arterieveggen. LDL-kolesterol er den kausale driveren; akkumulering av LDL-partikler i intima starter en immunrespons som involverer makrofager, T-celler og dannelse av skumceller. Dette danner kjernen i det aterosklerotiske plakket.
Glagov-effekten: I tidlige stadier vokser plakket utover i karveggen (positiv remodellering), noe som bevarer lumen og sikrer normal blodstrøm. Først når plakkbyrden overstiger ca. 40 % av karets areal, begynner lumen å innsnevres, og flow kan bli kompromittert.
Aterosklerotiske plakk kan være stabile (tykk fibrøs kappe, lite lipidkjerne) eller sårbare (tynn fibrøs kappe, stor nekrotisk lipidkjerne, høy inflammasjon). Det er ofte de sårbare plakkene som rupterer og forårsaker akutte koronarsyndromer, selv om de ikke nødvendigvis var hemodynamisk signifikante (obstruktive) i forkant. Dette understreker viktigheten av systemisk medisinsk behandling fremfor kun fokal behandling av stenoser.
Målet med moderne behandling er todelt:
1. Symptomlindring: Ved å redusere iskemi (medisiner eller revaskularisering).
2. Prognoseforbedring: Ved å stabilisere plakk, dempe inflammasjon og forhindre trombose (statiner, platehemmere, livsstil).
Intensiv lipidsenkende behandling kan ikke bare bremse progresjonen, men også endre plakkets sammensetning (gjøre det mer stabilt) og i noen tilfeller redusere plakkvolumet (regresjon), som vist i studier med IVUS (intravaskulær ultralyd) (Fisher et al., GLAGOV-studien).
Definisjon av stabil og ustabil angina
Stabil koronarsykdom (angina pectoris)
Klassisk angina pectoris oppleves som et retrosternalt ubehag, ofte beskrevet som trykk, klem, tyngde eller sammensnøring. Utstråling til venstre arm, begge armer, kjeve, nakke eller rygg er vanlig. Ved iskemi i inferior vegg kan smertene mistolkes som dyspepsi eller epigastriske smerter.
Sentrale kjennetegn ved stabil angina:
- Varighet: Vanligvis 2–5 minutter. Sjelden over 10 minutter (da mistenkes ACS).
- Utløsende faktorer: Fysisk anstrengelse, emosjonelt stress, kulde, store måltider.
- Lindring: Hvile eller nitroglyserin (effekt innen 1–2 minutter).
Dyspné (pustenød) er en viktig anginaekvivalent. Dersom dyspné oppstår ved belastning og letter ved hvile på samme måte som brystsmerter, bør det utredes som mulig iskemi, spesielt hos kvinner, eldre og diabetikere.
Walk-through angina og Warm-up angina er fenomener hvor iskemiens terskel forskyves. Ved warm-up angina kan pasienten tåle mer belastning etter en første, roligere anstrengelse, trolig grunnet iskemisk prekondisjonering og rekruttering av kollateraler.
EKG ved stabil koronarsykdom
Et normalt hvile-EKG utelukker ikke alvorlig koronarsykdom; faktisk har over 50 % av pasienter med stabil angina et normalt hvile-EKG. Under pågående smerter kan man derimot ofte se ST-depresjoner (subendokardial iskemi). Vedvarende EKG-forandringer som patologiske Q-bølger, venstre grenblokk (LBBB) eller tegn på venstre ventrikkelhypertrofi øker sannsynligheten for underliggende hjertesykdom.
Anbefalt kapittel: EKG ved myokardiskemi.
Troponinnivåer ved stabil koronarsykdom
Ved stabil angina skal troponiner per definisjon ikke ha dynamikk som ved infarkt. Imidlertid kan høysensitive troponiner (hs-cTn) være kronisk lett forhøyet hos pasienter med stabil CAD, strukturell hjertesykdom, nyresvikt eller hos eldre. Denne kroniske forhøyelsen reflekterer ikke nødvendigvis akutt plakkruptur, men er en markør for dårligere langtidsprognose og krever nøye klinisk vurdering for å ikke feildiagnostiseres som NSTEMI.
Stabil angina pectoris klassifiseres i henhold til Diamond-Forrester-kriteriene (modifisert i ESC-retningslinjer) vist i tabell 1.
Tabell 1. Klassifisering av angina pectoris.
| Klassifisering | Definisjon |
|---|---|
| Typisk angina pectoris | Typisk angina pectoris oppfyller alle de tre følgende kriteriene: 1) Trykkubehag retrosternalt/anteriort på thorax, ev. med utstråling. 2) Utløses ved fysisk anstrengelse eller emosjonelt stress. 3) Lindres raskt ved hvile eller ved hjelp av nitropreparater (innen minutter). |
| Atypisk angina pectoris | Atypisk angina pectoris oppfyller to av de tre kriteriene ovenfor. (Merk: Hos kvinner og eldre er atypisk presentasjon vanligere). |
| Ikke-anginøse brystsmerter | Smerter som oppfyller ett eller ingen av kriteriene. Ofte stikkende, respirasjonsavhengige eller langvarige (timer). |
Definisjon av ustabil angina pectoris (UA)
Ustabil angina pectoris skiller seg fra stabil angina ved endring i mønsteret. Det anses som et forstadium til hjerteinfarkt og krever øyeblikkelig sykehusinnleggelse. UA foreligger hvis:
- Angina oppstår i hvile og er langvarig (>20 min).
- Nyoppstått angina (siste 2 måneder) som er alvorlig (CCS klasse II-III).
- Crescendoangina: Tidligere stabil angina som har blitt hyppigere, varer lenger, eller utløses ved lavere terskel (økning i CCS-klasse).
Tabell 2. Klassifisering av angina pectoris (Canadian Cardiovascular Society – CCS)
| Klasse | Alvorlighetsgrad |
|---|---|
| Klasse I | Ingen angina ved vanlig fysisk aktivitet. Angina kun ved kraftig, rask eller langvarig anstrengelse. |
| Klasse II | Lett begrensning av daglig aktivitet. Angina ved rask gange, i motbakke, etter måltid, i kulde eller ved emosjonelt stress. |
| Klasse III | Moderat/betydelig begrensning av daglig aktivitet. Angina ved gange 1–2 kvartaler på flatmark eller ved å gå opp én trapp i normalt tempo. |
| Klasse IV | Manglende evne til å utføre noen fysisk aktivitet uten ubehag. Anginasymptomer kan være til stede i hvile. |
Evaluering av mistenkt kronisk koronarsykdom
Prinsipper for diagnostikk: Bayes’ teorem
Diagnostikk ved brystsmerter handler om sannsynlighetsberegning. Før vi velger en test, må vi estimere sannsynligheten for at pasienten har obstruktiv koronarsykdom (Pre-test sannsynlighet, PTP).
Testens verdi avhenger av PTP:
- Lav PTP: En positiv test er ofte falsk positiv.
- Svært høy PTP: En negativ test er ofte falsk negativ.
- Intermediær PTP: Her har diagnostiske tester størst verdi for å endre diagnosen.
Tradisjonelt arbeids-EKG har begrenset sensitivitet (ca. 50 %) og spesifisitet, og anbefales ikke lenger for å diagnostisere obstruktiv CAD, men kan brukes for å vurdere symptomer, arytmi, blodtrykksrespons og prognose.
Tabell 3 viser ytelsen til moderne diagnostiske modaliteter. Legg merke til den høye sensitiviteten (evnen til å utelukke sykdom) ved CT-angiografi, og den høye spesifisiteten (evnen til å bekrefte iskemisk signifikans) ved funksjonstester som stress-ekko og PET/SPECT.
Tabell 3: Testsensitivitet og -spesifisitet for koronararteriesykdom
| Modalitet | Sensitivitet (%) | Spesifisitet (%) |
|---|---|---|
| Anstrengelsestesting (arbeids-EKG) | 45-50% | 85-90% |
| Stress-ekkokardiografi | 80-85% | 80-88% |
| Stress-SPECT (scintigrafi) | 73-92% | 63-87% |
| Stress-MR (perfusjon) | 87-90% | 80-90% |
| CT-angiografi (CTA) koronararterier | 95-99% | 64-83% |
| Stress-PET (gullstandard funksjonell) | 90-95% | 85-90% |
Utredning av mistenkt koronarsykdom: Steg-for-steg
Figur 1 oppsummerer utredningsalgoritmen. Prosessen er designet for å identifisere pasienter som trenger revaskularisering og de som kan behandles medisinsk, samtidig som unødvendig invasiv utredning minimeres.

Trinn 1. Anamnese og klinisk undersøkelse
Det første trinnet er å vurdere om pasienten har ustabil angina eller annet akutt koronarsyndrom som krever øyeblikkelig innleggelse. Hvis tilstanden er stabil, kartlegges symptomer (typisk/atypisk angina) og risikoprofil.
Klinisk undersøkelse fokuserer på tegn til komorbiditet: bilyder (aortastenose, mitralklaffsvikt), tegn på hjertesvikt, perifer karsykdom (manglende pulser), xanthelasmer (dyslipidemi) og blodtrykksmåling. Kartlegging av kardiovaskulære risikofaktorer (røyking, hypertensjon, dyslipidemi, diabetes, tidlig familiehistorie) er avgjørende for PTP.
Trinn 2. Vurder komorbiditet og livskvalitet
Hvis revaskularisering (PCI/CABG) ikke er et alternativ på grunn av alvorlig komorbiditet eller kort forventet levetid, bør man avstå fra omfattende diagnostikk og heller fokusere på optimal medisinsk behandling (OMT) og symptomlindring.
Trinn 3. Basale undersøkelser
Hvile-EKG
Alle pasienter skal ta et 12-avledningers EKG. Se etter patologiske Q-bølger (gjennomgått infarkt), tegn til LV-hypertrofi, ledningsforstyrrelser (LBBB/RBBB) og repolariseringsforstyrrelser (ST-T-endringer).
Blodprøver
Standardpakke inkluderer:
- Lipidprofil: Totalkolesterol, LDL (kalkulert eller direkte), HDL, Triglyserider. Lipoprotein(a) bør måles én gang i livet hos alle med høy risiko.
- Glukosemetabolisme: HbA1c og fastende glukose for å avdekke diabetes eller pre-diabetes.
- Nyrefunksjon: Kreatinin og eGFR (viktig for valg av kontrastundersøkelser og medikamentdosering).
- Hemoglobin og thyroideafunksjon: For å utelukke anemi eller thyreotoksikose som årsak til iskemi/angina.
- Hs-Troponin: Ved klinisk usikkerhet eller forverrede symptomer for å utelukke myokardskade.
Ekkokardiografi i hvile
Ultralyd av hjertet er indisert hos alle for å:
- Utelukke andre årsaker til brystsmerter (aortastenose, hypertrofisk kardiomyopati).
- Vurdere venstre ventrikkels funksjon (LVEF). Nedsatt LVEF eller regionale veggbevegelsesforstyrrelser styrker mistanken om koronarsykdom.
Trinn 4. Beregn klinisk sannsynlighet for koronarsykdom (PTP)
I 2019-retningslinjene ble tabellen for PTP (Pre-Test Probability) oppdatert med data fra moderne kohorter. Disse viser at den faktiske forekomsten av obstruktiv CAD er lavere enn tidligere antatt.
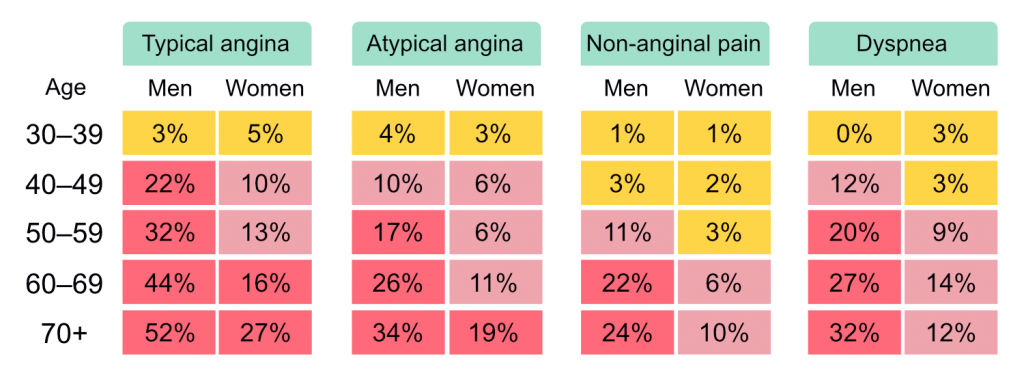
Klinisk sannsynlighet: PTP basert på alder/kjønn/symptomer alene er ofte ikke nok. Den kliniske sannsynligheten justeres opp eller ned basert på modifiserende faktorer:
- Øker sannsynligheten: Risikofaktorer (diabetes, hypertensjon, røyking), EKG-endringer (Q-bølger, ST-T endringer), redusert LVEF, eller patologisk kalsiumscore (Agatston score > 0 på CT).
- Reduserer sannsynligheten: Normalt arbeids-EKG (hvis utført), ingen koronarkalk på CT.
Trinn 5. Valg av diagnostisk test
Valget mellom anatomisk (CT) og funksjonell testing styres av den kliniske sannsynligheten (PTP) og pasientens karakteristika.
- CT-Angiografi (CT-koronar): Anbefales som førstevalg ved lav til intermediær sannsynlighet for koronarsykdom. Metoden har svært høy negativ prediktiv verdi (NPV) – en normal CT utelukker koronarsykdom med stor sikkerhet. CT er også utmerket for å påvise subklinisk aterosklerose (plakk som ikke er trange nok til å gi iskemi, men som krever preventiv behandling).
Begrensninger: Høy og uregelmessig hjertefrekvens, betydelig koronarkalk (blooming artifacts), nyresvikt, KMI > 35-40. - Funksjonell testing med bildebehandling (Stress-ekko, Stress-MR, PET, SPECT): Anbefales ved høy klinisk sannsynlighet, eller hos pasienter med kjent koronarsykdom (tidligere PCI/CABG) hvor man lurer på om nye symptomer skyldes iskemi. Disse testene svarer på spørsmålet: «Er denne stenosen hemodynamisk betydningsfull?»
- Invasiv koronar angiografi (ICA): Reserveres for pasienter med svært høy sannsynlighet for sykdom, alvorlige symptomer som er refraktære mot medisiner, typisk angina ved lav belastning, eller tegn til alvorlig dysfunksjon (f.eks. ved ekko). Ved ICA bør man ha lav terskel for å bruke trykkmåling (FFR/iFR) for å vurdere stenoser som ikke er åpenbart kritiske (>90%).
Mikrovaskulær angina (INOCA)
En betydelig andel pasienter (spesielt kvinner) har typiske brystsmerter og positiv funksjonstest, men «normale» eller ikke-obstruerte koronararterier ved angiografi/CT. Dette tilstanden kalles INOCA (Ischemia with Non-Obstructive Coronary Arteries). Årsaken er ofte dysfunksjon i mikrosirkulasjonen eller koronare spasmer. Disse pasientene har redusert livskvalitet og økt risiko for hendelser. Spesialisert utredning med måling av koronar flowreserve (CFR) og mikrovaskulær motstand (IMR) under invasiv angiografi kan bekrefte diagnosen og styre behandlingen.
Trinn 6. Risikostratifisering og behandling
Når diagnosen er stilt, klassifiseres pasienten som høyrisiko (årlig mortalitet >3 %) eller lavrisiko. Høyrisikopasienter (f.eks. hovedstammestenose, trekarsykdom med nedsatt EF, eller store iskemiske områder >10 % av myokard) har ofte overlevelsesgevinst av revaskularisering.
Behandling av kronisk koronarsyndrom
Behandlingen hviler på to pilarer:
1. Forebygging av hendelser (prognose): Livsstil, platehemming, lipidsenkning, og evt. ACE-hemmere.
2. Symptomlindring (livskvalitet): Antianginøse medisiner og revaskularisering.
Livsstilsintervensjon
Røykeslutt, sunt kosthold (middelhavsdiett), vektreduksjon og fysisk aktivitet er fundamentet. Alle pasienter bør henvises til hjerterehabilitering for strukturert oppfølging.
Medikamentell behandling
1. Lipidsenkende behandling
Nye, strenge mål: For pasienter med etablert koronarsykdom (veldig høy risiko) anbefaler ESC 2019/2021-retningslinjene et LDL-mål på < 1,4 mmol/L og minst 50 % reduksjon fra utgangspunktet. Ved gjentatte hendelser innen 2 år kan man vurdere < 1,0 mmol/L.
- Statiner: Høydose potent statin (Atorvastatin 40-80 mg eller Rosuvastatin 20-40 mg) er førstevalg.
- Ezetimib: Legges til hvis målet ikke nås med maksimal tolerert statindose.
- PCSK9-hemmere: Vurderes (på blå resept etter vilkår) hvis målet ikke nås med kombinasjonen statin + ezetimib.
2. Antitrombotisk behandling
- Acetylsalisylsyre (ASA): 75 mg x 1 anbefales livslangt til alle med koronarsykdom, med mindre det er kontraindisert.
- Klopidogrel: 75 mg x 1 er alternativet ved ASA-intoleranse.
- Dobbel platehemming (DAPT): Etter planlagt PCI (stenting) ved CCS gis normalt ASA + Klopidogrel i 6 måneder. Varigheten kan forkortes (1-3 mnd) ved høy blødningsrisiko eller forlenges ved høy iskemisk risiko.
- Kombinasjonsbehandling (COMPASS-regimet): Hos pasienter med særlig høy iskemisk risiko (f.eks. flerkarsykdom, diabetes, residiverende infarkter, perifer karsykdom) og lav blødningsrisiko, kan man vurdere å legge til lavdose Rivaroksaban (2,5 mg x 2) til ASA for å redusere risikoen for slag og hjerteinfarkt.
3. Antianginøs behandling
Målet er å redusere myokardets oksygenforbruk eller øke tilførselen.
- Betablokkere: Førstevalg for å redusere angina og iskemiepisoder. Særlig indisert ved tidligere hjerteinfarkt eller redusert LVEF. Mål: Hvilepuls 55–60/min.
- Kalsiumkanalblokkere (CCB):
- Dihydropyridiner (Amlodipin): Vasodilaterende. God i kombinasjon med betablokker.
- Ikke-dihydropyridiner (Verapamil/Diltiazem): Frekvensreduserende. Alternativ til betablokker (må ikke kombineres med betablokker pga. fare for AV-blokk/bradykardi).
- Langtidsvirkende nitrater: Andrelinjebehandling. Husk nitratfritt intervall for å unngå toleranseutvikling.
4. ACE-hemmere og Angiotensin II-blokkere
Disse medikamentene anbefales til pasienter med CCS som også har hypertensjon, diabetes, hjertesvikt (LVEF <40 %) eller kronisk nyresykdom. ACE-hemmere (f.eks. Ramipril, Enalapril) har vist seg å redusere risikoen for kardiovaskulær død og infarkt i disse gruppene (HOPE, EUROPA-studiene).
Revaskularisering ved stabil angina pectoris
Revaskularisering med PCI (stenting) eller CABG (bypassoperasjon) vurderes når symptomer vedvarer til tross for optimal medisinsk behandling, eller for å bedre prognosen ved utbredt iskemisk sykdom.
Beslutningstreet i Figur 5 viser at anatomisk kompleksitet (vurdert med SYNTAX-score) og pasientens operabilitet avgjør valget:
- CABG foretrekkes ved: Kompleks trekarsykdom, hovedstammestenose (spesielt ved høy SYNTAX-score), og hos pasienter med diabetes.
- PCI foretrekkes ved: En- eller tokarsykdom, lavere anatomisk kompleksitet, høy operasjonsrisiko eller pasientpreferanse.

Referanser
Knuuti et al: 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal (2020).
Visseren et al: 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. European Heart Journal (2021).
Marso SP et al. (Liraglutide/LEADER), Bonaca MP et al. (Ticagrelor/PEGASUS), Eikelboom JW et al. (Rivaroxaban/COMPASS).
ISCHEMIA-studien (2020): Viste at en invasiv strategi ikke reduserte iskemiske hendelser sammenlignet med optimal medisinsk behandling hos pasienter med stabil sykdom og moderat iskemi, men bedret angina-livskvalitet.