Lungeemboli (LE) oppstår når venøse blodpropper (tromber) løsner fra dannelsesstedet og emboliserer til lungearterien eller dens forgreninger. Tilstanden representerer en alvorlig og potensielt livstruende manifestasjon av venøs tromboembolisme (VTE). I de fleste tilfeller (ca. 90 %) stammer embolien fra en dyp venetrombose (DVT) i underekstremitetene eller bekkenet. Tromber kan løsne og følge blodstrømmen via vena cava inferior til høyre atrium og ventrikkel. Herfra pumpes tromben gjennom pulmonalklaffen og inn i truncus pulmonalis (lungearteriestammen). Avhengig av trombens størrelse, form og antall vil den kunne okkludere sentrale lungearterier eller mer perifere forgreninger. Jo større og mer sentral tromben er, desto mer uttalt blir den hemodynamiske påvirkningen.
Okklusjonen har to umiddelbare og kritiske effekter:
- Respiratorisk svikt: Redusert perfusjon i deler av lungesirkulasjonen skaper et område med ventilasjon, men ingen perfusjon (dødromsventilasjon), noe som resulterer i hypoksemi.
- Hemodynamisk svikt: Økt motstand i lungekretsløpet (økt etterbelastning for høyre ventrikkel) fører til redusert fylling av venstre ventrikkel. Dette gir redusert preload og dermed redusert hjerteminuttvolum.
En betydelig reduksjon i lungeperfusjonen og den påfølgende reduksjonen i venstre ventrikkels slagvolum fører til en kaskade av kompensatoriske mekanismer og patofysiologiske endringer som, uten behandling, kan kulminere i obstruktivt sjokk og hjertestans.
Lungeemboli er nært knyttet til dyp venetrombose (DVT), og disse bør betraktes som to manifestasjoner av samme sykdoms, VTE. Omtrent 70 % av personer med symptomatisk lungeemboli har påvisbar DVT, og en betydelig andel pasienter med proksimal DVT har asymptomatiske lungeembolier (Di Nisio et al.). Risikofaktorene er identiske og inkluderer elementene i Virchows triade: venøs stase, endotelskade og hyperkoagulabilitet (se Risikofaktorer nedenfor).
Klinisk presentasjon varierer fra asymptomatiske tilfeldige funn til massiv embolisering med plutselig død. En betydelig andel av høyrisikopasientene krever reperfusjonsbehandling (trombolyse eller embolektomi) for å gjenopprette sirkulasjonen. Administrering av trombolyse krever en nøye avveining av nytte mot blødningsrisiko, samt rask eksklusjon av differensialdiagnoser som aortadisseksjon og hjertetamponade, hvor trombolyse ville vært fatalt.
Venøs tromboembolisme er en kronisk tilstand med høy residivfare. Dødeligheten ved ubehandlet massiv lungeemboli er høy, men med korrekt diagnose og behandling er prognosen god for de fleste. Omtrent 30 % av pasientene opplever imidlertid en ny trombotisk hendelse i løpet av 10 år uten adekvat sekundærprofylakse (Goldhaber et al., Kearon et al.).
Epidemiologi ved lungeemboli
- Venøs tromboembolisme (VTE) er den tredje hyppigste kardiovaskulære dødsårsaken globalt, kun forbigått av hjerneslag og akutt hjerteinfarkt. Det anslås at det på verdensbasis oppstår 10 millioner tilfeller av VTE hvert år (Raskob et al.).
- Incidensen av lungeemboli har vist en stigende trend. Dette skyldes dels en aldrende befolkning med flere komorbiditeter (kreft, hjertesvikt, fedme), men også bedret diagnostikk med utstrakt bruk av CT lungearterier (CTPA) som oppdager mindre, segmentale embolier.
- COVID-19-pandemien har ytterligere aktualisert sykdommen, da infeksjonen gir en betydelig hyperkoagulabel tilstand (immunotrombose).
- Livstidsrisikoen for å utvikle VTE er estimert til ca. 8 % for personer i 45-årsalderen (Raskob et al, Heit et al).
Hjerte- og lungeeffekter av lungeemboli
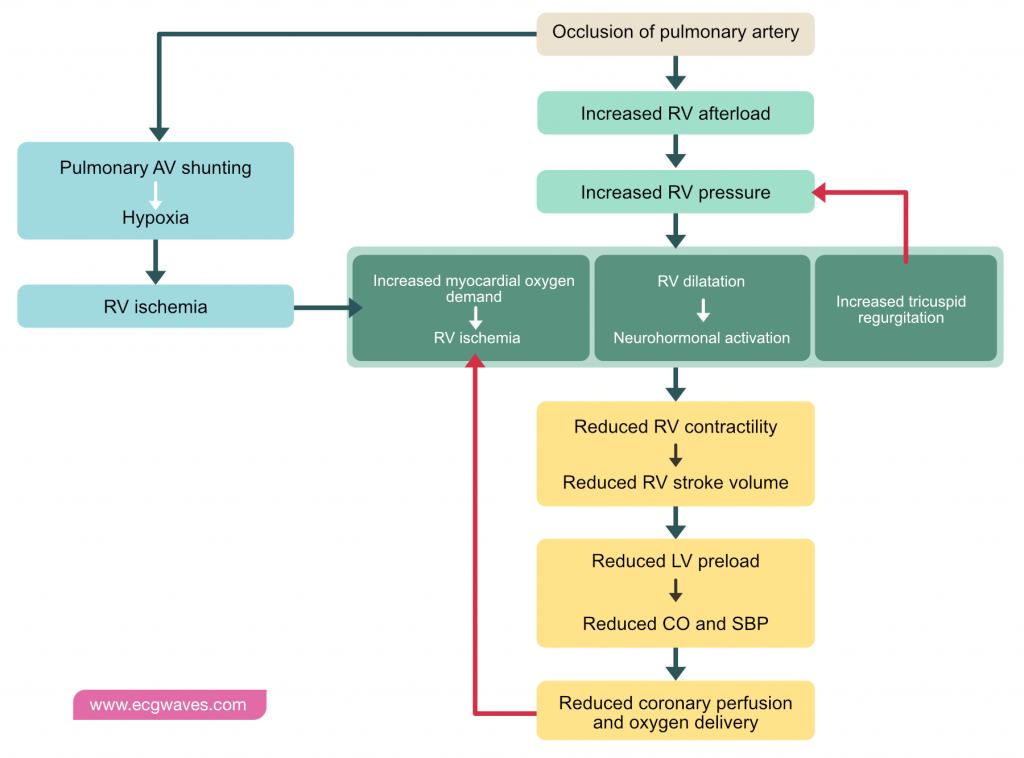
Hemodynamiske effekter: Svikt av høyre ventrikkel
Den primære dødsårsaken ved alvorlig lungeemboli er akutt høyresidig hjertesvikt. Embolisering fører til en brå økning i lungevaskulær motstand (PVR). Da høyre ventrikkel er en tynnvegget struktur tilpasset lavt trykk, har den begrenset evne til akutt å generere høyt trykk (i motsetning til venstre ventrikkel). Økt etterbelastning (afterload) fører til dilatadjon av høyre ventrikkel og økt veggspenning.
Dette utløser en ond sirkel («The Spiral of Death»):
- Dilatasjon: Høyre ventrikkel dilaterer for å opprettholde slagvolumet (Frank-Starling-mekanismen). Dette forskyver interventrikulær septum mot venstre, noe som reduserer fyllingen av venstre ventrikkel (ventrikulær interdependens).
- Iskemi: Økt veggspenning øker oksygenbehovet i høyre ventrikkel. Samtidig faller det systemiske blodtrykket, noe som reduserer perfusjonstrykket i høyre koronararterie (RCA). Perfusjon av høyre ventrikkel skjer normalt både i systole og diastole, men ved høyt trykk i høyre ventrikkel kompromitteres gjennomblødningen.
- Sjokk: Kombinasjonen av redusert koronarperfusjon og økt oksygenbehov gir myokardiskemi i høyre ventrikkel, redusert kontraktilitet, ytterligere fall i hjerteminuttvolum, og til slutt kardiogent sjokk og død.
Akutt lungeemboli medfører økt etterbelastning for høyre ventrikkel. Dette resulterer i dilatasjon, økt oksygenbehov, iskemi og potensielt infarkt i høyre ventrikkel, selv ved normale koronararterier.
Hjertestans ved lungeemboli presenterer seg oftest som pulsløs elektrisk aktivitet (PEA), da hjertet har elektrisk aktivitet, men ikke klarer å generere sirkulasjon mot den høye motstanden.
Pulmonale effekter
Obstruksjon av lungearteriene har flere respiratoriske konsekvenser:
- V/Q-mismatch: Områder av lungen ventileres, men perfunderes ikke. Dette øker det fysiologiske dødrommet.
- Hypoksemi: Skyldes en kombinasjon av V/Q-mismatch og redistribusjon av blod til åpne lungeavsnitt (hyperperfusjon) med redusert diffusjonskapasitet. Høyre-til-venstre shunting gjennom et åpent foramen ovale (PFO) kan forverre hypoksemien betydelig ved høyt trykk i høyre atrium.
- Hyperventilasjon: Stimulering av irritant-reseptorer i lungene gir reflektorisk tachypné og hyperventilasjon, som ofte resulterer i respiratorisk alkalose og hypokapni (lav pCO2).
- Lungeinfarkt: Ved okklusjon av distale arterier kan lungevevet nekrotisere, spesielt hvis kollateral sirkulasjon fra bronkialarteriene er utilstrekkelig. Dette gir pleurittiske smerter og hemoptyse.
Symptomer og tegn på lungeemboli
Symptombildet ved lungeemboli er kjent for å være uspesifikt og varierende («The Great Masquerader»). Det kliniske bildet spenner fra milde, forbigående plager til akutt sirkulasjonskollaps.
De vanligste symptomene inkluderer:
- Dyspné (tungpust): Det hyppigste symptomet, ofte akutt innsettende, enten i hvile eller ved anstrengelse.
- Brystsmerter: Kan være av to typer:
- Pleurittiske smerter: Skarpe smerter som forverres ved dyp inspirasjon (tyder på distal emboli med pleurairritasjon/lungeinfarkt).
- Anginøse smerter: Trykkende, sentrale smerter som ligner hjerteinfarkt (tyder på sentral emboli med iskemi i høyre ventrikkel).
- Synkope (besvimelse): Et alvorlig tegn som indikerer akutt reduksjon i hjerteminuttvolum og cerebral perfusjon. Kan være første og eneste symptom ved massiv LE.
- Hoste og hemoptyse: Blodig oppspytt forekommer oftere ved lungeinfarkt.
- Ensidig hevelse i benet: Tegn på DVT.
Kliniske funn:
- Takypné (respirasjonsfrekvens >20/min).
- Takykardi (puls >100/min).
- Hypoksi (redusert SpO2).
- Halsvenestuvning (tegn på høyresidig svikt).
- Auskultasjon: Ofte normalt, men kan vise aksentuert 2. hjertetone (P2) eller bilyd fra trikuspidalregurgitasjon.
- Feber: Subfebrilia er vanlig, men høy feber bør gi mistanke om pneumoni (differensialdiagnose).
Viktig: Hypotensjon (systolisk BT <90 mmHg) eller sjokk definerer pasienten som "hemodynamisk ustabil" (høyrisiko), noe som krever umiddelbar livreddende behandling.
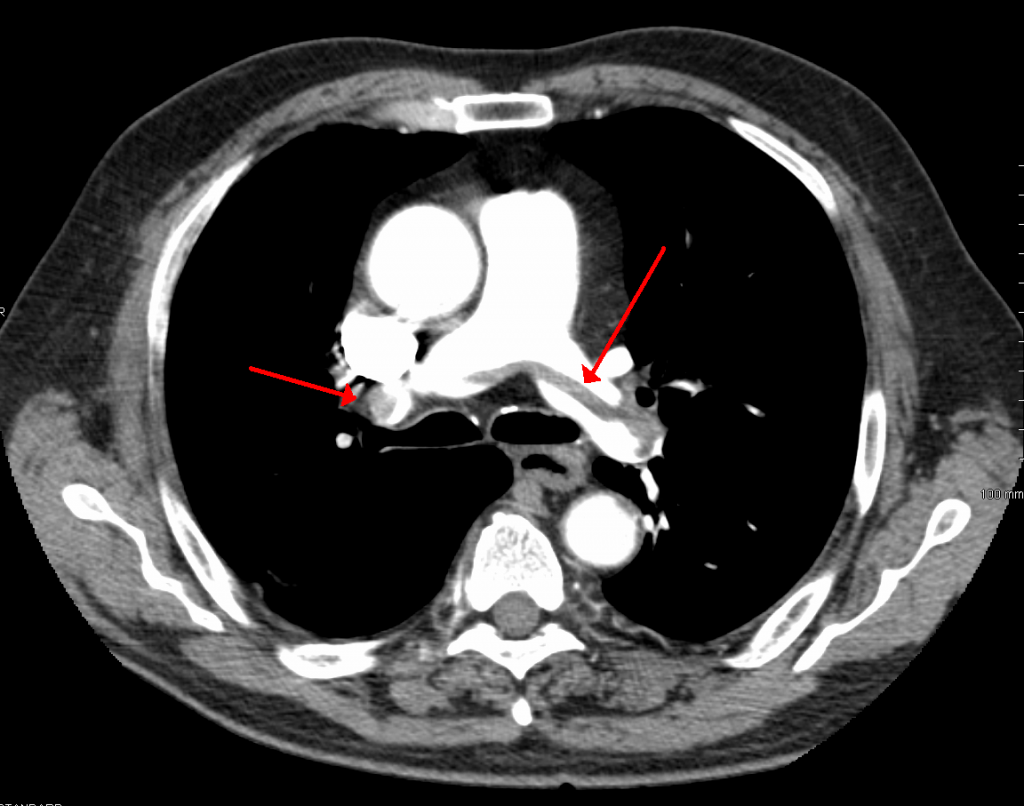
Sadelemboli
Sadelemboli refererer til en stor embolus som setter seg fast i bifurkasjonen av truncus pulmonalis, med forgreninger som strekker seg inn i både venstre og høyre hovedlungearterie. Navnet kommer av at emboliens kontur på CT-bilder minner om en hestesal (figur 2). Selv om begrepet høres dramatisk ut, trenger ikke sadelemboli nødvendigvis å gi hemodynamisk kollaps hvis den ikke er fullstendig okkluderende, men den representerer en stor trombemasse med høyt potensial for forverring.
Årsaker og etiologi
Selv om venøs trombe er den absolutte vanligste årsaken, finnes det non-trombotiske embolier man bør være klar over:
- Venøs tromboembolisme (DVT): Kilden til >90 % av LE.
- Fettemboli: Typisk etter brudd i lange rørknokler eller større ortopedisk kirurgi. Kan gi respirasjonssvikt, petekkier og cerebrale symptomer.
- Luftemboli: Kan oppstå ved prosedyrer (f.eks. sentrale venekatetre), dykking eller traumer.
- Fostervannsemboli: Sjelden, men katastrofal komplikasjon under fødsel.
- Septisk emboli: Fra høyresidig endokarditt (f.eks. hos intravenøse rusmisbrukere) eller infiserte katetre/pacemakere.
- Tumoremboli: Direkte vekst av tumor inn i vena cava/høyre atrium (f.eks. nyrecellekarsinom) eller metastaser.
- Sementemboli: Etter vertebroplastikk.
Risikofaktorer for lungeemboli
Risikofaktorer deles ofte inn i sterke, moderate og svake faktorer. Identifikasjon av disse er viktig for både diagnose og varighet av behandling.
Sterke risikofaktorer (Odds Ratio > 10)
- Brudd i underekstremitet
- Sykehusinnleggelse for hjertesvikt eller atrieflimmer/flutter (siste 3 mnd)
- Hofte- eller kneprotesekirurgi
- Større traumer
- Tidligere VTE
- Ryggmargsskade
Moderate risikofaktorer (Odds Ratio 2-9)
- Artroskopisk knekirurgi
- Autoimmune sykdommer
- Blodtransfusjon
- Sentrale venekatetre
- Kjemoterapi
- Hjertesvikt eller respirasjonssvikt
- Hormonerstatningsbehandling (HRT) og P-piller
- Infeksjoner (spesielt pneumoni, urinveisinfeksjon, HIV, Covid-19)
- Kreftsykdom (spesielt metastatisk)
- Trombofili (Faktor V Leiden, etc.)
- Post-partum perioden
Svake risikofaktorer (Odds Ratio < 2)
- Sengeleie > 3 dager
- Diabetes mellitus
- Hypertensjon
- Høy alder
- Laparoskopisk kirurgi
- Fedme
- Graviditet
- Varicer
Vær oppmerksom på at 30-50 % av all venøs tromboembolisme er «uprovosert» (ingen åpenbar utløsende årsak). Disse pasientene har høyere risiko for residiv og trenger ofte livslang antikoagulasjon.
Diagnose av lungeemboli
Diagnostikken baserer seg på en sekvensiell tilnærming: Klinisk mistanke → Vurdering av sannsynlighet (skåringsverktøy) → D-dimer (ved lav/middels sannsynlighet) → Bildediagnostikk.
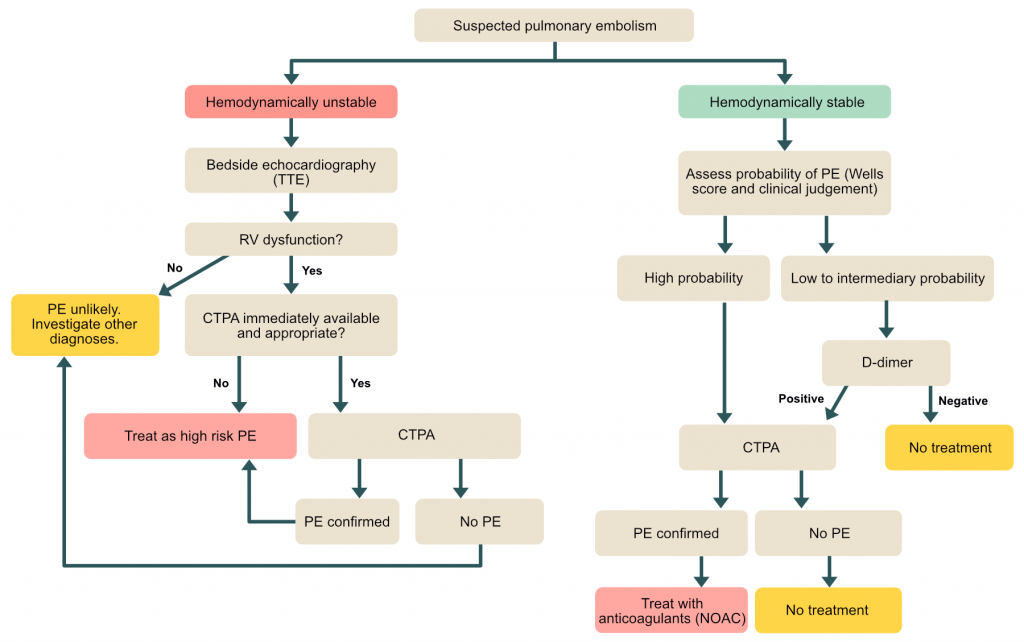
Klinisk sannsynlighet (Pre-test probability)
Det er avgjørende å vurdere sannsynligheten før man bestiller tester for å unngå overdiagnostikk og unødvendig stråling. De mest validerte verktøyene er Wells score og Revidert Genève-skår.
Ved hemodynamisk ustabil pasient er klinisk sannsynlighet per definisjon høy, og man går direkte til CTPA eller ekkokardiografi (hvis pasienten er for ustabil for CT).
Wells-score for lungeemboli
Tabell 1. Wells-kriterier for lungeemboli
| KRITERIER | PUNKTER |
|---|---|
| Symptomer eller tegn på DVT | 3 |
| Lungeemboli mer sannsynlig enn andre diagnoser | 3 |
| Tidligere VTE (lungeemboli eller DVT) | 1.5 |
| Takykardi (puls >100/bpm) | 1.5 |
| Immobilisering eller kirurgi i løpet av de siste 4 ukene | 1.5 |
| Hemoptyse | 1 |
| Kreft | 1 |
Evaluering av Wells score
Wells poengsum (todelt modell – mest brukt i klinikken)
- ≤ 4 poeng: Lungeemboli usannsynlig → Ta D-dimer.
- > 4 poeng: Lungeemboli sannsynlig → Bestill CT lungearterier direkte (ikke vent på D-dimer).
Revidert Genève-skår for lungeemboli
Tabell 2. Revidert Genève-skår for lungeemboli
| KRITERIER | PUNKTER |
|---|---|
| Alder >65 år | 1 |
| Tidligere VTE (lungeemboli eller DVT) | 3 |
| Nylig kirurgi (hvilken som helst) eller brudd i underekstremitetene | 2 |
| Kreftsykdom | 2 |
| Ensidige smerter i beinet | 3 |
| Hemoptyse | 2 |
| Hjertefrekvens 75-94 slag i minuttet | 3 |
| Hjertefrekvens ≥ 95/min | 5 |
| Smerte ved palpasjon av underekstremitet med unilateralt ødem | 4 |
Kriterier for utelukkelse av lungeemboli (PERC)
PERC-regelen (Pulmonary Embolism Rule-out Criteria) er utviklet for å unngå unødvendig utredning (inkludert D-dimer) hos pasienter der den kliniske mistanken allerede er svært lav. Dersom legen vurderer at sannsynligheten er lav (gestalt <15 %), og pasienten oppfyller alle PERC-kriteriene (0 poeng), er risikoen så lav at man kan avslutte utredningen uten testing.
Tabell 3. Kriterier for utelukkelse av lungeemboli (PERC)
| KRITERIER | PUNKTER |
|---|---|
| Alder > 50 år | 1 |
| Hjertefrekvens > 100/min | 1 |
| Oksygenmetning (POX) < 95 | 1 |
| Hemoptyse | 1 |
| Østrogenbehandling | 1 |
| Tidligere VTE (lungeemboli eller dyp venetrombose) | 1 |
| Nylig (<4 uker) kirurgi (hvilken som helst) eller traume | 1 |
| Ensidig ødem i underekstremitetene | 1 |
Biomarkører: D-dimer og Troponin
D-dimer
D-dimer er et degraderingsprodukt av tverrbindet fibrin. En normal D-dimer utelukker i praksis akutt tromboembolisme hos pasienter med lav/middels klinisk sannsynlighet (høy negativ prediktiv verdi).
D-dimer er imidlertid uspesifikk og kan være forhøyet ved en rekke tilstander som infeksjon, kreft, traumer, graviditet, høy alder og hospitalisering. En positiv D-dimer bekrefter derfor ikke diagnosen, men indikerer behov for bildediagnostikk.
Aldersjustert D-dimer
For å øke spesifisiteten hos eldre pasienter (>50 år) uten å gå på bekostning av sikkerheten, anbefales det nå å bruke aldersjustert cut-off:
- Alder > 50 år: Cut-off = Alder × 10 µg/L (eller 0.01 mg/L avhengig av laboratoriets enhet).
Dette reduserer antall unødvendige CT-undersøkelser betydelig i denne aldersgruppen.
Andre biomarkører
- Hjertetroponin (TnT/TnI): Forhøyet troponin indikerer myokardskade og er en markør for høyresidig hjertebelastning ved lungeemboli. Det er en viktig prognostisk markør; forhøyet troponin plasserer pasienten i en høyere risikokategori.
- BNP / NT-proBNP: Svært sensitiv markør for strekk i høyre ventrikkel. Normale nivåer har høy negativ prediktiv verdi for komplisert forløp.
- Arteriell blodgass: Er ikke diagnostisk, men viser typisk hypoksemi (lav pO2) og hypokapni (lav pCO2) grunnet hyperventilering. Laktatforhøyelse kan indikere sjokk.
EKG ved lungeemboli
EKG er viktig for å utelukke differensialdiagnoser (som hjerteinfarkt/STEMI), men er ofte normalt eller viser kun sinus takykardi ved lungeemboli. Ved større embolier kan man se tegn på høyre ventrikkel-belastning.
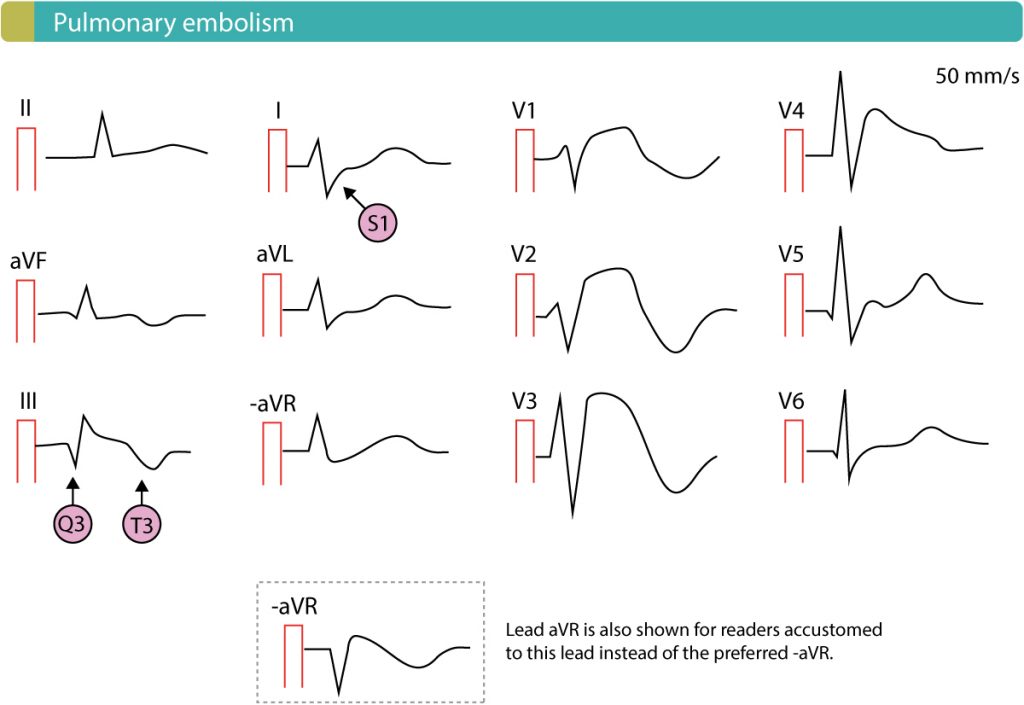
Typiske funn ved signifikant lungeemboli:
- Sinustakykardi: Det vanligste funnet.
- T-bølgeinversjoner i V1-V3 (og evt. III): Et spesifikt tegn på «RV strain» (høyre ventrikkelbelastning).
- S1Q3T3-mønster: Dyp S-bølge i avl. I, Q-bølge i avl. III og invertert T-bølge i avl. III. Klassisk, men lite sensitivt tegn.
- Nyoppstått høyre grenblokk (RBBB).
- Atrielle arytmier (Atrieflimmer/flutter).
- P-pulmonale (høy P-bølge i II).
- Høyreaksedeviasjon.
Bildediagnostikk
Computertomografi av lungearteriene (CTPA)
CT lungearterier (CTPA) er gullstandarden og den foretrukne metoden. Den visualiserer lungearteriene ned til subsegmentalt nivå. Diagnosen bekreftes ved fyllingsdefekter i kontrastvæsken. CTPA gir også informasjon om høyre ventrikkel (RV/LV-ratio > 1 indikerer dysfunksjon) og kan påvise alternative diagnoser (pneumoni, tumor, aortadisseksjon).
Forsiktighet: Graviditet (stråling), alvorlig nyresvikt (kontrast), og kjent alvorlig kontrastallergi.
Lungescintigrafi (V/Q-scan)
Brukes primært ved kontraindikasjoner mot CTPA (nyresvikt, allergi) eller hos unge/gravide for å redusere strålebelastning mot brystvev. Undersøkelsen ser etter «mismatch» mellom ventilasjon (normal) og perfusjon (redusert). Moderne SPECT-teknikk har økt nøyaktigheten. En normal perfusjonsscan utelukker LE.
Ekkokardiografi (Ultralyd av hjertet)
Ekkokardiografi er avgjørende hos den hemodynamisk ustabile pasienten. Ved massiv LE forventes tegn på akutt trykkbelastning av høyre ventrikkel. Fravær av slike tegn hos en pasient i sjokk utelukker i praksis LE som årsak til sjokket.
Klassiske ekkokardiografiske funn:
- Dilatert høyre ventrikkel (RV > LV).
- «D-formet» venstre ventrikkel i kortakse (paradoks septumbevegelse pga. trykkoverbelastning).
- McConnells tegn: Akinesi av RV frivegg med bevart kontraktilitet i apeks (ganske spesifikt for LE).
- Økt trikuspidal returstrømshastighet (TR-velocity) og forhøyet estimert lungearterietrykk (PASP).
- 60/60-tegnet: Akselerasjonstid i pulmonalklaffen <60 ms kombinert med TR-gradient <60 mmHg (spesifikt for akutt lungeemboli vs kronisk).
- Synlig trombe i høyre hjertehalvdel eller lungearterien (sjelden, men diagnostisk).
Behandling av lungeemboli
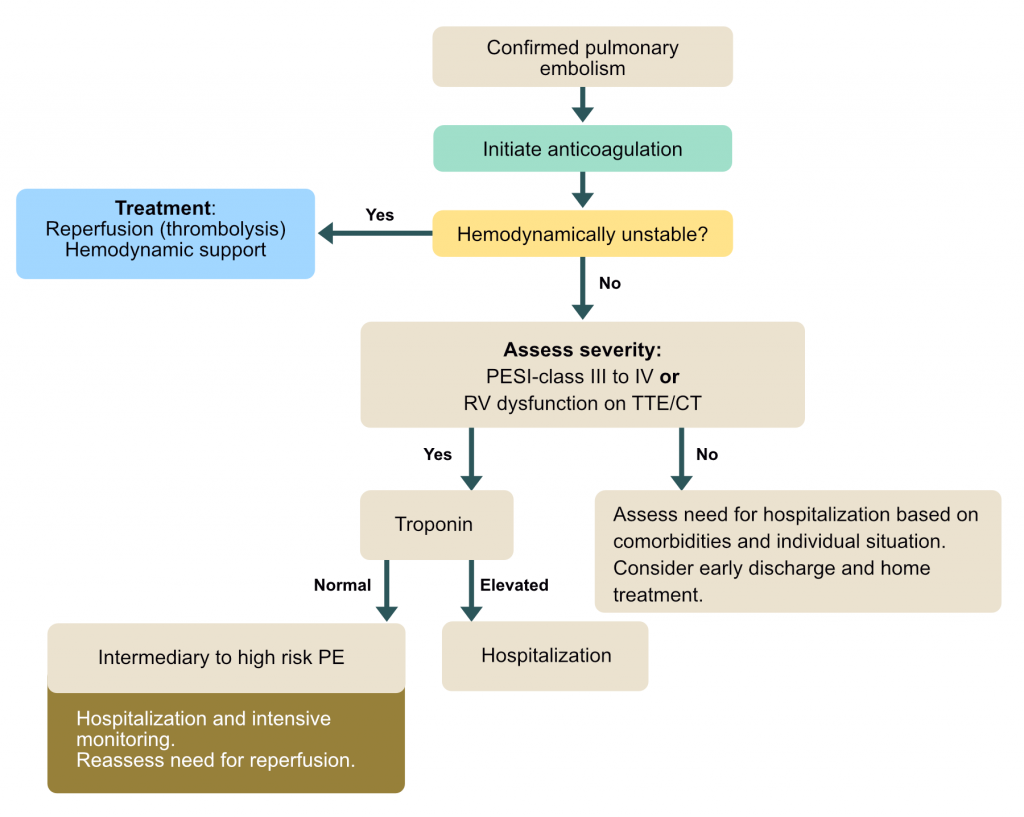
Behandlingsstrategien avhenger fullstendig av risikostratifiseringen. Målet er å hindre død, hindre residiv og hindre langtidskomplikasjoner (post-trombotisk syndrom/CTEPH).
Risikostratifisering (ESC Guidelines)
Pasienter deles inn i følgende grupper basert på risiko for tidlig død (innen 30 dager):
- Høy risiko (Massiv LE): Hemodynamisk ustabil (Sjokk eller vedvarende hypotensjon).
- Intermediær-høy risiko: Hemodynamisk stabil, men TEGN på RV-dysfunksjon (CT eller Ekko) OG forhøyet Troponin.
- Intermediær-lav risiko: Hemodynamisk stabil, enten RV-dysfunksjon ELLER forhøyet troponin (eller ingen av delene, men høy PESI-score).
- Lav risiko: Hemodynamisk stabil, ingen RV-dysfunksjon, normale biomarkører, lav PESI.
PESI (Pulmonal Embolism Severity Index)
PESI brukes for å identifisere pasienter med lav risiko som trygt kan behandles poliklinisk eller med tidlig utskrivelse. Forenklet versjon (sPESI) brukes ofte klinisk (1 poeng = ikke lav risiko).
Tabell 4. PESI (Pulmonal Embolism Severity Index)
| KRITERIER | POENG |
|---|---|
| Alder | 1 per år |
| Kreftsykdom | 30 |
| Systolisk blodtrykk < 100 mm Hg | 30 |
| Hjertefrekvens ≥ 110/min | 20 |
| Oksygenmetning (POX) < 90 | 20 |
| Hjertesvikt | 10 |
| Lungesykdom | 10 |
| Forandret mental status | 60 |
| Kroppstemperatur < 96,8 °F eller < 37 °C | 20 |
| Åndedrettsfrekvens ≥ 30/min | 20 |
| Mannlig kjønn | 10 |
Behandling av Høyrisiko (Massiv) lungeemboli
Dette er en øyeblikkelig hjelp-situasjon med høy dødelighet. Pasienten er ustabil. Reperfusjonsbehandling er indisert med mindre det foreligger absolutte kontraindikasjoner.
Akutte tiltak:
- Antikoagulasjon: Start ufraksjonert heparin (UFH) i.v. umiddelbart.
- Oksygen/Respirasjon: Gi O2. Vær forsiktig med intubasjon/respirator da overtrykksventilasjon kan redusere venøs retur og forverre sjokket.
- Sirkulasjon: Forsiktig væsketilførsel (volumbelastning kan overstrekke høyre ventrikkel). Vasoaktive medikamenter (Noradrenalin, Dobutamin) for å støtte RV-funksjon og opprettholde systemisk trykk.
- Systemisk Trombolyse: Førstevalg ved høyrisiko LE.
- Standard regime: Alteplase (tPA) 100 mg i.v. over 2 timer.
- Ved hjertestans: Bolusinjeksjon (f.eks. 50 mg).
- Kirurgisk embolektomi: Alternativ hvis trombolyse er kontraindisert eller mislykket. Krever hjerte-lunge-maskin.
- Kateterbasert behandling: Mekanisk fragmentering eller lokal trombolyse (EKOS) er alternativer ved høy blødningsrisiko.
- ECMO (VA-ECMO): Kan være aktuelt ved refraktær sirkulasjonssvikt som bro til annen behandling.
Kontraindikasjoner mot trombolyse
Vurderes alltid mot risikoen for død av lungeembolien. Ved hjertestans/trukket død er det i praksis ingen absolutte kontraindikasjoner.
Absolutte kontraindikasjoner (ved ikke-livstruende situasjon)
- Tidligere hjerneblødning (uansett tidspunkt)
- Iskemisk hjerneslag siste 6 måneder
- Skade/svulst i sentralnervesystemet
- Større traume/kirurgi/hodeskade siste 3 uker
- Pågående gastrointestinal blødning
- Kjent blødningsforstyrrelse
Behandling av Intermediær og Lav risiko
Standardbehandlingen er antikoagulasjon alene. Kroppens eget fibrinolytiske system vil over tid løse opp tromben.
Valg av antikoagulasjon (DOAK vs LMWH vs Warfarin)
- DOAK (Direkte Orale Antikoagulantia): Er nå førstevalg for de fleste pasienter.
- Apiksaban (Eliquis): 10 mg x 2 i 7 dager, deretter 5 mg x 2. (Ingen forbehandling med sprøyter nødvendig).
- Rivaroksaban (Xarelto): 15 mg x 2 i 21 dager, deretter 20 mg x 1. (Ingen forbehandling med sprøyter nødvendig).
- Edoksaban/Dabigatran: Krever minst 5 dagers forbehandling med LMWH (sprøyter) før oppstart.
- Lavmolekylært Heparin (LMWH): Førstevalg ved graviditet, og ofte ved aktiv kreftsykdom (selv om DOAK nå er likestilt for mange kreftpasienter). Brukes også ved innleggelse før overgang til tabletter.
- Warfarin (Marevan): Brukes ved alvorlig nyresvikt, antifosfolipidsyndrom, eller mekaniske hjerteklaffer. Krever «bridging» med LMWH til INR er terapeutisk (2.0-3.0).
Spesielle pasientgrupper
Gravide: Skal behandles med LMWH (Fragmin/Klexane) gjennom hele svangerskapet og minst 6 uker etter fødsel. DOAK er kontraindisert da de passerer placenta.
Kreftpasienter: Har høy risiko for både residiv og blødning. LMWH har lenge vært gullstandard, men Edoksaban, Rivaroksaban og Apiksaban er nå gode alternativer, unntatt ved gastrointestinal kreft (høyere blødningsrisiko).
Evaluering av blødningsrisiko
Det er viktig å revurdere modifiserbare blødningsrisikofaktorer jevnlig. Ukontrollert hypertensjon bør behandles aggressivt. Samtidig bruk av blodplatehemmere (Albyl-E, Plavix) bør unngås hvis mulig, da kombinasjonen med antikoagulasjon (dobbel/trippelbehandling) øker blødningsrisikoen betydelig.
Oppfølging og langtidskomplikasjoner
Behandlingslengden er vanligvis minst 3 måneder. Etter dette må det gjøres en vurdering om antikoagulasjonen skal seponeres (ved provosert LE med fjernet årsak) eller fortsette på ubestemt tid (ved uprovosert LE eller vedvarende risikofaktorer som kreft).
- Post-LE syndrom: Opptil 50 % rapporterer vedvarende dyspné eller redusert funksjonsnivå etter lungeemboli. Dette kan skyldes dekondisjonering, men også persisterende tromber.
- Kronisk tromboembolisk pulmonal hypertensjon (CTEPH): En sjelden (0.5-4 %), men alvorlig komplikasjon der trombene organiseres til fibrøst vev som okkluderer lungekarene permanent, noe som gir pulmonal hypertensjon og høyresidig hjertesvikt.
- Alle pasienter bør kontrolleres etter 3-6 måneder. Ved vedvarende dyspné bør ekkokardiografi utføres for å screene for CTEPH.
- CTEPH kan potensielt kureres kirurgisk (pulmonal endarterektomi) eller med ballongplastikk (BPA).
Referanser
Di Nisio et al. Dyp venetrombose og lungeemboli. Lancet 2016;388:3060-73
Raskob GE, Angchaisuksiri P, Blanco AN, et al. Trombose:
en viktig bidragsyter til den globale sykdomsbyrden. Arterioscler Thromb Vasc Biol 2014; 34: 2363-71
Heit JA. Epidemiologi av venøs tromboembolisme. Nat Rev Cardiol 2015; 12: 464-74.
Kearon C et al. Naturhistorien til venøs tromboembolisme. Circulation 2003; 107: I22-30.
Goldhaber SZ, Visani L, De Rosa M. Akutt lungeemboli: kliniske resultater i International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353: 1386-89.
Konstantinides et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism (ESC-retningslinjer for diagnostisering og behandling av akutt lungeemboli) utviklet i samarbeid med European Respiratory Society. European Heart Journal (2020) 41, 543603.
Leitman et al. Pulmonal arteries: imaging of pulmonary embolism and beyond. Cardiovasc Diagn Ther. 2019 aug; 9 (Suppl 1): S37-S58