Hjertesvikt
Hjertesvikt er et stort folkehelseproblem verden over og defineres klinisk som et syndrom bestående av kardinale symptomer (som dyspné og tretthet) som kan være ledsaget av tegn (som økte halsvenetrykk og lungeknatrelyder). Tilstanden skyldes en strukturell og/eller funksjonell hjertesykdom som resulterer i forhøyet intrakardialt trykk eller utilstrekkelig minuttvolum i hvile og/eller ved anstrengelse. Mens forekomsten av koronar hjertesykdom og akutt hjerteinfarkt har blitt redusert med omtrent 50 % i løpet av de siste tiårene, har forekomsten av hjertesvikt holdt seg stabil. Nye data tyder på at forekomsten av hjertesvikt blant unge voksne har økt de siste årene (Nabel et al., Savarese et al.). Dette er en paradoksal og bekymringsfull trend, særlig i lys av forbedringene i behandlingen av høyt blodtrykk (koronar hjertesykdom og høyt blodtrykk anses tradisjonelt som de viktigste årsakene til hjertesvikt). Det antas at den aldrende befolkningen og den økte forekomsten av fedme, diabetes og dysglykemi driver frem hjertesviktpandemien. Faktisk tyder stadig mer dokumentasjon på at hjertesvikt nå er den hyppigste komplikasjonen ved diabetes (Shah et al., McMurray et al.).
Behandlingen av hjertesvikt utviklet seg raskt i løpet av 1970- og 1980-årene. Betablokkere, ACE-hemmere (angiotensinkonverterende enzym-hemmere) og angiotensinreseptorblokkere (ARB) ble introdusert og forbedret overlevelsen dramatisk. Da pionerene Waagstein, Hjalmarsson og Swedberg foreslo å bruke betablokkere – som har negative inotrope og negative kronotrope effekter – for å behandle hjertesvikt, ble de møtt med skepsis. Deres banebrytende studier viste at betablokkere forlenger livet, lindrer symptomer og reduserer risikoen for sykehusinnleggelse hos pasienter med hjertesvikt. Flere store studier fulgte og viste at betablokkere, ACE-hemmere og ARB-er var effektive i behandlingen av hjertesvikt. De raske fremskrittene på 1970- og 1980-tallet ble etterfulgt av nesten to tiår uten noe større gjennombrudd i behandlingen av hjertesvikt. I 2014 introduserte PARADIGM-HF-studien en ny legemiddelklasse, ARNI (Angiotensin-Neprilysin Inhibitors), et etterlengtet gjennombrudd. Senere har introduksjonen av SGLT2-hemmere (natrium-glukose-kotransportør 2-hemmere) revolusjonert behandlingen ytterligere, og vi snakker nå om «de fire pilarene» i medisinsk behandling av hjertesvikt.
Hjertesvikt er en alvorlig tilstand med dårlig langtidsprognose dersom den forblir ubehandlet. Femårsoverlevelsen etter sykehusinnleggelse for hjertesvikt er tradisjonelt angitt til ca. 60 %, noe som kan sammenlignes med flere vanlige kreftformer (Stewart et al.). I tillegg er hjertesvikt en invalidiserende tilstand med svært negativ innvirkning på livskvaliteten. Omtrent halvparten av alle pasienter med hjertesvikt dør plutselig som følge av ventrikulære arytmier (ventrikkeltakykardi, ventrikkelflimmer). Tidlig diagnose, rask oppstart av de fire pilarene og aggressiv titrering kan forlenge overlevelsen, forbedre livskvaliteten, redusere sykehusinnleggelser og redusere risikoen for plutselig død.
Ifølge American Heart Association (AHA) og European Society of Cardiology (ESC) finnes det tre typer hjertesvikt: HFPEF, HFmrEF og HFREF. Denne klassifiseringen er primært basert på måling av venstre ventrikkels ejeksjonsfraksjon (LVEF). Majoriteten av alle kliniske studier, epidemiologiske studier og mekanistiske studier er utført på HFREF (hjertesvikt med redusert ejeksjonsfraksjon). Vår nåværende kunnskap om hjertesvikt har derfor tradisjonelt vært synonymt med kunnskap om HFREF. HFPEF (hjertesvikt med bevart ejeksjonsfraksjon) og HFmrEF (hjertesvikt med moderat redusert ejeksjonsfraksjon) har fått økt oppmerksomhet de siste årene. Tidligere fantes det ingen effektive behandlinger som kunne endre det naturlige forløpet ved disse tilstandene, men nyere studier (blant annet med SGLT2-hemmere) har vist lovende resultater også for disse pasientgruppene.
Tabell 1. Typer hjertesvikt.
| Type | Beskrivelse | Ejeksjonsfraksjon (%) |
|---|---|---|
| HFREF | Hjertesvikt med redusert ejeksjonsfraksjon | ≤40% |
| HFmrEF | Hjertesvikt med moderat redusert ejeksjonsfraksjon | 41-49% |
| HFPEF | Hjertesvikt med bevart ejeksjonsfraksjon | ≥50% |
Ved HFREF er venstre ventrikkels systoliske funksjon (ejeksjonsfraksjon) betydelig nedsatt. Ved HFPEF er det kliniske tegn på hjertesvikt til tross for normal ejeksjonsfraksjon (EF ≥50 %). Ved HFmrEF er det tegn på hjertesvikt med ejeksjonsfraksjon i en «gråsone» på 41-49 %. Det er viktig å merke seg at ejeksjonsfraksjon er en kontinuerlig variabel med en normalfordeling i befolkningen, og pasienter kan flytte seg mellom kategoriene over tid (f.eks. «HF with improved EF» etter vellykket behandling).
Mekanismene som forårsaker HFPEF er komplekse og heterogene. Tilstanden er sterkt assosiert med alder, kvinner, hypertensjon og atrieflimmer. Så godt som alle pasienter med HFPEF har diastolisk dysfunksjon og strukturelle endringer som venstre atriumdilatasjon.
Majoriteten av alle pasienter med hjertesvikt har omfattende komorbiditet. Iskemisk hjertesykdom, hjerteinfarkt, hypertensjon, arytmier, lungesykdom, kronisk nyresykdom (CKD), jernmangel og diabetes (type 1-diabetes, type 2-diabetes) er vanlige sameksisterende tilstander. Dette kompliserer behandlingen av hjertesvikt på grunn av risikoen for legemiddelinteraksjoner og vanskeliggjør titreringen av medisiner (f.eks. ACE-hemmere hos pasienter med nyresvikt). Kardiorenalt syndrom er en spesielt utfordrende tilstand, der pasienten har hjertesvikt og nyresvikt som gjensidig forverrer hverandre.
Epidemiologi ved hjertesvikt
- Hjertesvikt er noe mer vanlig blant menn ved lavere alder, men jevner seg ut hos eldre. HFPEF er vanligere hos kvinner.
- Omtrent 1-2 % av den voksne befolkningen i vestlige land har hjertesvikt, og forekomsten stiger til >10 % blant personer over 70 år.
- I Norge lever anslagsvis 100 000 personer med symptomatisk hjertesvikt.
- Livstidsrisikoen for å utvikle hjertesvikt er 20 % for en 40-åring.
- Forekomsten av hjertesvikt har vært stabil de siste to tiårene, til tross for dramatiske reduksjoner i forekomsten av akutt hjerteinfarkt og forbedret behandling av høyt blodtrykk, hovedsakelig grunnet en aldrende befolkning.
- Diabetes er sannsynligvis en av de vanligste årsakene til hjertesvikt (diabetisk kardiomyopati; Packer et al.).
Prognose
Tabell 2. Langtidsoverlevelse etter sykehusinnleggelse for hjertesvikt.
| Tid siden sykehusinnleggelse | Overlevelse (%) |
|---|---|
| 1 år | Ca. 70-80% (avhengig av alvorlighetsgrad) |
| 5 år | Ca. 50-60% |
Dødeligheten ved hjertesvikt er fortsatt høy, men har bedret seg betydelig med implementering av moderne medisinsk behandling («de fire pilarene») og enhetsterapi. Dødsfallene fordeler seg hovedsakelig mellom progressiv pumpesvikt og plutselig hjertedød (SCD). Risikoen for SCD er høyest hos pasienter med moderat alvorlig svikt (NYHA II-III), mens pasienter med alvorlig svikt (NYHA IV) oftere dør av pumpesvikt.
Årsaker til hjertesvikt
Mekanismer for hjertesvikt
- Myokardial sykdom: patologisk forandring i hjertemuskelen (iskemi, toksisk skade, inflammasjon).
- Strukturell hjertesykdom: f.eks. klaffesykdom, medfødt hjertesykdom.
- Arytmier: Både brady- og takyarytmier.
- Ledningsforstyrrelser: LBBB (venstre grenblokk) forårsaker dyssynkroni.
- Hemodynamiske forhold: Hypertensjon (trykkbelastning), volumoverbelastning.
Den underliggende årsaken avgjør om hjertesvikten er forbigående eller kronisk. For eksempel er hjertesvikt på grunn av hjerteinfarkt ofte kronisk på grunn av arrvev, mens hjertesvikt på grunn av takykardi (f.eks. atrieflimmer) kan være fullstendig reversibel ved frekvenskontroll eller konvertering til sinusrytme.
Relatert kapittel: Takykardi-indusert kardiomyopati.
Koronararteriesykdom og hjerteinfarkt
Hjerteinfarkt (STEMI, Non-STEMI) er den vanligste årsaken til hjertesvikt i den vestlige verden. Tap av viabelt myokard fører til nedsatt kontraktilitet. «Hibernating myocardium» (dvalemyokard) er en tilstand med kronisk iskemi og nedsatt funksjon som potensielt kan bedres ved revaskularisering.
Hypertensjon
Hypertensjon er den vanligste årsaken til sykelighet og dødelighet på verdensbasis (Ezzati et al.). Hypertensjon er en ledende årsak til HFPEF og en viktig bidragsyter til HFREF. Hypertensjon forårsaker hjertesvikt ved å øke etterbelastningen, noe venstre ventrikkel motvirker ved å utvikle konsentrisk hypertrofi. Hypertrofi fører imidlertid til økt veggstivhet, diastolisk dysfunksjon og remodellering, noe som til slutt kan føre til nedsatt systolisk funksjon og dilatasjon.
Diabetes
Diabetes er en sterk uavhengig risikofaktor for hjertesvikt. Begrepet diabetisk kardiomyopati brukes for å beskrive ventrikulær dysfunksjon hos diabetikere i fravær av koronarsykdom og hypertensjon. Mekanismene inkluderer metabolsk dysregulering, fibrose, mikrovaskulær dysfunksjon og nevropati. SGLT2-hemmere har vist seg å være spesielt effektive for å forebygge hjertesvikt hos denne pasientgruppen.
Arytmier som forårsaker hjertesvikt
Bradykardi (bradyarytmi) kan forårsake hjertesvikt når hjertets minuttvolum (CO) faller under kroppens metabolske behov, eller ved å forårsake dyssynkroni.
Langvarig takykardi (takyarytmi) kan forårsake hjertesvikt (takykardi-indusert kardiomyopati). En vanlig årsak til takykardiindusert hjertesvikt er atrieflimmer med høy ventrikkelfrekvens over tid. Tidlig intervensjon kan ofte normalisere venstre ventrikkelfunksjon.
Atrieflimmer og hjertesvikt er sterkt korrelert og forverrer hverandre gjensidig. Tap av atrienes bidrag til fyllingen («atrial kick») og uregelmessig ventrikkelrytme reduserer hjertets effektivitet.
Strukturell hjertesykdom
Strukturell hjertesykdom refererer til abnormiteter i hjertemuskelen, klaffer eller større kar. De vanligste klaffesykdommene som forårsaker hjertesvikt, er:
- Aortastenose (AS) – gir trykkbelastning.
- Aortaregurgitasjon (AR) – gir volumbelastning.
- Mitralstenose (MS) – hindrer fylling av venstre ventrikkel.
- Mitralinsuffisiens (MR) – gir volumbelastning (sekundær MR er vanlig ved dilatert LV).
Hjertetoksisitet
Stoffmisbruk
Alkohol er den vanligste substansen som forårsaker hjertesvikt. Alkoholisk kardiomyopati er en form for dilatert kardiomyopati som kan reverseres ved totalavholdenhet i tidlig fase. Kokain og amfetaminer kan forårsake akutt iskemi, hypertensiv krise og direkte myokardskade.
Kreftmedisiner og strålebehandling
Kardio-onkologi er et raskt voksende felt. Kreftmedisiner er en viktig årsak til hjertesvikt, ofte via direkte toksisitet eller iskemi. De vanligste kardiotoksiske legemidlene er (Suter et al.):
- Antracykliner (Doxorubicin, Epirubicin) – gir ofte irreversibel skade (doseavhengig).
- Trastuzumab (Herceptin) – gir ofte reversibel dysfunksjon.
- Tyrosinkinasehemmere (Sunitinib, Imatinib etc.).
- Immunterapi (Checkpoint-hemmere) – kan gi fulminant myokarditt.
Strålebehandling mot thorax kan forårsake myokardfibrose, koronarsykdom og perikardsykdom, ofte mange år etter behandling.
Genetiske årsaker til hjertesvikt
Genetiske mutasjoner i proteiner som utgjør cytoskjelettet, sarkomeren eller desmosomene er viktige årsaker til kardiomyopati, spesielt hos yngre pasienter:
- Dilatert kardiomyopati (DCM): Titin-mutasjoner er vanlige.
- Hypertrofisk kardiomyopati (HCM): Mutasjoner i myosin-bindende protein C eller beta-myosin tungkjede.
- Arytmogen høyre ventrikkel-kardiomyopati (ARVC).
Andre årsaker til hjertesvikt
- Infiltrative sykdommer og lagringssykdommer
- Amyloidose (AL- og ATTR-amyloidose). Viktig differensialdiagnose ved HFpEF hos eldre.
- Sarkoidose.
- Hemokromatose (jernavleiring).
- Fabrys sykdom.
- Endokrine årsaker
- Sykdommer i skjoldbruskkjertelen (hypo-/hypertyreose).
- Phaeochromocytom.
- Svangerskap
- Peripartum kardiomyopati: Nyoppstått hjertesvikt mot slutten av svangerskapet eller de første månedene etter fødsel.
- Ernæringsmessige årsaker
- Tiaminmangel (Beriberi) – sjelden, men kan sees ved underernæring/alkoholisme.
- Stress-indusert kardiomyopati
- Tako-Tsubo kardiomyopati («Broken heart syndrome»).
Remodellering av hjertet
Hjertemodellering er en sentral patofysiologisk prosess ved hjertesvikt. Det innebærer endringer i genuttrykk, molekylære, cellulære og interstitielle forandringer som manifesterer seg klinisk som endringer i hjertets størrelse, form (fra elliptisk til sfærisk) og funksjon.
Remodelleringen drives av nevrohormonell aktivering, primært via det sympatiske nervesystemet og renin-angiotensin-aldosteron-systemet (RAAS). Mens disse mekanismene er gunstige akutt for å opprettholde blodtrykket, er kronisk aktivering skadelig og fører til fibrose, apoptose (celledød) og hypertrofi.
Målet med moderne hjertesviktbehandling («Reverse Remodeling») er å bremse eller reversere denne prosessen. Betablokkere, ACE-hemmere/ARB/ARNI, MRA og SGLT2-hemmere motvirker alle ulike aspekter av remodelleringsprosessen og bidrar til at hjertet kan gjenvinne funksjon og normalisere størrelse.
Symptomer på hjertesvikt
Symptomene på hjertesvikt skyldes redusert organperfusjon (lavt minuttvolum) og/eller forhøyet fyllingstrykk (stuvning). Det kan være vanskelig å skille hjertesvikt fra andre tilstander, særlig hos:
- Pasienter med lungesykdom (f.eks. KOLS): Dyspné er hovedsymptom ved begge tilstander.
- Pasienter med fedme: Dyspné ved anstrengelse er vanlig.
- Eldre: Generell svekkelse kan maskere spesifikke symptomer.
Det er også viktig å være oppmerksom på legemiddelinduserte ødemer (f.eks. kalsiumblokkere av typen amlodipin) som kan forveksles med hjertesvikt.
Typiske symptomer på hjertesvikt
- Dyspné (kortpustethet) ved anstrengelse.
- Ortopné (tungpustethet i liggende stilling som bedres ved å sitte opp).
- Paroksysmal nattlig dyspné (anfall av tungpust som vekker pasienten om natten).
- Redusert fysisk yteevne og tretthet.
- Bilaterale ankelødemer (symmetriske).
Mindre typiske symptomer
- Nattlig hoste.
- Hvesing («Hjerteastma»).
- Vektøkning (>2 kg på 3 dager tyder på væskeretensjon).
- Vekttap (kardial kakeksi ved langtkommet svikt).
- Oppblåsthet/kvalme (grunnet leverstuvning og ødem i tarmveggen).
- Forvirring (redusert cerebral perfusjon).
Symptomer på dekompensert (akutt) hjertesvikt
Akutt hjertesvikt er en livstruende tilstand som krever øyeblikkelig sykehusinnleggelse. Det kan oppstå de novo (nyoppstått) eller, mer vanlig, som en akutt forverring av kronisk hjertesvikt. Vanlige utløsende faktorer inkluderer infeksjoner, manglende etterlevelse av medisiner/diett (salt/væske), iskemiske hendelser, eller arytmier som atrieflimmer.
Figur 1 viser symptomer ved dekompensasjon. Pasienten presenterer ofte med «vått og varmt» bilde (stuvning, men god perfusjon), men kan også være «våt og kald» (kardiogent sjokk) eller «tørr og kald» (lavt minuttvolum uten stuvning).
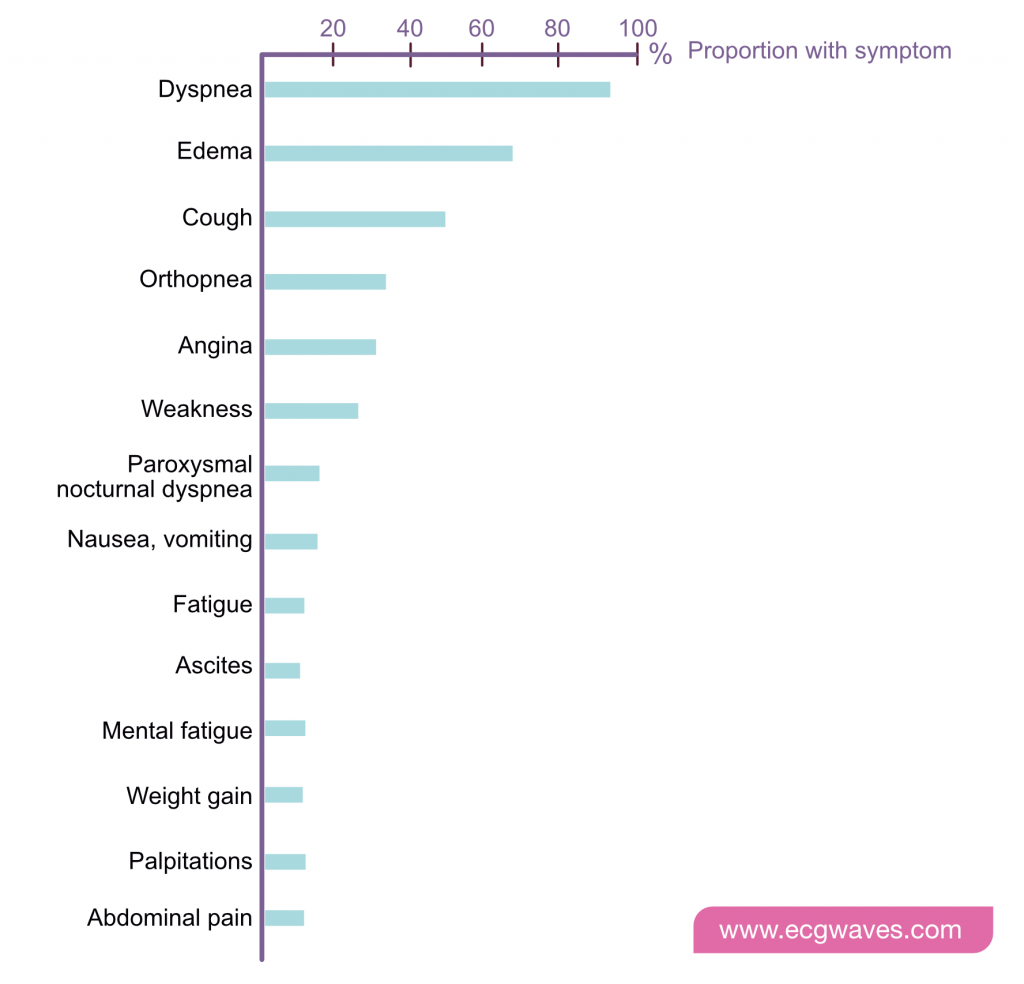
New York Heart Associations (NYHA) funksjonsklassifisering
Klassifisering av funksjonsnivå er essensielt for å overvåke sykdomsprogresjon og styre behandling.
Tabell 3. New York Heart Associations (NYHA) funksjonsklassifisering
| NYHA-klasse | Beskrivelse |
|---|---|
| I | Ingen begrensning av fysisk aktivitet. Vanlig fysisk aktivitet forårsaker ikke symptomer. |
| II | Lett begrensning av fysisk aktivitet. Symptomfri i hvile, men vanlig fysisk aktivitet gir symptomer. |
| III | Markert begrensning av fysisk aktivitet. Symptomfri i hvile, men mindre enn vanlig aktivitet (f.eks. gå på flatmark, påkledning) gir symptomer. |
| IV | Kan ikke utføre noen fysisk aktivitet uten ubehag. Symptomer på hjertesvikt i hvile. |
Kliniske tegn på hjertesvikt
En grundig klinisk undersøkelse er hjørnesteinen i diagnostikken. Vær spesielt oppmerksom på tegn på væskeretensjon («våt») og tegn på lav perfusjon («kald»).
- Halsvenestuvning: Økt jugulært venetrykk (JVP) er et spesifikt tegn på høyresidig svikt/økt fyllingstrykk.
- Hepatojugulær refluks: Positiv ved vedvarende stuvning av halsvener ved trykk mot abdomen.
- Tredje hjertelyd (S3): En lavfrekvent lyd tidlig i diastolen («ventrikkelgalopp»). Indikerer økt fyllingstrykk og nedsatt ventrikkelfunksjon. Svært spesifikt, men lav sensitivitet.
- Sideforflyttet ictus cordis: Tyder på dilatert venstre ventrikkel.
- Lungeauskultasjon: Knatrelyder (krepitasjoner), oftest basalt, tyder på lungeødem. Kan være fraværende ved kronisk svikt grunnet økt lymfedrenasje. Pleuravæske (dempning ved perkusjon) er også vanlig.
- Perifere ødemer: Symmetriske, pitting-ødemer over ankler/legger/sacrum.
- Hepatomegali og ascites: Ved høyresidig svikt.
- Takykardi og uregelmessig puls: Kompensasjonsmekanisme eller arytmi.
- Kalde ekstremiteter/oliguri: Tegn på hypoperfusjon (lavt minuttvolum).
Diagnostisering av hjertesvikt: kriterier og retningslinjer
Diagnostisering av kronisk hjertesvikt
Diagnostikken følger en logisk algoritme (se Figur 2). Ved mistanke om hjertesvikt skal pasienten utredes med:
- 1. Klinisk vurdering (anamnese, symptomer, tegn).
- 2. EKG (nesten alle med hjertesvikt har unormalt EKG).
- 3. Blodprøver (Natriuretiske peptider: NT-proBNP eller BNP).
Hvis disse testene styrker mistanken, er ekkokardiografi den avgjørende undersøkelsen for å bekrefte diagnosen og klassifisere typen (HFREF, HFmrEF, HFPEF).
Figur 2. Utredning av pasienter med mistanke om hjertesvikt (basert på ESC Guidelines).
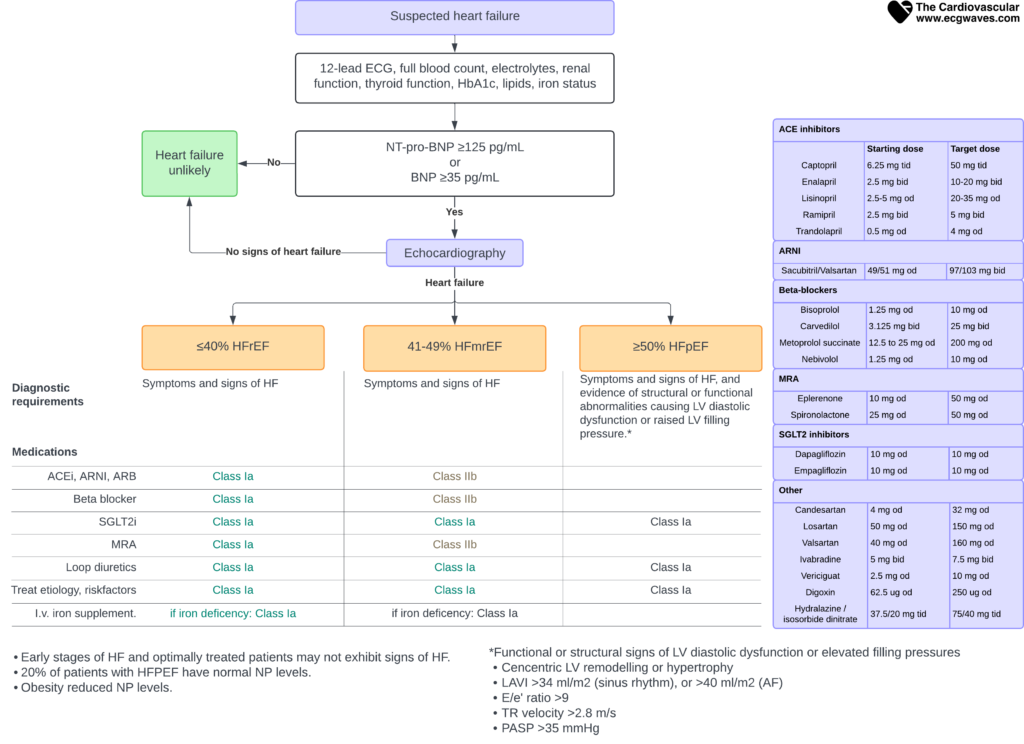
Hvis sykehistorie, fysisk undersøkelse og EKG er normale, er det lite sannsynlig at det foreligger hjertesvikt.
NT-proBNP og BNP ved hjertesvikt
Natriuretiske peptider (NT-proBNP og BNP) skilles ut fra hjertemuskelcellene ved strekk/økt veggstress. De har høy negativ prediktiv verdi, noe som betyr at normale verdier langt på vei utelukker ubehandlet hjertesvikt.
NT-proBNP-nivåer under 125 pg/mL (i ikke-akutt setting) gjør diagnosen hjertesvikt svært usannsynlig.
Tabell 4. Veiledende grenseverdier for NT-proBNP og BNP
| Biomarkør | Grenseverdi for utelukkelse (Cut-off) |
|---|---|
| Poliklinisk / Ikke-akutt | |
| NT-proBNP | 125 pg/mL |
| BNP | 35 pg/mL |
| Akutt (innleggelse) | |
| NT-proBNP | 300 pg/mL |
| BNP | 100 pg/mL |
Det er viktig å være klar over at NT-proBNP stiger ved alder og redusert nyrefunksjon (siden det skilles ut renalt). Ved atrieflimmer er verdiene ofte forhøyet uten at det nødvendigvis foreligger hjertesvikt. Motsatt kan pasienter med fedme ha falskt lave verdier.
Tabell 5. Årsaker til endrede nivåer av natriuretiske peptider
| ØKTE NIVÅER (KARDIALE) |
| Hjertesvikt |
| Atrieflimmer |
| Akutt koronarsyndrom |
| Lungeemboli / Høyre ventrikkelbelastning |
| Venstre ventrikkelhypertrofi (LVH) |
| Myokarditt |
| ØKTE NIVÅER (IKKE-KARDIALE) |
| Nyresvikt (viktig!) |
| Høy alder |
| Alvorlig infeksjon (sepsis, pneumoni) |
| Anemi |
| LAVE NIVÅER |
| Fedme (BMI >30) |
EKG ved hjertesvikt
Et helt normalt EKG taler sterkt mot systolisk hjertesvikt (98% negativ prediktiv verdi). Se etter tegn på tidligere infarkt (Q-bølger), venstre ventrikkelhypertrofi, grenblokk (LBBB) eller atrieflimmer.
Ekkokardiografi ved hjertesvikt
Ekkokardiografi er gullstandarden for diagnose. Den gir informasjon om:
- Ventrikkelfunksjon (LVEF, Global Longitudinal Strain).
- Kammerdimensjoner (dilatasjon, hypertrofi).
- Klaffefunksjon.
- Diastolisk funksjon (fyllingstrykk).
Hjerte-MR (magnetisk resonanstomografi)
Hjerte-MR er nyttig for å avklare etiologi (årsak), spesielt ved mistanke om myokarditt, amyloidose, sarkoidose eller for å skille iskemisk fra ikke-iskemisk kardiomyopati (ved hjelp av Late Gadolinium Enhancement – LGE).
Diagnostiske kriterier for hjertesvikt
Hjertesvikt med redusert ejeksjonsfraksjon (HFREF)
Kriterier:
- Symptomer og/eller tegn på hjertesvikt.
- LVEF ≤ 40 %.
Hjertesvikt med moderat redusert ejeksjonsfraksjon (HFmrEF)
Kriterier:
- Symptomer og/eller tegn på hjertesvikt.
- LVEF 41-49 %.
Hjertesvikt med bevart ejeksjonsfraksjon (HFPEF)
Dette er den vanskeligste diagnosen å stille. Siden EF er normal, hviler diagnosen på bevis for strukturell hjertesykdom og økte fyllingstrykk.
Kriterier for HFPEF:
- Symptomer og/eller tegn på hjertesvikt.
- LVEF ≥ 50 %.
- Objektiv evidens på strukturelle og/eller funksjonelle hjerteforandringer forenlig med diastolisk dysfunksjon / forhøyet fyllingstrykk i venstre ventrikkel, inkludert forhøyet NT-proBNP.
For å hjelpe i diagnostikken kan man bruke skåringsverktøy som HFA-PEFF score eller H2FPEF score. Diastolisk stresstest (ekko under belastning) kan være nødvendig hvis hvile-ekko er inkonklusivt.
Behandling av hjertesvikt
Behandlingsmål
Moderne behandling av hjertesvikt har to hovedmål:
- Forbedre prognosen: Redusere dødelighet og sykehusinnleggelser.
- Forbedre livskvalitet: Lindre symptomer og øke funksjonsevnen.
Behandling av hjertesvikt med redusert ejeksjonsfraksjon (HFREF)
Behandlingen av HFrEF er i dag basert på «De fire pilarene» – fire legemiddelklasser som alle reduserer dødelighet og sykehusinnleggelser uavhengig av hverandre. Målet er å starte disse raskt og titrere opp til måldoser.
De fire pilarene er:
- ARNI / ACE-hemmere / ARB
- Betablokkere
- Mineralokortikoidreseptorantagonister (MRA)
- SGLT2-hemmere

Diuretika
- Brukes for å lindre symptomer og tegn på væskeretensjon (stuvning).
- Har ingen dokumentert effekt på overlevelse alene, men er nødvendig for symptomlindring og for å gjøre det mulig å titrere opp andre medisiner.
- Sløyfediuretika (furosemid, bumetanid) er førstevalg. Tiazider kan legges til for synergieffekt ved diuretikaresistens.
ACE-hemmere (ACEi)
- Hjørnestein i behandlingen. Skal vurderes hos alle pasienter med HFrEF.
- Reduserer dødelighet og sykelighet.
- Vanligste bivirkning: Tørrhoste.
- Overvåk nyrefunksjon (kreatinin) og kalium etter oppstart og doseøkning.
Betablokkere
- Skal gis til alle stabile pasienter med HFrEF.
- Reduserer dødelighet med ca. 35 % og reduserer plutselig død.
- Kun evidensbaserte betablokkere bør brukes: Bisoprolol, Carvedilol, Metoprolol depot, eller Nebivolol (eldre).
- Start lavt («Start low, go slow») for å unngå forverring av svikt i startfasen.
Aldosteronantagonister (MRA)
- Spironolakton eller Eplerenon.
- Anbefales til alle pasienter med HFrEF som er symptomatiske til tross for ACEi/BB.
- Viktig: Risiko for hyperkalemi. Nøye oppfølging av K+ og kreatinin kreves. Skal brukes med forsiktighet ved eGFR <30.
SGLT2-hemmere
SGLT2-hemmere (Dapagliflozin, Empagliflozin) ble opprinnelig utviklet for diabetes, men har vist seg å ha en formidabel effekt ved hjertesvikt uavhengig av diabetesstatus. Studiene DAPA-HF og EMPEROR-Reduced viste betydelig reduksjon i kardiovaskulær død og sykehusinnleggelse.
- Anbefales til alle pasienter med HFrEF (Klasse I anbefaling).
- Trenger ingen opptitrering (startdose er måldose: 10 mg x 1).
- Har også gunstig effekt på nyrefunksjonen over tid.
- Bivirkninger: Genital soppinfeksjon er vanligst. Risiko for ketoacidose er svært lav hos ikke-diabetikere.
ARNI (sakubitril-valsartan)
Sakubitril-valsartan kombinerer en ARB med en neprilysinhemmer. Dette øker nivåene av gunstige natriuretiske peptider samtidig som RAAS-systemet hemmes.
- Overlegen ACE-hemmer (Enalapril) når det gjelder å redusere dødelighet (PARADIGM-HF studien).
- Anbefales som erstatning for ACEi hos pasienter som fortsatt har symptomer. Kan også vurderes som førstelinjebehandling hos sykehusinnlagte pasienter (de novo).
- Krever 36 timers utvaskingsperiode hvis pasienten står på ACE-hemmer (ikke nødvendig ved bytte fra ARB).
Ivabradin
Ivabradin senker hjertefrekvensen ved å hemme sinusknuten, uten å påvirke blodtrykket vesentlig. Kan vurderes hos pasienter med sinusrytme og hvilepuls ≥70/min til tross for maksimal tolerert betablokkerdose, eller der betablokker er kontraindisert.
Behandling av hjertesvikt med bevart ejeksjonsfraksjon (HFPEF)
Behandlingen av HFPEF har gjennomgått store endringer. Tidligere fantes ingen behandling med dokumentert effekt på overlevelse, men nyere studier (EMPEROR-Preserved og DELIVER) har endret dette bildet radikalt.
- SGLT2-hemmere (Dapagliflozin, Empagliflozin): Er nå den eneste medikamentgruppen med en Klasse I anbefaling for behandling av HFPEF og HFmrEF. De reduserer risikoen for sykehusinnleggelse for hjertesvikt og kardiovaskulær død.
- Diuretika: Brukes for symptomlindring ved væskeretensjon.
- Behandling av komorbiditet: Det er avgjørende å behandle underliggende årsaker og tilleggssykdommer aggressivt, spesielt hypertensjon og atrieflimmer.
- MRA (Spironolakton) og ARNI kan vurderes hos utvalgte pasienter (svakere anbefaling, Klasse IIb), særlig ved EF i nedre sjikt.
Behandling av komorbiditeter
Jernmangel ved hjertesvikt
Jernmangel er svært vanlig ved hjertesvikt (opptil 50 % av pasientene), uavhengig av om pasienten har anemi eller ikke. Jernmangel ved hjertesvikt er assosiert med redusert arbeidskapasitet, dårligere livskvalitet og økt risiko for sykehusinnleggelse.
- Alle pasienter med hjertesvikt bør screenes for jernmangel med måling av Ferritin og TSAT (transferrinmetning).
- Diagnosen stilles ved Ferritin <100 µg/L, eller Ferritin 100-299 µg/L hvis TSAT <20 %.
- Intravenøs jernbehandling (f.eks. jernkarboksymaltose) anbefales til symptomatiske pasienter med påvist jernmangel for å bedre symptomer og livskvalitet, og for å redusere risikoen for reinnleggelse (Klasse I/IIa anbefaling). Peroral jernbehandling har liten eller ingen effekt ved hjertesvikt på grunn av redusert opptak i tarmen.
Andre behandlinger for hjertesvikt
- Livsstil: Røykeslutt, vektreduksjon ved fedme, og tilpasset fysisk aktivitet/rehabilitering er essensielt.
- Vaksinasjoner: Årlig influensavaksine, pneumokokkvaksine og COVID-19 vaksine anbefales sterkt.
- Salt og væske: Moderat saltbegrensning. Væskerestriksjon (1.5-2 L/døgn) anbefales vanligvis kun ved alvorlig svikt med hyponatremi eller betydelig ødemtendens.
Apparatbehandling for hjertesvikt
For utvalgte pasienter med HFrEF som forblir symptomatiske og har redusert EF til tross for optimal medisinsk behandling i minst 3 mnd, skal implantasjon av hjertestarter (ICD) og/eller resynkroniseringsterapi (CRT) vurderes.
Resynkroniseringsbehandling av hjertet (CRT)
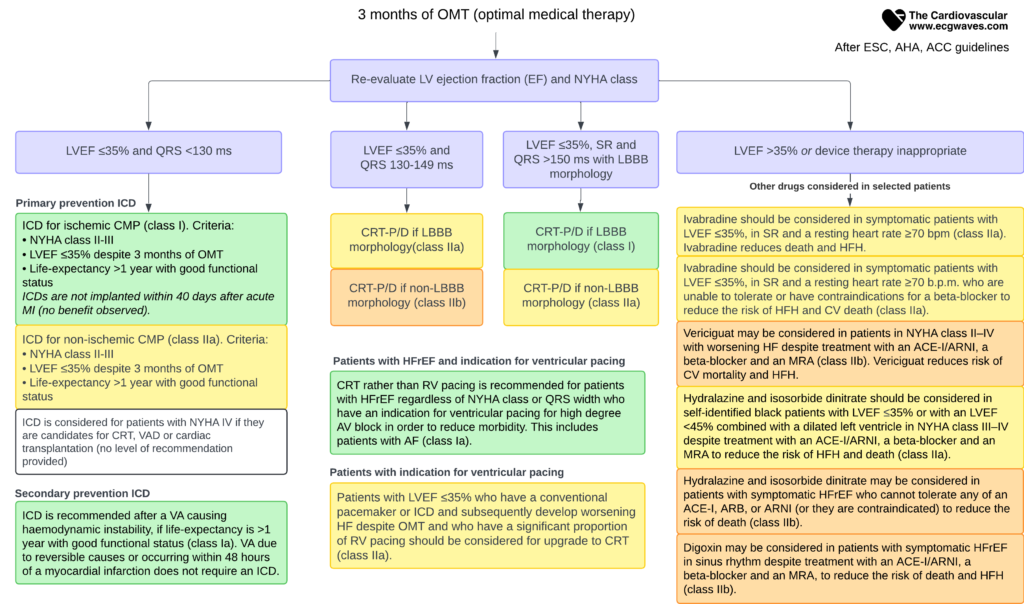
Formålet med CRT er å koordinere sammentrekningen av høyre og venstre ventrikkel hos pasienter med dyssynkroni (typisk venstre grenblokk, LBBB). Dette bedrer pumpefunksjonen, reduserer mitrallekkasje og bedrer overlevelse.
Hovedindikasjoner for CRT (ESC Guidelines 2021):
- Symptomatisk hjertesvikt (NYHA II-IV).
- LVEF ≤ 35 %.
- Optimal medisinsk behandling.
- Sinusrytme.
- LBBB med QRS-bredde ≥ 150 ms (Klasse I, sterkeste anbefaling).
- Kan også vurderes ved LBBB 130-149 ms, eller non-LBBB med QRS ≥ 150 ms.
Implanterbar kardioverterdefibrillator (ICD)
En ICD forebygger plutselig død ved å behandle maligne ventrikulære arytmier med pacing (ATP) eller sjokk. Det skilles mellom sekundærprofylakse (pasienter som har overlevd hjertestans/alvorlig arytmi) og primærprofylakse (forebygging hos risikopasienter).
Primær forebygging med ICD
- Anbefales generelt ved iskemisk kardiomyopati (etter infarkt) med LVEF ≤ 35 % og NYHA II-III, etter 3 mnd optimal behandling.
- Ved ikke-iskemisk kardiomyopati er effekten på totaldødelighet noe mindre sikker (jf. DANISH-studien), men anbefales fortsatt hos pasienter med høy risiko (Klasse IIa).
Avansert hjertesvikt
Hos en liten andel pasienter progredierer svikten til tross for all behandling. Disse pasientene har «avansert hjertesvikt» (tidligere kalt end-stage). Symptomer inkluderer alvorlig dyspné i hvile, kakeksi, hypotensjon og hyppige innleggelser. Behandlingsalternativer her er hjertetransplantasjon (HTX) eller mekanisk hjertepumpe (LVAD) som «bro til transplantasjon» eller som destinasjonsterapi («varig behandling»). Palliativ behandling og symptomlindring er sentralt i denne fasen.
Referanser
McDonagh TA, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021.
McDonagh TA, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2023.
Nabel EG, Braunwald E. En historie om koronararteriesykdom og hjerteinfarkt. New England Journal of Medicine. 2012.
McMurray JJ, Packer M, Desai AS, et al. Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure. New England Journal of Medicine. 2014.
McMurray JJ, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction (DAPA-HF). New England Journal of Medicine. 2019.
Packer M, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure (EMPEROR-Reduced). New England Journal of Medicine. 2020.
Anker SD, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction (EMPEROR-Preserved). New England Journal of Medicine. 2021.
Ponikowski P, et al. Ferric Carboxymaltose for Iron Deficiency at Discharge after Acute Heart Failure (AFFIRM-AHF). The Lancet. 2020.