Fysikk ved myokardperfusjonsavbildning (SPECT, PET): Radiotracere, perfusjon, blodstrøm og viabilitet
SPECT vs. PET: Teknologiske forskjeller og klinisk anvendelse
Valget mellom SPECT og PET avhenger av tilgjengelighet, klinisk problemstilling og pasientkarakteristika. Mens SPECT lenge har vært arbeidshesten innen nukleærkardiologi, tilbyr PET betydelige fordeler når det gjelder bildekvalitet og diagnostisk nøyaktighet.
- Ved SPECT (Single Photon Emission Computed Tomography) benyttes radiotracere (sporstoffer) som sender ut enkle gammafotoner direkte. Disse gammastrålene detekteres av gammakameraer som roterer rundt pasienten for å lage tomografiske bilder av venstre ventrikkel. Selv om moderne SPECT-kameraer med CZT-detektorer har bedret bildekvaliteten, begrenses teknikken fortsatt av lavere oppløsning og utfordringer med å korrigere for bløtvevsattenuering (svekkelse av signalet gjennom vev), spesielt hos overvektige pasienter.
- Ved PET (Positronemisjonstomografi) avgir radiotracere positroner. Når et positron kolliderer med et elektron i vevet, annihilerer de hverandre og produserer to høyenergi gammafotoner (511 keV) som sendes ut i nøyaktig motsatt retning (180 grader). PET-skannere bruker koinsidensdeteksjon for å registrere disse parene, noe som eliminerer behovet for mekaniske kollimatorer. Dette resulterer i bilder med betydelig høyere romlig og tidsmessig oppløsning. PET muliggjør også rutinemessig og nøyaktig korreksjon for attenuering (vanligvis ved hjelp av CT), noe som gir færre artefakter og høyere diagnostisk sikkerhet.
Når bør PET foretrekkes fremfor SPECT?
I henhold til gjeldende europeiske retningslinjer (ESC) og norsk klinisk praksis, bør PET vurderes fremfor SPECT i følgende situasjoner:
- Overvektige pasienter: Pasienter med høy BMI (>30-35) får ofte dårlig bildekvalitet på SPECT grunnet bløtvevsattenuering. PETs høyere energi og attenuasjonskorreksjon gir diagnostiske bilder der SPECT ofte feiler.
- Flerkarsykdom: Mistanke om balansert iskemi (se under) krever kvantifisering av blodstrøm, som er en styrke ved PET.
- Kjent koronarsykdom: For vurdering av funksjonell betydning av kjente stenoser eller graft-funksjon etter CABG.
- Strålehygiene: PET-protokoller (spesielt med Rubidium-82 eller Ammoniakk-13N) gir ofte lavere stråledose til pasienten sammenlignet med tradisjonelle SPECT-protokoller.
Kvantifisering av blodstrøm og koronar flowreserve (CFR)
En av de største fordelene med PET er muligheten til absolutt kvantifisering. Mens SPECT tradisjonelt viser relativ perfusjon (hvor det friskeste området settes til 100 %), gir kvantitativ PET-perfusjonsavbildning presise målinger av myokardets absolutte blodstrøm i milliliter per minutt per gram vev (mL/min/g).
Denne teknikken er essensiell for å påvise balansert iskemi. Slik iskemi oppstår ved betydelig flerkarsykdom eller hovedstammestenose, hvor alle koronararteriene er like kompromittert. Dette fører til en jevnt redusert perfusjon i hele myokardiet, som feilaktig kan fremstå som normalt (homogent opptak) på relative SPECT-bilder. Ved å kvantifisere den absolutte blodstrømmen avsløres det at flowen er globalt nedsatt.
Koronar Flowreserve (CFR)
Ved hjelp av absolutte målinger kan man beregne koronar flowreserve (CFR), som er ratioen mellom myokardial blodstrøm under maksimalt stress og blodstrøm i hvile. En normal CFR er vanligvis > 2,0–2,5. En redusert CFR kan indikere:
- Obstruktiv epikardial koronarsykdom.
- Koronar mikrovaskulær dysfunksjon (CMD) – en tilstand som er spesielt hyppig hos kvinner, diabetikere og pasienter med hypertensjon, hvor epikardiale kar er åpne, men mikrosirkulasjonen er syk.
For at et sporstoff skal være egnet til å kvantifisere blodstrømmen i myokardiet, må opptaket være nært korrelert med den faktiske blodstrømmen. Et ideelt sporstoff har høy ekstraksjon fra blod til vev og høy retensjon, med et lineært forhold mellom myokardblodstrøm og målt sporstoffaktivitet over et bredt fysiologisk område (Murthy et al.).
Som det fremgår av figur 1 under, er 15O-vann (radioaktivt vann) det sporstoffet som kommer nærmest det ideelle, med et lineært forhold mellom myokardialt opptak og koronar blodstrøm selv ved svært høye flow-rater. 15O-vann har en svært kort halveringstid (2 minutter), noe som medfører minimal strålingseksponering og tillater raske protokoller. Det er metabolsk inert og diffunderer fritt over cellemembraner. Ulempen er at det ikke bindes i vevet, noe som krever dynamisk scanning og avansert kinetisk modellering for bildeanalyse. En enkelt sesjon kan brukes til å utføre både hvile- og stressbilder (Sogbein et al.).
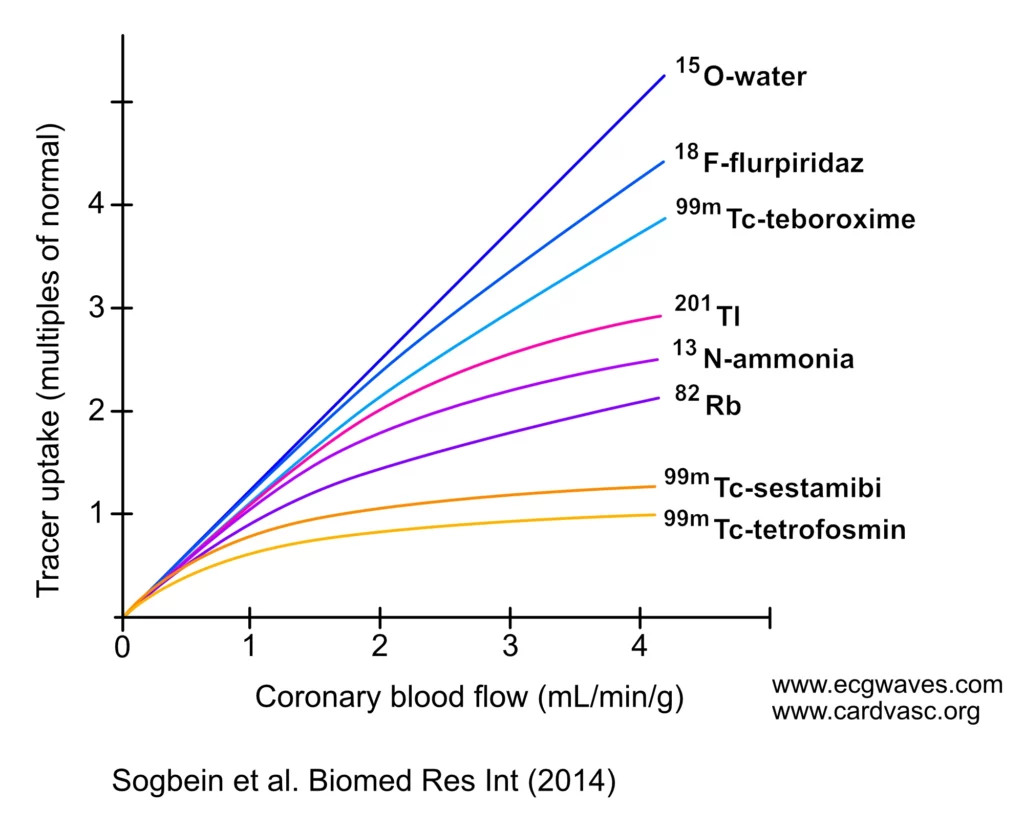
Roll-off-fenomenet
Roll-off-fenomenet ved myokardperfusjonsavbildning, illustrert i figuren over, beskriver det ikke-lineære forholdet mellom opptak av visse sporstoffer og den faktiske koronare blodstrømmen. Dette er en viktig begrensning ved flere vanlige radiotracere.
Som observert med sporstoffer som Technetium-99m (Sestamibi/Tetrofosmin) og Tallium-201, øker opptaket lineært ved lav til normal koronar blodstrøm. Etter hvert som blodstrømmen stiger til høyere nivåer (som under farmakologisk stress), flater imidlertid ekstraksjonsfraksjonen ut – sporstoffet «klarer ikke å henge med» økningen i flow. Denne metningseffekten («roll-off») fører til at forskjellen i signal mellom et normalt perfusert område og et iskemisk område blir mindre enn den faktiske flow-forskjellen skulle tilsi. Dette kan føre til en underestimering av iskemigraden ved betydelig koronarsykdom og potensielt resultere i falskt negative funn eller underestimering av stenosealvorlighet.
Radiotracere i myokardperfusjonsavbildning
Valg av radiotracer er avgjørende for bildekvalitet, logistikk og strålebelastning. Radiotracere er designet for å distribuere seg proporsjonalt med blodstrømmen og dermed identifisere iskemiske områder i myokardiet.
Radiotracere for SPECT
- Technetium-99m (Sestamibi eller Tetrofosmin): Dette er standarden for SPECT i dag. Med en halveringstid på seks timer og en gammaenergi på 140 keV, er isotopen optimalisert for moderne gammakameraer. Dette muliggjør høye doser for bedre bildekvalitet med akseptabel strålebelastning. Sporstoffet diffunderer passivt inn i kardiomyocyttene drevet av membranpotensialet, bindes til mitokondriene og omfordeles (redistribueres) minimalt. Siden opptaket er «låst» kort tid etter injeksjon, kan bildetakning skje 30-60 minutter etter stress, noe som gir logistisk fleksibilitet.
- Tallium-201 (201Tl): Historisk viktig, men mindre brukt i dag grunnet ugunstig dosimetri. Det er en kaliumanalog med en halveringstid på 73 timer, som transporteres inn i kardiomyocyttene via Na+/K+-ATPase-pumpen. En unik egenskap er at Tallium redistribueres over tid. Dette gjør det mulig å vurdere levedyktighet (viabilitet) og «hibernating myocardium» (dvalemyokard) ved å ta bilder sent etter injeksjon. Ulempene inkluderer lav fotonenergi (gir mer attenuering/uskarphet) og betydelig høyere strålingseksponering for pasienten sammenlignet med Technetium-baserte tracere.
Hva er myokardial redistribusjon?
I myokardperfusjonsavbildning refererer redistribusjon til dynamikken i hvordan et radiotracer beveger seg inn og ut av myokardiet over tid. Radiotracere uten signifikant redistribusjon (som Tc-99m) opprettholder sin opprinnelige distribusjon, noe som betyr at bildet gjenspeiler blodstrømmen nøyaktig slik den var på injeksjonstidspunktet (f.eks. under maksimalt stress). Radiotracere med høy grad av redistribusjon (som Tallium-201) vil over tid vaskes ut av normale celler og akkumuleres i iskemiske celler som var dårlig perfusert initielt. Dette fenomenet utnyttes klinisk for å skille mellom permanent arrvev (ingen opptak verken tidlig eller sent) og levedyktig vev (redusert opptak tidlig, men normalisering ved sen avbildning).
Tabell 1. Radiotracere som brukes til SPECT-avbildning
| Egenskap | Tallium-201 (201Tl) | Technetium-99m (99mTc) |
|---|---|---|
| Radiotracer-dose | 3-4 mCi Ytterligere 1 mCi for reinjeksjonsprotokoll |
~30 mCi (1100 MBq) hvis hvile 10–30 mCi hvis det utføres både hvile- og stressavbildning |
| Stråleeksponering | Høy (12-16 mSv) T1/2 = 73 timer |
Moderat (5-10 mSv) T1/2 = 6 timer |
| Varighet av studien | 4-5 timer (hvile og omfordeling) 24 timer hvis sen avbildning utføres |
1-2 timer (effektiv protokoll) |
| Gating (funksjonell info) | Dårlig kvalitet (lavt fotontall) | Ja, utmerket for vurdering av EF og veggebevegelse |
| Omfordeling | Ja – Krever gjentatt avbildning for å skille iskemi fra arr. | Nei – Perfusjonen er «frosset» ved injeksjonstidspunktet. |
| Bildekvalitet | Dårligere 69-80 keV røntgenstråler Lav energi gir mer vevsabsorpsjon og støy |
Overlegen 140 keV fotoner Ideell energi for gammakameraer, mindre støy |
| Ekstrakardialt opptak | Hyppig opptak i lungene ved venstre ventrikkelsvikt (indikerer dårlig prognose) | Hyppig lever- og tarmopptak kan forstyrre tolkningen av inferior vegg |
| Kontraindikasjoner | Ingen spesifikke | Ingen absolutte, men forsiktighet ved graviditet/amming (gjelder alle isotoper) |
| Ekstraksjonsfraksjon | ~85 % (høy) | ~65 % Sestamibi ~54 % Tetrofosmin |
| Clearance | Renal/GI | Hepatobiliær (viktig å vente til leveraktivitet klarnes) |
Sporstoffer for PET-avbildning
PET-tracere har generelt kortere halveringstid enn SPECT-tracere, noe som krever enten en syklotron på stedet (for 13N-ammoniakk og 15O-vann) eller en generator (for 82Rubidium). Dette påvirker logistikk og kostnader.
Tabell 2. Radiotracere som brukes til kvantifisering av myokardblodstrøm ved PET
| Egenskap | 82Rb-klorid (Rubidium) | 13N-ammoniakk | 15O-vann | 18F-flurpiridaz (Under utvikling) |
|---|---|---|---|---|
| Produksjonsmetode | Generator (tilgjengelig uten syklotron) | Syklotron (krever on-site produksjon) | Syklotron (krever on-site produksjon) | Syklotron (kan distribueres regionalt) |
| Halveringstid (min) | 1.27 (svært kort) | 10 | 2.0 | 110 (lengre holdbarhet) |
| Positronrekkevidde (mm) | 2.6 (gir noe lavere oppløsning) | 0.57 | 1.0 | 0.23 (svært høy oppløsning) |
| Effektiv dose (mSv) | Lav (< 3-4 mSv for komplett studie) | ~2 mSv | ~1 mSv | ~2-4 mSv |
| Spillover fra organer | Magevegg (kan forstyrre) | Lever og lunge (generelt lite problem) | Ingen vevsopptak (krever subtraksjon av blodpool) | Tidlig lever |
| Klinisk bruk | Mest brukt i klinisk praksis (høyvolum-sentre) | Gullstandard for kvantifisering i mange studier | Forskningsstandard for absolutt flow | Lovende for fremtidig klinisk bruk |
18F-Fluorodeoksyglukose (18F-FDG) PET: Viabilitet og inflammasjon
Mens de overnevnte tracerne ser på blodstrøm (perfusjon), ser 18F-FDG på cellemetabolisme. FDG er en glukoseanalog.
Viabilitetsutredning
18F-FDG PET er «gullstandarden» for å vurdere myokardets levedyktighet (viabilitet) hos pasienter med iskemisk hjertesvikt. Det tas selektivt opp av metabolsk aktivt myokard som har byttet substrat fra fettsyrer til glukose grunnet iskemi.
- Perfusjon-metabolisme mismatch: Dette er kjennetegnet på levedyktig myokard («hibernating myocardium»). Man ser redusert blodstrøm (på ammoniakk/rubidium-PET eller SPECT), men bevart eller økt opptak av FDG. Dette indikerer at vevet er i live og kan gjenvinne funksjon ved revaskularisering (PCI eller CABG).
- Match: Redusert blodstrøm og tilsvarende redusert FDG-opptak indikerer arrvev. Revaskularisering vil sannsynligvis ikke bedre hjertefunksjonen i dette området.
Hjertesarkoidose
18F-FDG PET brukes også i økende grad til å diagnostisere og overvåke aktiv hjertesarkoidose. Inflammatoriske celler (makrofager) har høyt glukoseopptak. Ved å bruke spesielle dietter (høy-fett, lav-karbo) før undersøkelsen for å undertrykke det normale hjertets glukoseopptak, vil områder med aktiv inflammasjon lyse opp som «hot spots».
Farmakologisk stress og fysiologiske fenomener
De fleste PET-undersøkelser og mange SPECT-undersøkelser utføres med farmakologisk stress i stedet for fysisk belastning på ergometersykkel. De vanligste medikamentene er vasodilatorer som adenosin, regadenoson eller dipyridamol.
Koronar steal-fenomenet
Vasodilaterende stressmidler fungerer ved å maksimere koronar blodstrøm. Dette kan utløse «koronar steal», et fenomen som oppstår når blod omdirigeres fra et område som forsynes av en stenotisk arterie, til et område med bedre perfusjon (friske kar).
Mekanismen er som følger: Arteriolene distalt for en trang stenose er allerede maksimalt dilaterte i hvile for å opprettholde blodstrømmen (autoregulering). Friske kar har derimot bevart reservekapasitet. Når man gir en vasodilator, vil motstanden i de friske karene falle drastisk, mens motstanden i det syke karet ikke kan reduseres ytterligere. Dette fører til at perfusjonstrykket faller, og blodstrømmen «stjeles» bort fra det iskemiske området til fordel for det friske området. Denne relative (og noen ganger absolutte) reduksjonen i blodstrøm gjør iskemien synlig på bildene.
Omvendt fordeling (Reverse Redistribution)
Omvendt omfordeling er et uvanlig og ofte misforstått funn. Det refererer til et mønster der en perfusjonsdefekt som er observert under stressavbildning, ser ut til å forverres – eller oppstår som en ny defekt – på hvilebilder. Normalt forventer man at defekter bedres (iskemi) eller forblir uendret (arr) i hvile.
Dette mønsteret ses noen ganger med technetium-99m sestamibi og antas ofte å være en artefakt snarere enn en indikasjon på ekte patologi. Årsaker kan inkludere:
- Raskere utvasking (washout) av tracer fra iskemiske områder enn normale områder (mindre sannsynlig med Tc-99m).
- Subtile forskjeller i attenuering eller pasientposisjonering mellom stress- og hvileopptak.
Klinisk er omvendt omfordeling vanligere hos overvektige pasienter (ofte i RCA-territoriet grunnet diafragma-attenuering) og hos kvinner med store bryster (vanligvis i LAD-territoriet). Det har svakere korrelasjon med obstruktiv koronarsykdom enn klassisk reversibel iskemi og anses i mange tilfeller som en godartet artefakt eller relatert til ikke-obstruktiv sykdom, selv om det i noen tilfeller har vært assosiert med tidligere infarkt eller kardiomyopati.