Introduksjon til pacemakere og hjerteutstyr: Pacemaker, ICD, CRT
Den kunstige pacemakeren er en av de største medisinske oppfinnelsene i det 20. århundret. Fra å være et risikabelt eksperiment på 1930-tallet har pacemakeren utviklet seg til å bli en rutinemessig, trygg og sofistikert behandling som brukes over hele verden. Kunstige pacemakere har dratt stor nytte av de tekniske fremskrittene som er gjort, særlig i forbindelse med utviklingen av transistorer, programmerbare kretser, litiumbatterier og Internett-tilkoblede enheter (remote monitoring). De siste årene har det skjedd ytterligere gjennombrudd. Den ledningsfrie («leadless») pacemakeren representerer en betydelig teknologisk evolusjon, men også utviklingen innen fysiologisk pacing – inkludert His-bunt-pacing og venstre gren-områdepacing (LBBAP) – endrer nå standarden for hvordan vi tenker rundt ventrikulær aktivering.1
Med tanke på den utstrakte bruken av pacemakere og trenden mot økt bruk av cardiale implanterbare elektroniske enheter (CIED) generelt, er det viktig å ha god kjennskap til disse apparatene. Denne delen er viet konvensjonelle kunstige pacemakere. Mer avanserte enheter som ICD (implanterbar kardioverterdefibrillator) og CRT (kardial resynkroniseringsterapi) omtales i de påfølgende kapitlene. Den første delen består av en grundig gjennomgang av det grunnleggende om hjertets automatikk, aksjonspotensialer og elektrofysiologien som danner grunnlaget for pacemakerbehandling.
Prinsipper for myokardets eksitabilitet og ledningssystem
Hjertet fungerer som et funksjonelt syncytium. For å oppnå en hemodynamisk effektiv pumpemekanisme må atriene og ventriklene aktiveres raskt og sekvensielt. Rask aktivering er avgjørende for å rekruttere så mye myokard samtidig som mulig; synkron kontraksjon sikrer et høyt trykk i kamrene og dermed effektiv tømming. Sekvensiell aktivering innebærer at forkamrene kontraherer først (atrialt bidrag), slik at ventriklene fylles optimalt før ventrikkelkontraksjonen starter (preload). For å koordinere disse prosessene er hjertet avhengig av sin iboende pacemaker – sinusknuten – og et spesialisert elektrisk ledningssystem.
Det elektriske systemet er isolert fra det kontraktile myokardiet av annulus fibrosus (ventileplanet), som hindrer ukontrollert elektrisk overledning mellom atrier og ventrikler. Den eneste normale elektriske forbindelsen passerer gjennom AV-knuten og His-bunten. Ledningscellene i ventriklene danner bunter av fibre som sprer aksjonspotensialet med høy hastighet til det kontraktile myokardiet. Når myokardcellene mottar aksjonspotensialet, aktiveres kalsiumfrigjøring intracellulært, noe som fører til mekanisk kontraksjon (eksitasjons-kontraksjons-kobling). Figur 1 illustrerer sinusknuten og komponentene i ledningssystemet.
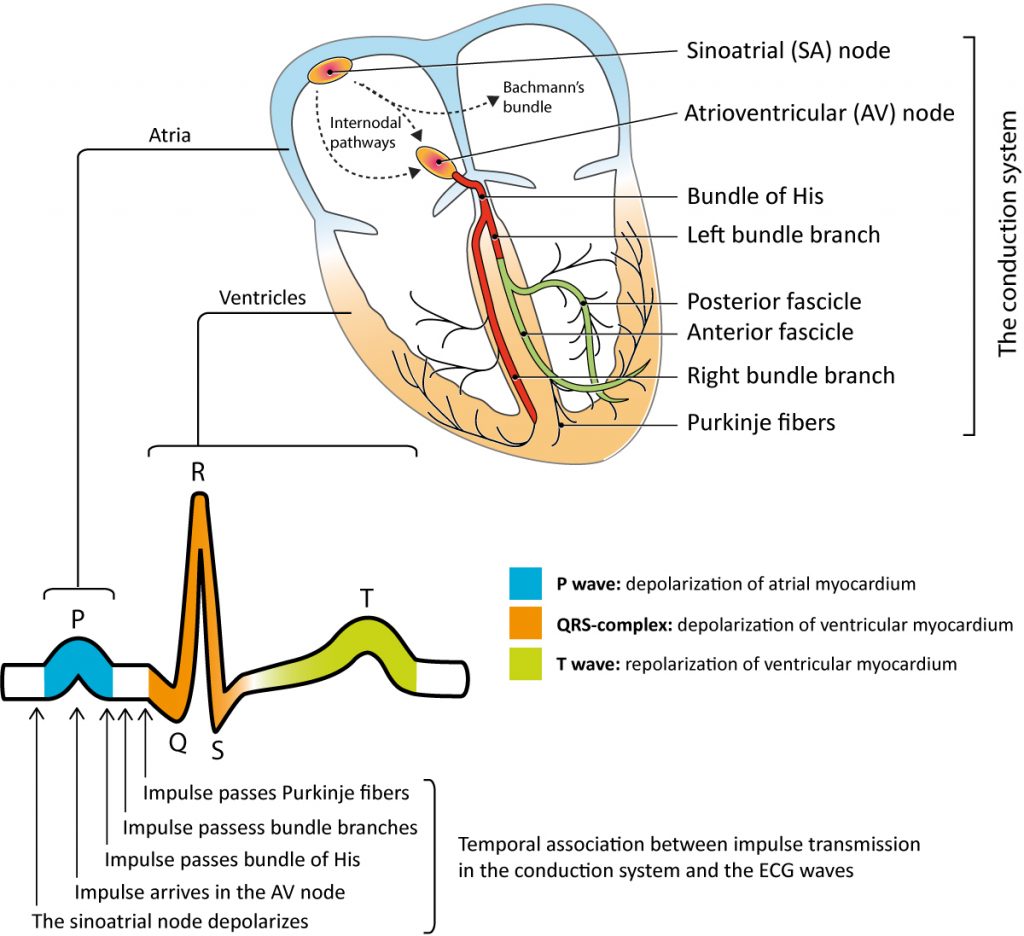
AV-systemet består av AV-knuten, His-bunten og Purkinje-fibrene. Disse strukturene overfører atriepulsen til ventriklene. En fysiologisk forsinkelse i AV-knuten er nødvendig for å la atriene tømme seg før ventrikkelkontraksjonen starter. Deretter er impulsoverføringen svært rask (2–4 m/s) gjennom His-bunten og Purkinje-fibrene, slik at praktisk talt hele ventrikkelmyokardiet aktiveres (depolariseres) nesten momentant. Denne raske aktiveringen fra apex og oppover gir et smalt QRS-kompleks (normalt <120 ms). Ved konvensjonell pacemakerbehandling i høyre ventrikkel, startes aktiveringen utenfor ledningssystemet, noe som gir langsommere muskel-til-muskel ledning og et bredere QRS-kompleks (grenblokkmønster).
Hjertets aksjonspotensial
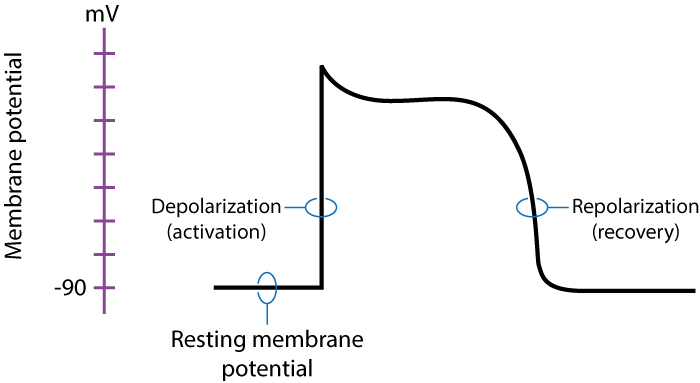
Aksjonspotensialet representerer de elektriske spenningsendringene over cellemembranen og består av en depolarisering (aktivering) etterfulgt av repolarisering (gjenoppretting). Hjertesyklusen starter når sinusknuten utløser det første aksjonspotensialet, som deretter sprer seg gjennom myokardiet som en bølgefront. Det er fundamentale forskjeller mellom aksjonspotensialet i pacemakerceller (som i sinusknuten og AV-knuten) og i kontraktile muskelceller (atrialt og ventrikulært myokard).
I kontraktile celler («fast response»-vev) domineres depolariseringen av en rask innstrømming av natrium (Na+). I pacemakerceller («slow response»-vev) er det kalsiumioner (Ca2+) som står for selve depolariseringen, og de mangler den raske natriumstrømmen, noe som gir en langsommere stigning i fase 0. Figur 2 viser hvordan aksjonspotensialet ser ut i kontraktile myokardceller, inndelt i fasene 0 til 4.
Hjertets elektromekaniske kobling
Depolarisering aktiverer myokardcellene og setter i gang cellulære prosesser som fører til sammentrekning av cellene. Dette skjer primært ved at depolariseringen åpner spenningsstyrte L-type kalsiumkanaler i cellemembranen. Kalsium strømmer inn i cellen og utløser en mye større frigjøring av kalsium fra sarkoplasmatisk retikulum (kalsium-indusert kalsiumfrigjøring). Denne økningen i intracellulært kalsium muliggjør interaksjon mellom aktin og myosin. Spredningen av en elektrisk impuls er derfor direkte koblet til en mekanisk hendelse; dette kalles elektromekanisk kobling.
Det elektriske ledningssystemet i hjertet
Sinusknuten og den iboende automatikken
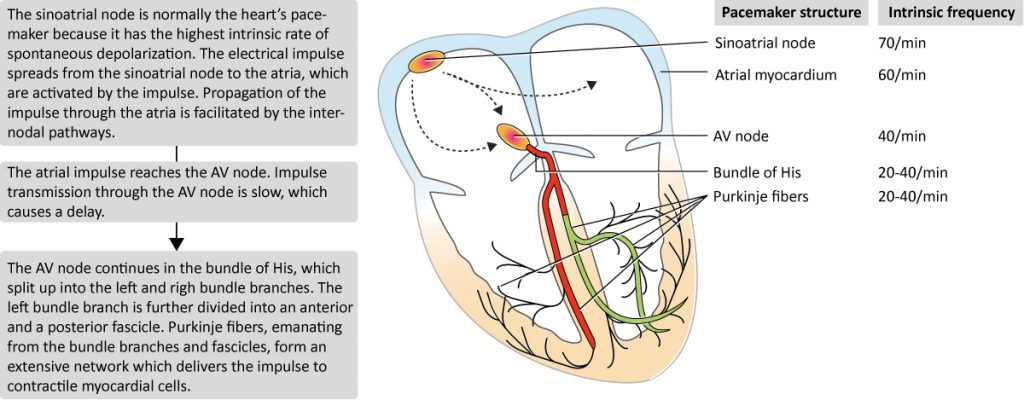
Sinusknuten er en liten oval struktur (ca. 15 mm lang) som ligger subepikardielt nær inngangen til vena cava superior i høyre atrium (figur 1). Sinusknuten består av høyt spesialiserte pacemakerceller (P-celler) i en kollagen matrise. Disse cellene har en unik evne til å depolarisere spontant i fase 4 (diastolen). Cellene i sinusknuten er dermed i stand til spontant å utløse et aksjonspotensial uten ekstern stimulering. Denne evnen kalles automatikk. Under hvileforhold har cellene i sinusknuten en iboende depolarisasjonshastighet på omtrent 60–80 ganger per minutt. Sinusknuten er hjertets primære pacemaker og er rikt innervert av både sympatiske og parasympatiske nervefibre, som finjusterer hjertefrekvensen kontinuerlig.
Sekundære (latente) pacemakere
Dersom sinusknuten svikter, har hjertet innebygde sikkerhetsmekanismer. Det finnes flere strukturer som har automatikk og dermed evnen til å fungere som hjertets pacemaker. Disse strukturene danner et hierarki:
- Deler av atrialt myokard: Det finnes klynger av atriale celler rundt crista terminalis, inngangen til sinus coronarius og vena cava inferior, samt celler rundt mitral- og trikuspidalklaffene, som har automatikk.
- AV-overgangen (Junctional Rhythm): Det er en vanlig misforståelse at selve den kompakte atrioventrikulærknuten har automatikk. Det er cellene i overgangssonen rundt knuten og i den proksimale delen av His-bunten som har pacemakeregenskaper. En erstatningsrytme herfra har typisk en frekvens på 40–60 slag per minutt og gir smale QRS-komplekser (hvis ledningssystemet distalt er intakt).
- His-Purkinje-nettverket: Ventrikulære erstatningsrytmer oppstår i His-bunten eller Purkinje-nettverket. Disse cellene har langsommere automatikk, typisk 20–40 slag per minutt. Rytmer som oppstår distalt i Purkinje-fibrene gir brede QRS-komplekser og er ofte hemodynamisk ustabile.
Hjertet har altså flere potensielle pacemakere. Fenomenet der den raskeste pacemakeren (normalt sinusknuten) undertrykker de andre kalles «overdrive suppression». Hjerterytmen styres av den raskeste pacemakeren fordi denne depolariserer og nullstiller membranpotensialet til de latente pacemakerne før disse rekker å nå sin terskelverdi spontant.
Den iboende depolarisasjonshastigheten til alle pacemakerceller er vist i figur 3.
Indikasjoner for kunstige pacemakere
Hvis sinusknuten ikke genererer impulser, eller hvis det elektriske ledningssystemet ikke overfører impulser, kan det føre til symptomatisk bradykardi eller asystoli. Latente pacemakere forhindrer vanligvis asystoli ved å etablere en erstatningsrytme («escape rhythm»). Selv om slike rytmer kan være livreddende, har de to grunnleggende svakheter:
- Erstatningsrytmer fra lavere deler av ledningssystemet har en lavere frekvens, noe som betyr at hjertets minuttvolum reduseres, ofte til et nivå som ikke er forenlig med fysisk aktivitet.
- Latente pacemakere er upålitelige på lang sikt; aktiviteten kan opphøre plutselig eller ikke øke tilstrekkelig ved stress, noe som resulterer i asystoli eller synkope.
Kunstige pacemakere er indisert hvis impulsdannelsen eller impulsoverledningen er defekt på en irreversibel måte, eller hvis en nødvendig medikamentell behandling forårsaker bradykardi. De vanligste kliniske diagnosene er:
- Syk sinusknute-syndrom (SND): Omfatter sinusbradykardi, sinusarrest, SA-blokk og taky-brady-syndrom. En viktig undergruppe er pasienter med kronotrop inkompetanse, som ikke klarer å øke pulsen tilstrekkelig ved fysisk anstrengelse.
- Atrioventrikulært blokk (AV-blokk): Brudd i ledningen mellom atrier og ventrikler.
Selv om slagvolumet øker noe under bradykardi (på grunn av økt fyllingstid/preload i henhold til Frank-Starling-loven), kompenserer dette sjelden fullt ut for den lave frekvensen. Dette fører til redusert hjerteminuttvolum. Symptomer inkluderer svimmelhet, presynkope eller synkope (Adams-Stokes anfall). Ved moderat reduksjon i minuttvolum kan pasienten oppleve dyspné, tretthet, anstrengelsesintoleranse eller forverring av hjertesvikt.
Fra et klinisk perspektiv haster det mest med håndteringen hvis bradykardien skyldes høygradig AV-blokk (Mobitz type II, tredjegrads blokk), da erstatningsrytmen her ofte er langsom og upålitelig, med høy risiko for asystoli.
Intrinsisk hjerteautomatikk: Pacemakerpotensial
Automatikken i sinusknutens celler er resultatet av en unik elektrofysiologisk egenskap: ustabilt hvilemembranpotensial. I motsetning til vanlige muskelceller som ligger stabilt på ca -90 mV, begynner pacemakercellene å depolarisere langsomt så snart den forrige repolariseringen er ferdig (fase 4). Denne spontane diastoliske depolariseringen kalles pacemakerpotensialet.
Mekanismen drives primært av den såkalte «Funny current» ($I_f$), en innadgående strøm av blandede kationer (mest natrium) som aktiveres ved hyperpolarisering (når cellen er negativ). Etter hvert som natrium lekker inn via $I_f$-kanalene, blir cellemembranen gradvis mer positiv. Når membranpotensialet når terskelen på ca -40 mV, utløses aksjonspotensialet. Ved -40 mV åpnes spenningsstyrte L-type kalsiumkanaler ($I_{Ca,L}$), slik at kalsium strømmer raskt inn og skaper fase 0 (depolarisering). Deretter åpnes utadrettede kaliumkanaler, noe som fører til repolarisering av cellen (fase 3). Syklusen gjentar seg deretter automatisk. Dette illustreres i figur 4.
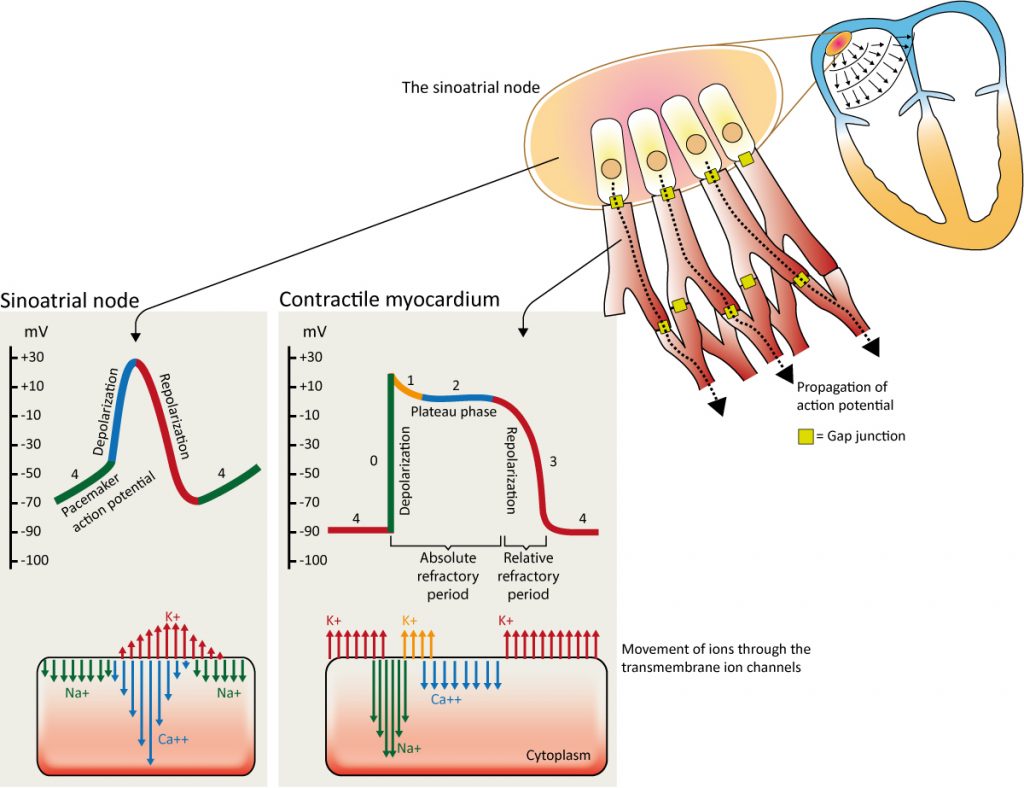
Depolariseringen sprer seg fra sinusknuten til atrie- og ventrikkelmyokard. Spredning av aksjonspotensialet er mulig fordi alle hjertecellene er elektrisk sammenkoblet med gap junctions (kanalsoner), som består av proteiner kalt connexiner. Tettheten og typen connexiner avgjør ledningshastigheten. I Purkinje-nettverket er tettheten svært høy, noe som forklarer den raske impulsoverføringen. Cellene i atrioventrikulærknuten har derimot færre gap junctions og en arkitektur som forsinker impulsen. Dette er fysiologisk viktig for å beskytte ventriklene mot for raske atriale rytmer (f.eks. atrieflimmer).
De kontraktile cellene har, i motsetning til cellene i sinoatrialknuten, et ekte, stabilt hvilepotensial (fase 4) på rundt -90 mV. Disse cellene må stimuleres av en nabocelle eller en pacemaker for å nå terskelverdien og utløse et aksjonspotensial. Ved stimulering åpner raske natriumkanaler ($I_{Na}$) seg, noe som fører til en massiv innstrømning av natrium og depolariserer cellen nesten øyeblikkelig. Kontraktile celler begynner å trekke seg sammen noen millisekunder etter at depolariseringen har startet, og avslapningsfasen inntrer når kalsium pumpes tilbake i sarkoplasmatisk retikulum.
Les mer om dette: Hjertets elektrofysiologi: aksjonspotensial, automatikk og vektorer
Absolutte og relative refraktærperioder under aksjonspotensialet
Under størstedelen av aksjonspotensialet er myokardcellen absolutt refraktær for stimulering. Dette betyr at natriumkanalene er inaktiverte, og en ytterligere stimulus kan ikke utløse et nytt aksjonspotensial, uansett stimulusens intensitet. Dette beskytter hjertet mot tetanisk (vedvarende) kontraksjon, som ville stanset pumpefunksjonen. Den absolutte refraktærperioden etterfølges av en relativ refraktærperiode, der en kraftigere stimulering enn normalt kan utløse et nytt, men ofte forkortet og langsommere aksjonspotensial.
Slutten av den relative refraktærperioden kalles ofte den vulnerable perioden (sammenfallende med toppen av T-bølgen på EKG). Et elektrisk støt eller feil-timet pacemakerstimulus her kan utløse ventrikkelflimmer («R-på-T fenomen»). Pacemakere er programmert med refraktærperioder for å unngå å sanse T-bølger eller utløse impulser i denne sårbare fasen. De absolutte og relative refraktærperiodene er vist i figur 5.
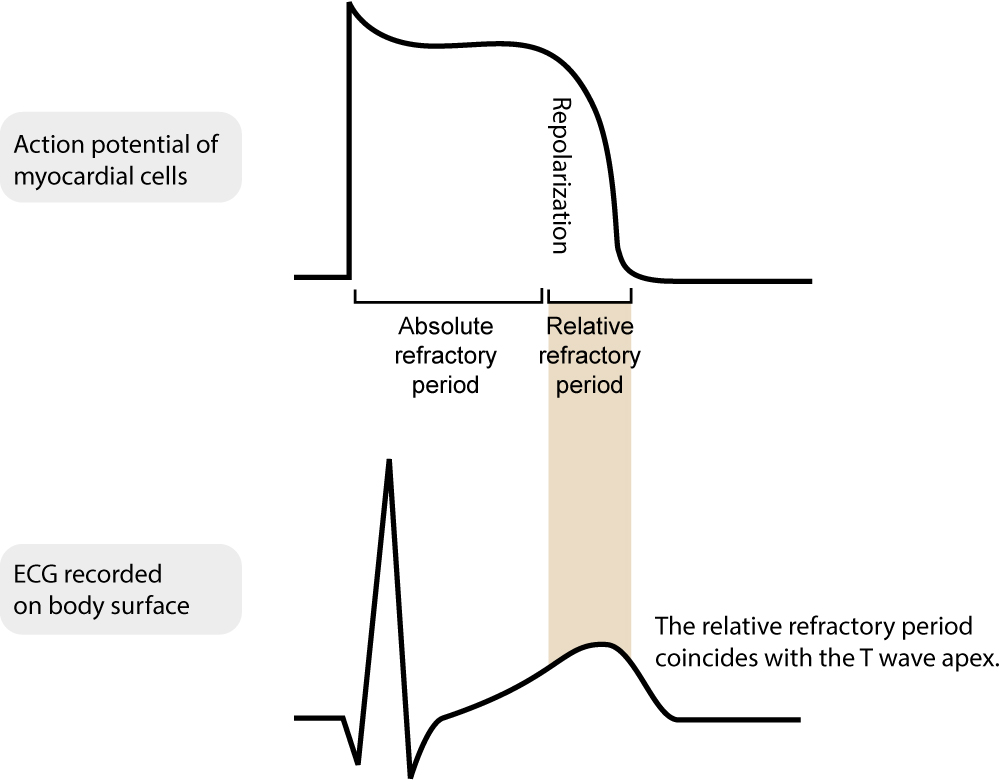
Biofysikk ved pacing: Stimuleringsterskel
For at en kunstig pacemaker skal kunne overta hjertets rytme, må den levere en elektrisk impuls som er sterk nok til å depolarisere myokardcellene rundt elektrodespissen til terskelverdien (ca -40 mV). Når disse cellene depolariseres, sprer aktiveringen seg videre til resten av hjertet. Den minste energimengden som kreves for konsekvent å oppnå aktivering («capture»), kalles stimuleringsterskelen.
Terskelen avhenger av to faktorer i impulsen: amplitude (spenning i volt) og varighet (pulsbredde i millisekunder). Forholdet mellom disse beskrives av styrke-varighets-kurven. Kortvarige impulser krever høyere spenning, mens lengre impulser krever lavere spenning. For å spare batteri og samtidig ivareta pasientsikkerheten, programmeres pacemakeren vanligvis med en sikkerhetsmargin – typisk 2–3 ganger målt terskelverdi i spenning. Moderne pacemakere måler terskelen automatisk («capture management») og justerer utgangen daglig for å optimalisere levetiden.
Prinsipper for kunstige pacemakere
Moderne pacemakere er ekstremt sofistikerte datamaskiner. De kan erstatte både impulsdannelse og impulsledning ved å stimulere høyre atrium, høyre ventrikkel, eller begge (to-kammersystem). De grunnleggende funksjonene inkluderer:
- Sensing: Evnen til å «se» hjertets egen elektriske aktivitet. Hvis pasienten har egenrytme, vil pacemakeren holde tilbake sin impuls (inhibering) for å unngå konkurranse med hjertet.
- Pacing: Levering av elektrisk impuls når ingen egenrytme oppdages innen et gitt tidsintervall.
- Frekvensrespons: Ved hjelp av sensorer (f.eks. akselerometer som måler bevegelse, eller impedansmåling som reflekterer respirasjon) kan pacemakeren øke hjertefrekvensen under fysisk aktivitet hos pasienter med kronotrop inkompetanse.
Moderne enheter kan også oppdage og behandle takyarytmier, samt lagre detaljert diagnostisk data om arytmibyrde (f.eks. atrieflimmer) og fysiologisk status. Disse temaene, samt NBG-kodesystemet for pacemakerinnstillinger, vil bli diskutert i detalj i senere kapitler.
Referanser
Reynolds et al. A Leadless Intracardiac Transcatheter Pacing System. The New England Journal of Medicine.
Mulpuru et al. Cardiac Pacemakers: Function, Troubleshooting, and Management. JACC.
Glikson M et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. European Heart Journal.