Forholdet mellom ventrikkeltrykk og ventrikkelvolum: Forspenning, etterbelastning, slagvolum, veggspenning og Frank-Starlings lov
Forholdet mellom ventrikulært trykk og volum
Forholdet mellom trykk og volum i venstre ventrikkel er gullstandarden for å vurdere ventrikkelens hemodynamiske egenskaper. Dette kan beskrives ved hjelp av et sløyfediagram (PV-loop) med volumet avbildet på x-aksen og trykket i venstre ventrikkel på y-aksen. Hvis trykk og volum i venstre ventrikkel måles kontinuerlig i løpet av en enkelt hjertesyklus – typisk ved hjelp av konduktanskateter under invasiv utredning – får man sløyfediagrammet som er vist i figur 1. Arealet av denne sløyfen representerer det eksterne arbeidet hjertet utfører i det gjeldende slaget.
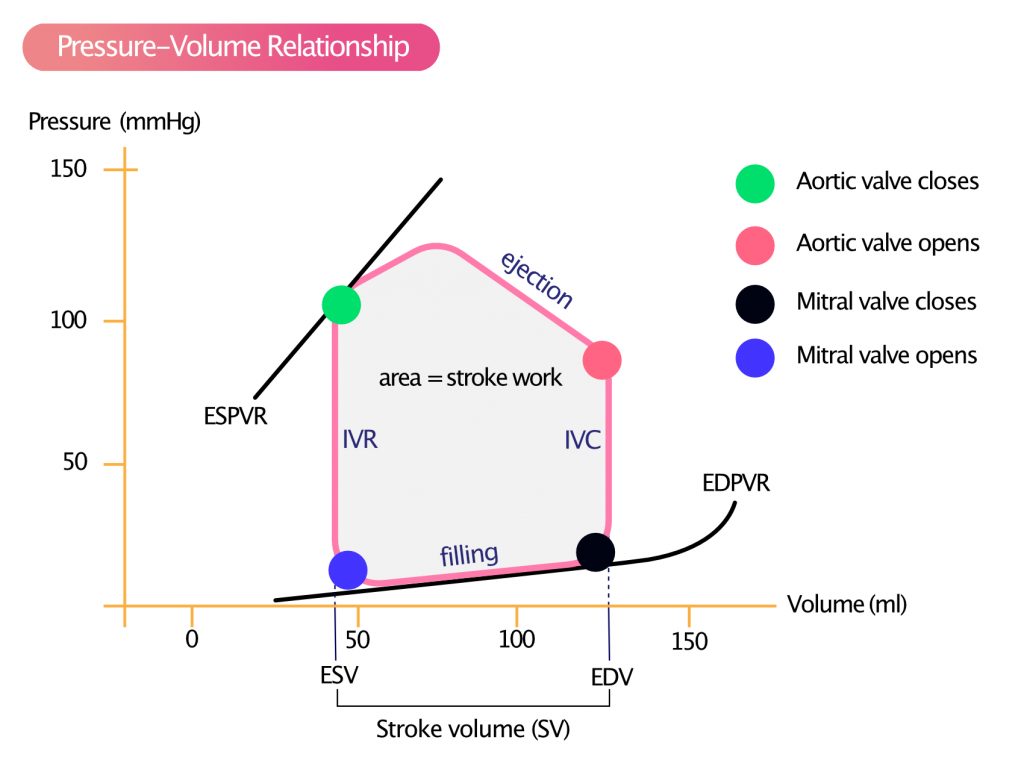
I figur 1 begynner vi i diastole, i det øyeblikket mitralklaffen åpner seg. Når mitralklaffen åpner seg (fordi ventrikkeltrykket faller under atrietrykket), strømmer blod fra venstre atrium og inn i venstre ventrikkel. Dette fører til en rask økning i venstre ventrikkels volum. I en frisk ventrikkel medfører denne volumøkningen bare en liten økning i trykket i venstre ventrikkel. Dette fenomenet forklares med at venstre ventrikkel er i stand til å slappe av aktivt og utvide seg raskt under diastolen.
Begrepet compliance (etterlevelighet) brukes for å beskrive venstre ventrikkels evne til å la seg fylle under diastolen uten betydelig trykkstigning ($dV/dP$). Compliance er en fundamental komponent av diastolisk funksjon. Høy compliance er fysiologisk ønskelig og betyr at ventrikkelen er i stand til å fylle seg raskt samtidig som den opererer ved lavt sluttdiastolisk trykk (LVEDP), noe som sikrer lavt trykk bakover i lungekretsløpet. Redusert compliance ses typisk ved venstre ventrikkelhypertrofi, iskemi eller restriktiv kardiomyopati, og er en sentral mekanisme ved hjertesvikt med bevart ejeksjonsfraksjon (HFpEF).
EDV (endediastolisk volum) betegner volumet i venstre ventrikkel rett før sammentrekningen starter (preloads volumkomponent). Trykket i venstre ventrikkel øker idet den elektriske aktiveringen initierer myokardkontraksjon. Når trykket i venstre ventrikkel overstiger trykket i venstre atrium, lukker mitralklaffen seg. Fra dette punktet øker trykket i venstre ventrikkel svært raskt mens både aortaklaffen og mitralklaffen er lukket (konstant volum). Denne fasen kalles isovolumetrisk kontraksjon (IVC; figur 1 og 2). Dette er den mest energikrevende fasen av hjertesyklusen, da myokardiet genererer veggspenning uten forkortning av fibrene.
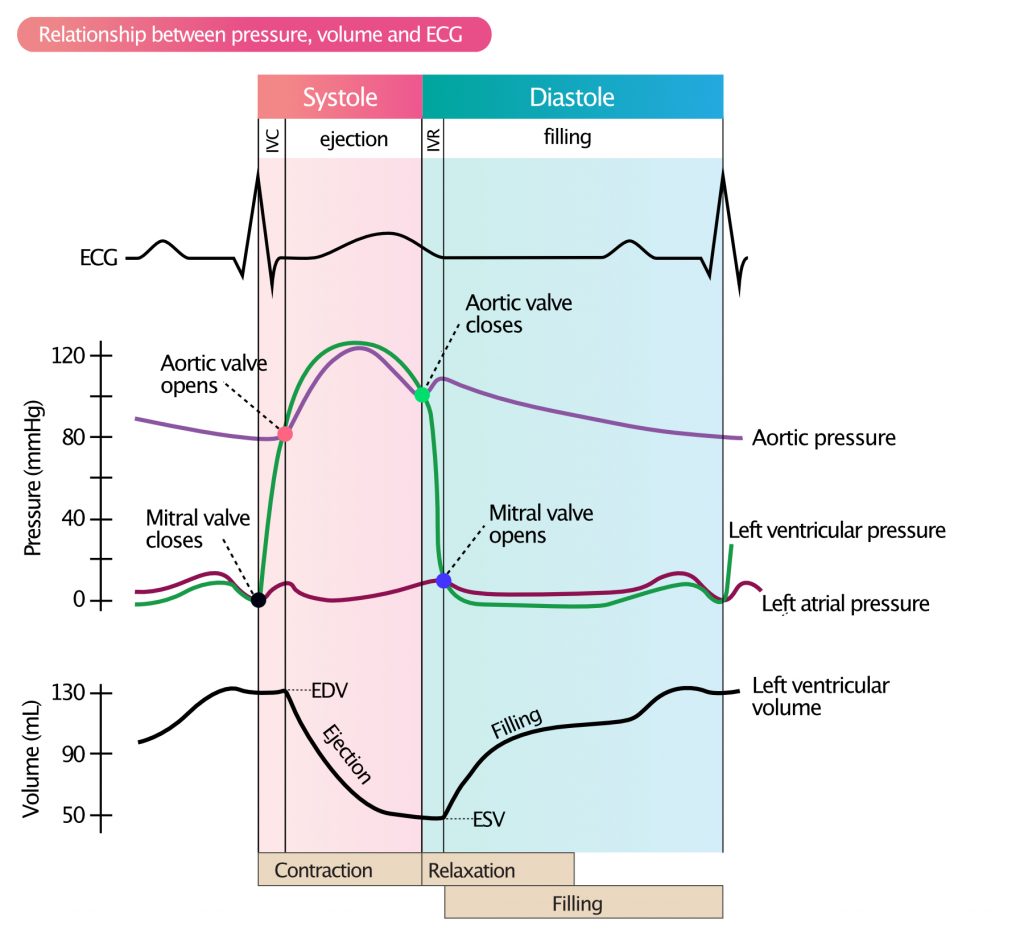
Når trykket i venstre ventrikkel overstiger det diastoliske trykket i aorta, åpner aortaklaffen seg, og ejeksjonsfasen starter hvor blod presses ut i aorta. Volumet i venstre ventrikkel avtar etter hvert som ventrikkelen trekker seg sammen. Etter at maksimalt trykk er nådd, reduseres utstrømmingshastigheten, og ventrikkelen begynner repolariseringsfasen. Dette fører til redusert trykk i venstre ventrikkel. Aortaklaffen lukker seg når aortatrykket overstiger trykket i venstre ventrikkel (dette markerer slutten på systolen og danner «incisura» eller «dicrotic notch» på aortatrykkskurven).
ESV (endesystolisk volum) er definert som venstre ventrikkels volum ved lukking av aortaklaffen. Når aortaklaffen lukkes, slapper ventrikkelen av, og trykket faller raskt, uten at volumet endres nevneverdig. Denne fasen kalles isovolumetrisk relaksasjon (IVR; figur 1 og 2). Det er viktig å merke seg at relaksasjon er en energikrevende prosess som krever ATP for å pumpe kalsium tilbake til sarkoplasmatisk retikulum. Når ventrikkeltrykket faller til et nivå lavere enn trykket i venstre atrium, åpner mitralklaffen seg, og syklusen gjentas.
Slagvolum (SV) og slagarbeid (SW)
Slagvolumet (SV) er definert som differansen mellom ESV og EDV, som tilsvarer bredden på sløyfen i figur 1. Arealet innenfor sløyfen er slagarbeidet (SW), som representerer det mekaniske arbeidet ventrikkelen utfører per slag.
Trykk-volum-sløyfen i figur 1 er ikke statisk; den endres dynamisk basert på fysiologiske betingelser. Den begrenses av to definerte linjer: EDPVR og ESPVR.
EDPVR (End-Diastolic Pressure-Volume Relationship) viser forholdet mellom trykk og volum ved slutten av diastolen over et spekter av fyllingsgrader. EDPVR-kurven er eksponentiell og reflekterer ventrikkelens passive stivhet. Kurven viser at venstre ventrikkel tåler fylling opp til et visst punkt med minimal trykkøkning, men ved en viss terskel stiger trykket bratt ved ytterligere volumøkninger. Dette forklares med at det finnes en øvre grense for perikardets og cytoskjelettets ettergivelighet. Jo større venstre ventrikkels ettergivelighet (compliance) er, desto flatere (mindre bratt) blir EDPVR-kurvens helning. Ved redusert compliance (f.eks. ved fibrose) skifter kurven oppover og til venstre.
ESPVR (End-Systolic Pressure-Volume Relationship) representerer den maksimale trykk-volum-relasjonen ved slutten av systolen og er tilnærmet lineær. Helningen på ESPVR-linjen kalles endsystolisk elastans ($E_{es}$) og er et robust mål på venstre ventrikkels inotropi (kontraktilitet), som er tilnærmet uavhengig av loading-forhold. Jo brattere helning på ESPVR, desto høyere kontraktilitet. Ved akutt hjertesvikt eller kardiomyopati vil helningen avta (bli flatere), noe som indikerer at ventrikkelen ikke klarer å generere like høyt trykk for et gitt volum.
Ved hjelp av todimensjonal (2D) og tredimensjonal (3D) ekkokardiografi kan man beregne slagvolumet nøyaktig. En vesentlig begrensning med å bruke slagvolum isolert som mål på venstre ventrikkels funksjon, er at det er sterkt avhengig av loading-forhold (preload og afterload). Dette fremgår tydelig av figur 1, som viser at slagvolumet er differansen mellom ESV og EDV. En pasient med alvorlig dilatert kardiomyopati (DCM) kan opprettholde et normalt slagvolum simpelthen på grunn av et svært stort endediastolisk volum (EDV), til tross for at ejeksjonsfraksjonen (EF) er betydelig redusert og kontraktiliteten (ESPVR) er flat.
Slagarbeid (SW) og Myokardielt Oksygenforbruk
I fysikken tilsvarer arbeid produktet av kraft (f) og avstand (d). For hjertet, som pumper en væske, er arbeidet integralet av trykk med hensyn til volum. Slagarbeid (SW) er det eksterne arbeidet som utføres for å flytte blod fra ventrikkelen til aorta mot en motstand.
Slagarbeid representeres grafisk av arealet innenfor trykk-volum-sløyfen i figur 1. In vivo-måling av slagarbeid krever kontinuerlig måling av ventrikkeltrykk og -volum, noe som vanligvis krever invasive metoder. I klinisk praksis kan slagarbeid tilnærmes som produktet av slagvolum og gjennomsnittlig arterietrykk (MAP), selv om dette ignorerer de oscillerende komponentene av arbeidet og arbeidet utført i de isovolumetriske fasene.
Totalt energiforbruk i hjertet korrelerer sterkt med trykk-volum-arealet (PVA). PVA er summen av det eksterne slagarbeidet (arealet i loopen) og den potensielle energien som er lagret i myokardiet ved slutten av systolen (arealet trekantet avgrenset av ESPVR, EDPVR og den systoliske delen av loopen). Dette konseptet er viktig fordi det forklarer hvorfor økt afterload (høyt blodtrykk) øker myokardiets oksygenforbruk ($MVO_2$) betydelig mer enn en tilsvarende økning i slagvolum.
Hjertets arbeid
Hjertearbeid (Cardiac Work, CW) per minutt er produktet av hjertefrekvens (HR) og slagarbeid (SW). Dette gir et mål på effekten hjertet yter:
CW = HR · SW
(SW ≈ SV · MAP)
Økt hjertefrekvens øker hjertets arbeid per minutt lineært, men øker også oksygenforbruket betydelig siden antallet isovolumetriske kontraksjoner (som er energikrevende) øker.
Frank-Starlings lov (mekanisme)
Frank-Starlings lov beskriver hjertets evne til å endre sin kontraktionskraft og dermed slagvolum som respons på endringer i venøs retur (preload). Et klassisk eksempel er stillingsendring: Slagvolumet er større i liggende stilling sammenlignet med oppreist stilling. Dette skyldes at tyngdekraftens effekt på venene opphører, og den venøse returen til hjertet øker. Mer blod strømmer tilbake til hjertet, noe som fører til økt ventrikkelfylling og dermed økt EDV. Venstre ventrikkel reagerer på denne økningen i EDV (strekk) ved automatisk å øke slagvolumet.
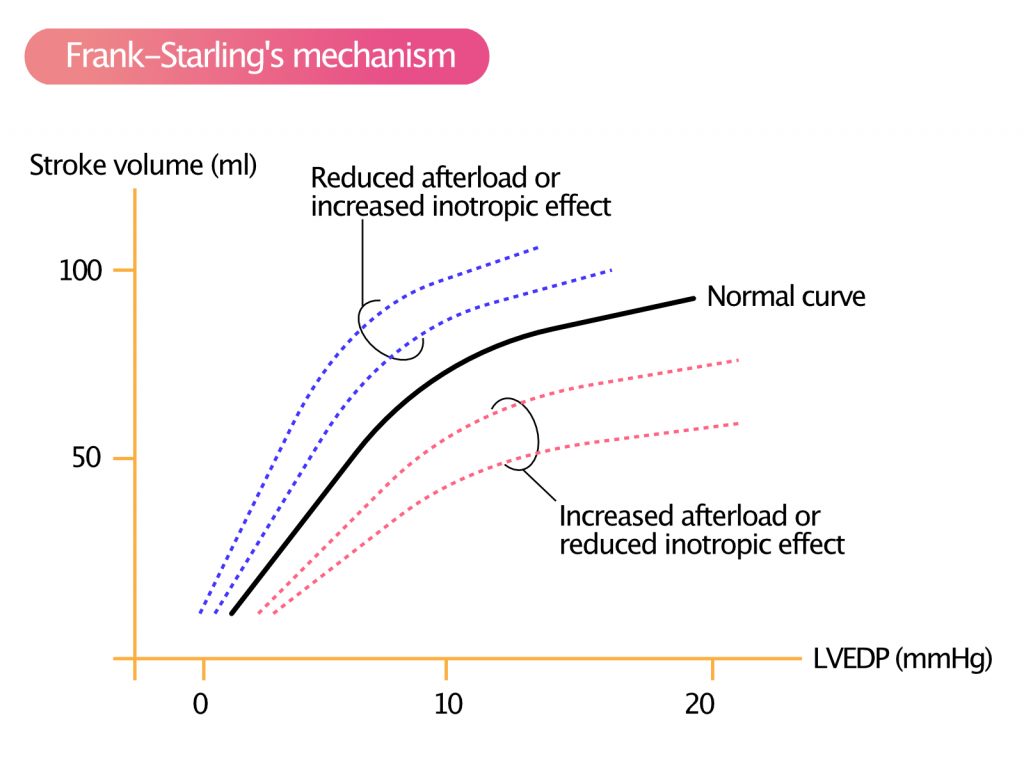
Frank og Starling oppdaget at en økning i venstre ventrikkels endediastoliske trykk (LVEDP) eller volum fører til kraftigere sammentrekninger og større slagvolum, inntil et visst fysiologisk tak. Denne mekanismen er intrinsisk til myocyttene og uavhengig av nevrohumorale stimuli, selv om sympatikusaktivering kan forskyve kurven oppover (økt inotropi). Som det fremgår av figur 3, modifiseres Frank-Starling-kurven av etterbelastning og inotropi i myokardiet. Ved hjertesvikt er kurven flatere; dette betyr at en økning i preload gir minimal økning i slagvolum, men en betydelig økning i lungestuvning (LVEDP).
En cellulær mekanisme kjent som lengde-avhengig aktivering forklarer Frank-Starlings mekanisme. Når ventrikkelfyllingen øker, strekkes myokardfibrene og deres sarkomerer mot en optimal lengde (ca. 2,2 µm). Dette fører til at troponin C blir mer følsomt for kalsium og at det blir en optimal overlapp mellom aktin- og myosinfilamenter. Dette akselererer dannelsen av kryssbroer og gir mer kraft.
Forskjellen mellom kontraktilitet og kontraktil funksjon
I klinisk dagligtale brukes begrepene ofte om hverandre, men fysiologisk er det en distinkt forskjell mellom kontraktilitet og kontraktil funksjon.
Kontraktilitet (Inotropi) beskriver myokardiets iboende evne til å trekke seg sammen, uavhengig av for- og etterbelastning. Det er en egenskap ved selve hjertemuskelcellen, påvirket av kalsiumhåndtering og beta-adrenerg stimulering. Gullstandarden for å måle dette er helningen på ESPVR ($E_{es}$) fra trykk-volum-loops. Andre indekser inkluderer $dP/dt_{max}$ (maksimal trykkstigningshastighet under isovolumetrisk kontraksjon).
Kontraktil funksjon (Pumpefunksjon) beskriver myokardiets evne til å pumpe blod i en gitt hemodynamisk tilstand. Dette resultatet er avhengig av tre faktorer: kontraktilitet, preload og afterload. Pumpefunksjon måles klinisk ofte som ejeksjonsfraksjon (LVEF) eller slagvolum. Det er viktig å forstå at LVEF kan endres kun ved å endre afterload (f.eks. blodtrykksbehandling), uten at hjertets iboende kontraktilitet er endret.
Ventrikulo-arteriell kobling
For å forstå hjertets totale effektivitet, må man se på samspillet mellom hjertet og karsystemet, kjent som ventrikulo-arteriell kobling (VA-coupling). Dette forholdet er definert som ratioen mellom arteriell elastans ($E_a$, et mål på total etterbelastning) og ventrikulær elastans ($E_{es}$, kontraktilitet).
Optimal mekanisk effektivitet (overføring av energi fra myokard til blodstrøm) oppstår når $E_a / E_{es}$ er nær 1 (eller litt lavere, rundt 0.7 for optimal metabolsk effektivitet). Ved hjertesvikt kan denne balansen forstyrres («uncoupling»), hvor hjertet bruker uforholdsmessig mye energi for å opprettholde trykk fremfor flow. Behandling av hjertesvikt (f.eks. ACE-hemmere) sikte ofte på å redusere $E_a$ for å gjenopprette gunstig kobling.
Forbelastning (Preload)
Forspenning er den kraften eller lasten som tøyer myokardfibrene ved slutten av diastolen, rett før kontraksjonen starter. Strekkingen kan beskrives ved hjelp av surrogatmål som endediastolisk trykk (LVEDP), endediastolisk volum (LVEDV) eller endediastolisk diameter.
Klinisk er LVEDP (ofte estimert via PCWP – lungekapillært innkilingstrykk) mye brukt, men forholdet mellom trykk og volum er ikke lineært (se avsnittet om compliance). Derfor er endediastolisk volum eller, enda mer presist, endediastolisk veggspenning det mest korrekte målet på preload, da dette reflekterer den faktiske strekken på sarkomerene.
Forspenningsreserven er en viktig parameter for arbeidskapasitet. Den angir hvor mye ventrikkelen kan øke sitt slagvolum ved ytterligere fylling. En ventrikkel med stor forspenningsreserve kan ta imot et større blodvolum og øke slagvolumet via Frank-Starling-mekanismen. I oppreist stilling har friske personer en stor reserve. Ved hjertesvikt er ventrikkelen ofte overfylt og opererer på den flate delen av Starling-kurven, hvor ytterligere volum (preload) hovedsakelig gir økt trykk og stuvning, uten vesentlig økning i slagvolum.
Etterbelastning (Afterload)
Afterload er den motstanden eller «lasten» myokardiet må arbeide mot for å ejektere blod under systolen. Fysiologisk er dette veggspenningen i venstre ventrikkel under utdrivningsfasen. Klinisk tilnærmes afterload ofte ved systemisk vaskulær motstand (SVR) eller aortatrykk, men dette er forenklinger.
Afterload bestemmes av:
- Systemisk vaskulær motstand (arteriolær tonus).
- Aorta-compliance (hvor stiv aorta er).
- Reflekterte bølger fra periferien.
- Ventrikkelens geometri (radius og veggtykkelse, jfr. Laplace lov).
Personer med kronisk høyt blodtrykk eller aortastenose (høy etterbelastning) utvikler ofte kompensatorisk konsentrisk hypertrofi. Ved å øke veggtykkelsen reduseres veggspenningen per myocytt (normalisering av afterload), men dette kan over tid gå på bekostning av diastolisk funksjon.
Veggspenning og Laplace lov
Veggspenning ($σ$) er den kraften som virker per tverrsnittsareal av myokardveggen. Ifølge Laplaces lov for en sfære (som er en forenklet modell av venstre ventrikkel), er veggspenningen proporsjonal med trykk og radius, og omvendt proporsjonal med veggtykkelse:
σ = (p · r) / (2 · t)
p = transmuralt trykk; r = ventrikkelradius; t = veggtykkelse.
Denne formelen har store kliniske implikasjoner:
- Dilatert hjerte: Når ventrikkelen dilaterer (økt radius $r$), øker veggspenningen dramatisk hvis trykket er konstant. Dette øker oksygenbehovet ($MVO_2$) og kan indusere videre skade og dilatasjon («ond sirkel»).
- Hypertrofi: Ved trykkbelastning (økt $p$) kompenserer hjertet ved å øke veggtykkelsen ($t$). Dette holder nevneren i brøken større, og bidrar til å holde veggspenningen ($σ$) innenfor normalområdet.
Transmuralt trykk (p) er differansen mellom intraventrikulært trykk og intrathorakalt trykk, men tilnærmes i praksis ofte som det systoliske ventrikkeltrykket.