Tromboembolisme i hjertet
Tromboembolisme representerer en betydelig global helseutfordring og er en av de ledende dødsårsakene på verdensbasis (1). Kardiale embolier, som har sitt utspring i atriene, venstre aurikkel (LAA – Left Atrial Appendage), ventriklene, hjerteklaffene eller proksimale aorta, kan føre til alvorlige komplikasjoner som hjerneslag, TIA (transitorisk iskemisk anfall), akutt koronararterieokklusjon og perifer arteriell embolisering. Hjerneslag er den tredje hyppigste dødsårsaken i vestlige land, og en stor andel av disse tilfellene har kardial etiologi. Rutinemessig utredning med ekkokardiografi og ultralyd av halskar er derfor standard prosedyre for de fleste pasienter med akutt iskemisk cerebrovaskulær sykdom. Formålet er å identifisere potensielle embolikilder som aterosklerotiske plakk, intrakardielle tromber, vegetasjoner eller intrakardielle shunter.
Hjerneslag klassifiseres patofysiologisk i hemoragisk (ca. 13 % av tilfellene) og iskemisk (ca. 87 % av tilfellene). Begrepene hemoragisk hjerneslag og intracerebral blødning benyttes ofte om hverandre, der blødningen oppstår direkte i hjerneparenkymet, hyppigst forårsaket av dårlig regulert hypertensjon eller cerebral amyloid angiopati. Iskemisk hjerneslag skyldes okklusjon av en hjernearterie, enten grunnet lokal aterotrombose eller embolisering fra en proksimal kilde. Det estimeres at omtrent 30 % av alle iskemiske hjerneslag er kardioemboliske. Dette tallet kan være høyere hvis man inkluderer kryptogene hjerneslag hvor man mistenker, men ikke har påvist, paroksysmal atrieflimmer eller paradoksal embolisering via persisterende foramen ovale (PFO).
Hjerneslag og TIA (transitorisk iskemisk anfall)
Iskemisk hjerneslag deles etiologisk inn i ulike underkategorier (ofte basert på TOAST-klassifikasjonen):
- Lakunært hjerneslag eller lakunært infarkt (småkarsykdom): Dette skyldes okklusjon av små, penetrerende arterioler som forsyner dype cerebrale strukturer (basalganglier, capsula interna, hjernestamme). Tilstanden er sterkt assosiert med hypertensjon og diabetes. Lakunære syndromer inkluderer:
- (1) rent motorisk utfall/hemiparese
- (2) ataktisk hemiparese
- (3) dysartri/klosset hånd-syndrom
- (4) rent sensorisk utfall
- (5) blandet sensorimotorisk utfall.
- Kardioembolisk hjerneslag: Okklusjon av større cerebrale arterier forårsaket av embolus fra hjertet, oftest assosiert med atrieflimmer.
- Storkarsykdom (aterosklerose): Embolisering fra eller trombose i store ekstrakranielle eller intrakranielle arterier (f.eks. carotisstenose).
- Kryptogent hjerneslag: Hjerneslag uten påvisbar årsak etter standard utredning. En undergruppe her er ESUS (Embolic Stroke of Undetermined Source).
- Paradoksal emboli: Embolisk materiale fra venesiden (f.eks. DVT) krysser til arteriesiden via en intrakardiell shunt, oftest et persisterende foramen ovale (PFO) eller en atrieseptumdefekt (ASD).
Ekkokardiografi er hjørnesteinen i utredningen av kardioembolisk og kryptogent hjerneslag, samt ved mistanke om aortisk patologi.
Kardioemboli er årsaken til minst 30 % av alle iskemiske hjerneslag, og andelen øker med alder grunnet høyere prevalens av atrieflimmer.
Embolisk materiale
Selv om tromber bestående av koagulert blod er hyppigst, kan kardiale embolier bestå av diverse materialer:
- Trombemasser (fibrin, trombocytter, erytrocytter)
- Tumorfragmenter (f.eks. fra myxom eller papillært fibroelastom)
- Infeksiøse vegetasjoner (bakterier, sopp, inflammatoriske celler)
- Ikke-bakterielle trombotiske vegetasjoner (Libman-Sacks, marantisk endokarditt)
- Kalkfragmenter (fra f.eks. aortastenose eller mitralringkalk)
- Ateromatøst debris (kolesterolkrystaller fra aortaplaque)
Embolisk potensial
Risikoen for embolisering varierer betydelig mellom ulike kardiale tilstander. Det er klinisk viktig å skille mellom høyrisikokilder (som krever antikoagulasjon eller intervensjon) og lavrisikokilder. Tabell 1 gir en oversikt over denne risikostratifiseringen.
| TABELL 1. KILDER TIL KARDIALE EMBOLIER OG EMBOLISK POTENSIAL |
| HØYT EMBOLISK POTENSIAL |
| Atrielle arytmier – spesielt atrieflimmer og atrieflutter . |
| Iskemisk hjertesykdom – Både akutt hjerteinfarkt (spesielt fremre vegg) og kronisk iskemisk hjertesykdom med aneurismeutvikling. |
| Venstre ventrikkelaneurisme med påvist trombe |
| Dilatert kardiomyopati med sterkt redusert EF |
| Mekaniske klaffeproteser |
| Intrakardielle apparater (pacemaker, ICD, CRT-ledninger) |
| Infeksiøs endokarditt |
| Hjertesvulster (spesielt myxom og fibroelastom) |
| Kompleks aterosklerose i aorta (plakk > 4mm eller mobile komponenter) |
| LAVT ELLER USIKKERT EMBOLISK POTENSIAL |
| SEC (Spontant ekkokardiografisk potensial/Røyk) uten trombe |
| Venstre ventrikkelaneurisme uten synlig trombe |
| Prolaps av mitralklaffen (uten betydelig insuffisiens/myxomatøs) |
| Aortastenose med forkalkning |
| Mitralsykdom med forkalkning (MAC) |
| Fibrintråder (Strands) |
| Gigantiske Lambls utvekster (kan ha moderat risiko ved slag) |
| Septumdefekter – PFO, ASA, ASD (Risiko avhenger av shunt-størrelse og anatomi) |
Ekkokardiografi for undersøkelse av kardiale embolikilder
Ekkokardiografi er den primære bildemodaliteten for å identifisere kardiale embolikilder. Undersøkelsen bør svare på om det foreligger en strukturell eller funksjonell hjertesykdom som kan forklare pasientens iskemiske hendelse. Valg av modalitet – transtorakal (TTE) vs. transøsofageal (TEE) – avhenger av den kliniske problemstillingen.
Transtorakal ekkokardiografi (TTE) er førstevalget og gir god oversikt over venstre ventrikkels funksjon, veggbevegelser (akinesi/aneurisme) og tilstedeværelse av apikale tromber. Ved mistanke om ventrikkeltrombe bør det benyttes ekkokontrast (LVO – Left Ventricular Opacification) for å øke sensitiviteten, da små tromber kan være vanskelige å skille fra trabekler.
Transøsofageal ekkokardiografi (TEE) er indisert når TTE ikke gir konklusive svar, eller når man mistenker patologi i områder som er vanskelige å visualisere transtorakalt. Dette gjelder spesielt:
- Venstre aurikkel (LAA): TEE er gullstandarden for å utelukke tromber i LAA før kardioversjon eller ablasjon.
- Atrieseptum: For detaljert vurdering av PFO og ASD. Her suppleres undersøkelsen ofte med en «bobletest» (agitated saline contrast) med Valsalva-manøver for å påvise høyre-til-venstre-shunt.
- Aorta: For å vurdere aterosklerotiske plakk i aorta ascendens og aortabuen.
- Klaffer: For å se etter små vegetasjoner (endokarditt) eller dysfunksjon ved klaffeproteser.
Moderne TEE-prober inkluderer ofte 3D-teknologi (X-plane), som gir en overlegen anatomisk fremstilling av aurikkelen og mitralklaffen.
Tromboembolisme fra venstre aurikkel (LAA)
Venstre atrium og spesielt venstre aurikkel (LAA – Left Atrial Appendage) er den dominerende kilden til kardiogene embolier. Trombedannelse er sterkt korrelert med atrielle takyarytmier som atrieflimmer og atrieflutter. Det antas at over 90 % av tromber ved ikke-klaffeassosiert atrieflimmer oppstår i aurikkelen. Patofysiologien er knyttet til redusert tømmingshastighet i aurikkelen, som fører til stase og hyperkoagulabilitet.
Morfologi i venstre aurikkel
Anatomien til venstre aurikkel varierer betydelig mellom individer, og morfologien har vist seg å korrelere med risikoen for trombedannelse. Di Biase et al. beskrev fire hovedtyper basert på CT- og MR-studier (3, 4):
- Chicken Wing (Kyllingvinge): Den vanligste formen. Denne morfologien er assosiert med lavere risiko for emboliske hendelser sammenlignet med de andre typene.
- Cactus (Kaktus)
- Windsock (Vindpølse)
- Cauliflower (Blomkål): Denne morfologien, med sin komplekse indre struktur, er assosiert med høyere risiko for stase og trombedannelse.
Kunnskap om morfologi kan være relevant ved planlegging av LAA-lukning (perkutan okklusjon av aurikkelen), som er et alternativ for pasienter med atrieflimmer som ikke tåler peroral antikoagulasjon.
Atrieflimmer og kardioembolisme
Mekanismene bak trombose ved atrieflimmer kan forklares ved Virchows triade:
- Hemodynamiske endringer (Stase): Ved atrieflimmer opphører den mekaniske kontraksjonen i atriet. Dette fører til lav blodstrømningshastighet, spesielt i aurikkelen. Ved TEE kan man måle tømmingshastigheten i LAA (LAA emptying velocity). Hastigheter under 20–40 cm/s er sterkt assosiert med tromberisiko og SEC.
- Endotelskade/dysfunksjon: Strukturell remodellering og dilatasjon av atriet fører til endokardiale forandringer som eksponerer pro-trombotiske faktorer (f.eks. kollagen og von Willebrand-faktor).
- Hyperkoagulabilitet: Systemisk inflammasjon og endrede nivåer av koagulasjonsfaktorer bidrar til en pro-trombotisk tilstand.
Spontan ekkokontrast (SEC), ofte kalt «røyk» på ekkokardiografi, er et visuelt tegn på erytrocytt-aggregering grunnet lav flow. Det graderes ofte fra mild til alvorlig. Når SEC blir svært tett og gelatinøs, kalles det sludge, som regnes som et forstadium til en organisert trombe. En trombe skiller seg fra sludge ved å ha en distinkt vevsstruktur og er synlig gjennom hele hjertesyklusen.
Embolisme og elektrisk kardioversjon
Gjenopprettelse av sinusrytme ved elektrisk eller medikamentell kardioversjon medfører en risiko for embolisering av eksisterende tromber. Mekanismene inkluderer:
- Mekanisk løsrivelse: Når atriell kontraksjon gjenopptas («atrial kick»), kan tromber presses ut av aurikkelen.
- Atriell stunning: Selv etter elektrisk konvertering til sinusrytme, kan den mekaniske funksjonen i atriet og aurikkelen være nedsatt i minutter til uker (stunning). Dette kan paradoksalt nok føre til ny trombedannelse i perioden rett etter kardioversjon hvis pasienten ikke er adekvat antikoagulert.
Kliniske retningslinjer (ESC):
- Ved atrieflimmer med varighet > 48 timer (eller ukjent varighet), må trombe utelukkes før kardioversjon. Dette gjøres enten ved:
- Effektiv antikoagulasjon (DOAK eller Warfarin med INR 2-3) i minst 3 uker før konvertering.
- TEE-veiledet kardioversjon: Hvis TEE utelukker trombe i LAA, kan kardioversjon utføres umiddelbart under dekke av antikoagulasjon.
- Ved varighet < 48 timer er risikoen lavere, men ikke null. Hos pasienter med svært høy risiko (høy CHA2DS2-VASc-score) anbefales ofte antikoagulasjon eller TEE også ved kortere varighet.
Uavhengig av metode, skal antikoagulasjon fortsette i minst 4 uker etter vellykket kardioversjon (eller livslangt basert på slagrisiko).
Ekkokardiografisk vurdering av venstre aurikkel
Ved TEE-undersøkelse av LAA bør man systematisk vurdere:
- Anatomi: Antall lober og morfologi.
- Funksjon: Måling av tømmingshastighet (LAA emptying velocity) med Pulsed Wave (PW) Doppler plassert ved munningen av aurikkelen. Normal hastighet er > 50 cm/s.
- Innhold: Nøye inspeksjon i flere plan (0, 45, 90 og 135 grader) for å se etter SEC, sludge eller trombe. Tromber er oftest lokalisert i tuppen av aurikkelen.
Tromboembolisme fra venstre ventrikkel
Akutt hjerteinfarkt (AMI)
Trombedannelse i venstre ventrikkel (LV-trombe) er en alvorlig komplikasjon til akutt hjerteinfarkt, spesielt ved fremre veggs infarkt (anteriort infarkt) som involverer apex. Selv om forekomsten har sunket i reperfusjons-æraen (PCI), oppstår det fortsatt hos en signifikant andel pasienter med store infarkter.
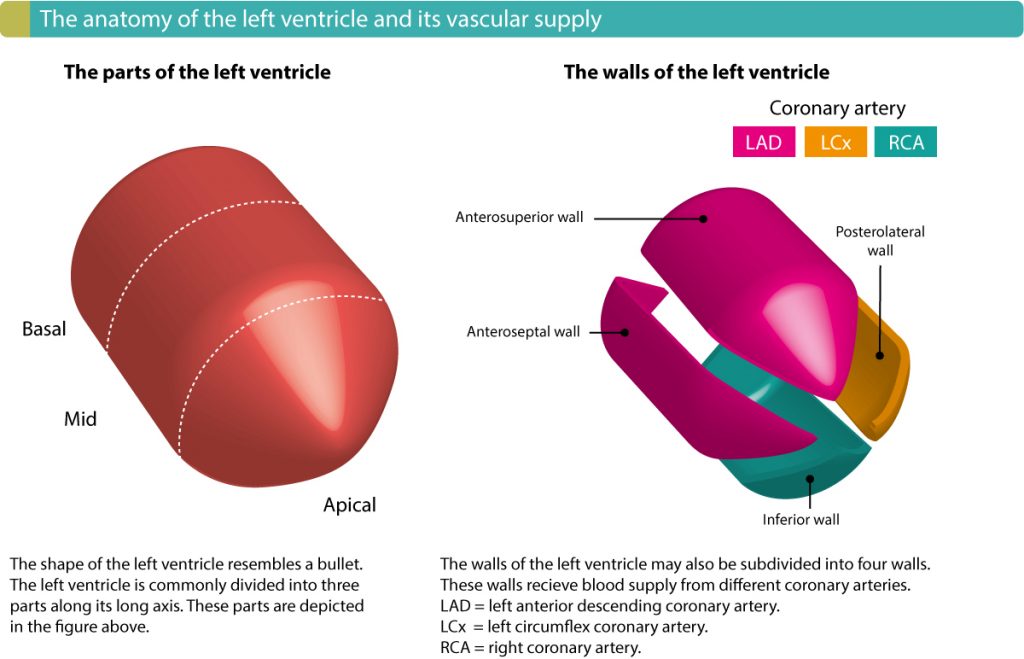
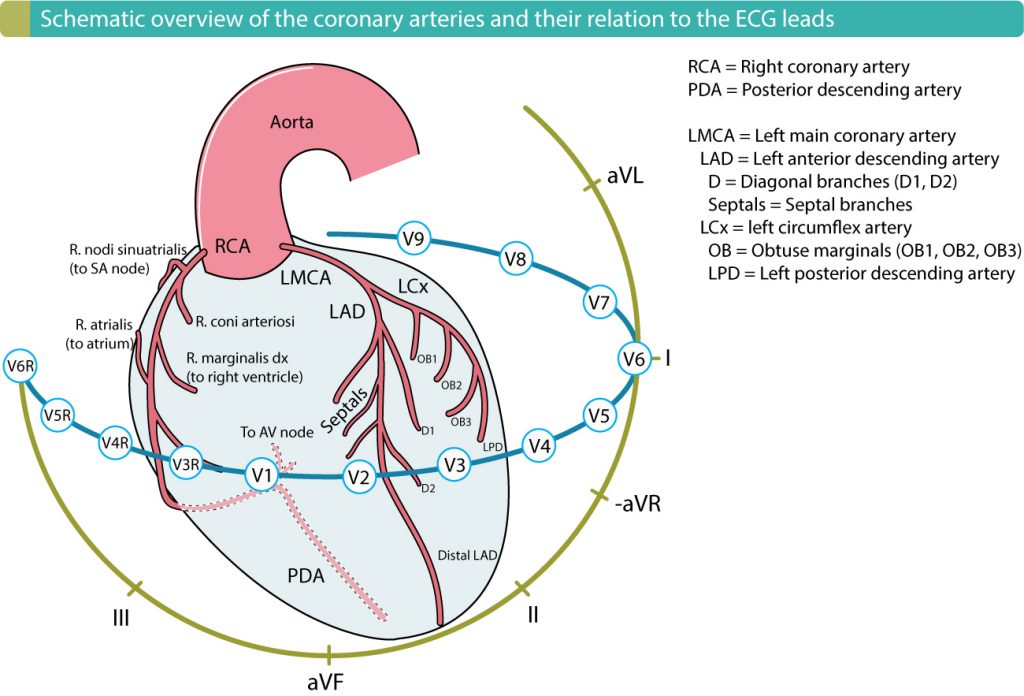
Anbefalt kapittel: Lokalisering av akutt hjerteinfarkt ved hjelp av EKG.
Patofysiologien involverer skade på endokardet (inflammasjon), regional blodstase grunnet akinesi eller dyskinesi (spesielt ved aneurisme) og en hyperkoagulabel tilstand post-infarkt. Tromber dannes typisk innen de første 24-48 timene, men kan oppstå opptil 2 uker etter hendelsen. Aneurismer i venstre ventrikkel representerer en kronisk risiko for trombedannelse.
Risikofaktorer for trombose i venstre ventrikkel (Virchows triade i ventrikkelen):
- Stort anteriort infarkt (LAD-okklusjon).
- Apikal akinesi eller dyskinesi (aneurisme).
- Alvorlig redusert ejeksjonsfraksjon (LVEF < 30-40 %).
- Tilstedeværelse av SEC i ventrikkelen.
Kardiomyopati
Ved dilatert kardiomyopati (DCM) og andre former for hjertesvikt med redusert EF, er risikoen for tromber økt selv uten koronarsykdom. Hypokinesi fører til stase, spesielt i apex. Ved spesifikke tilstander som non-compaction kardiomyopati (LVNC) kan tromber dannes i de dype trabeklene.
Typer tromber i venstre ventrikkel
Morfologien på tromben har betydning for embolirisikoen:
- Mural trombe: Ligger flatt inntil endokardet. Lavere risiko for embolisering, men krever fortsatt behandling. Kan være vanskelig å oppdage uten kontrast.
- Protruderende tromber: Stikker tydelig inn i lumen.
- Mobile tromber: Har en stilk eller bevegelige deler som svinger i blodstrømmen. Disse har svært høy risiko for embolisering og krever aggressiv antikoagulasjon.
Ekkokardiografi for visualisering av tromber i venstre ventrikkel
TTE har god spesifisitet (85–90 %), men varierer i sensitivitet. Det er avgjørende å visualisere apex fra flere vinkler, ofte ved å bruke modifiserte apikale snitt. Tromber fremstår som en ekkotett masse distinkt fra myokardet.
Bruk av ekkokontrast (LVO): Ved dårlig akustisk vindu eller mistanke om apikal patologi, anbefales bruk av ultralydkontrast (f.eks. SonoVue). Kontrasten fyller ventrikkelen, men ikke tromben, slik at tromben fremstår som en «utsparring» i kontrasten. Dette øker sensitiviteten for deteksjon av tromber betydelig. Hvis ekkokardiografi er inkonklusiv, er hjerte-MR (CMR) gullstandarden for diagnostikk.
Kardioembolisme ved hjerteklaffsykdom
Klaffesykdom kan forårsake embolier gjennom flere mekanismer: direkte trombedannelse (spesielt ved mekaniske klaffer eller mitralklaffstenose), løsrivelse av kalk (kalsifiserte embolier) eller via infeksiøse vegetasjoner.
Septisk endokarditt
Ved infeksiøs endokarditt består emboliene av vegetasjoner (bakterier, fibrin, inflammatoriske celler). Embolisering er en hyppig og alvorlig komplikasjon (20–50 % av pasientene). Risikoen er størst ved:
- Store vegetasjoner (> 10 mm).
- Mobile vegetasjoner.
- Infeksjon med Staphylococcus aureus, Candida eller HACEK-gruppen.
- Mitral-lokalisasjon (spesielt fremre seil).
Diagnosen stilles ved hjelp av Duke-kriteriene, hvor ekkokardiografi (ofte TEE) er sentralt.
Aseptisk endokarditt
Libman-Sacks endokarditt (verrukøs endokarditt)
Dette er en steril, inflammatorisk endokarditt assosiert med systemisk lupus erythematosus (SLE) og antifosfolipidsyndrom (APS). Vegetasjonene består av immunkomplekser og fibrineksudater. De kan finnes overalt på klaffen, inkludert på ventrikkelsiden av mitralklaffen (i motsetning til revmatisk sykdom som oftest er på arteriesiden). Selv om de ofte er asymptomatiske, kan de embolisere eller danne grunnlag for påleiring av bakterier (sekundær infeksiøs endokarditt). Pasienter med APS har særlig høy risiko for både arterielle og venøse tromboser.
Marantisk endokarditt (NBTE)
Også kjent som Non-Bacterial Thrombotic Endocarditis (NBTE). Dette er sterkt assosiert med hyperkoagulative tilstander, spesielt avansert kreft (adenokarsinomer i lunge, pancreas, GI-tractus). Vegetasjonene er sprø og løsner lett, noe som gir høy risiko for omfattende embolisering («mange små hjerneslag»).
Strands og Lambls ekskresenser
Dette er tynne, mobile, trådformede strukturer som ofte sees på klaffene hos eldre (degenerativ prosess). Lambls ekskresenser finnes typisk på koaptasjonslinjene til aortaklaffen. Selv om de ser dramatiske ut på TEE, er det omdiskutert hvor stor embolirisikoen egentlig er. I fravær av annen forklaring på et hjerneslag, kan de betraktes som en mulig kilde, men antikoagulasjon er ikke rutinemessig indisert med mindre pasienten har hatt residiverende hendelser.
Forkalkning av mitral annulus (MAC)
Mitralringkalk (Mitral Annular Calcification – MAC) er en vanlig degenerativ prosess, spesielt hos eldre kvinner og pasienter med nyresvikt. Det sees som en kraftig ekkogen struktur i overgangen mellom atriet og ventrikkelen. MAC er ikke bare en markør for generell aterosklerose, men kan direkte forårsake embolier (kalkembolier eller tromber dannet på den ru overflaten). Viktigst er assosiasjonen med atrieflimmer; MAC kan forstyrre ledningssystemet og predisponere for arytmi.
Prostetiske klaffer
Risikoen for trombose avhenger av klaffetype og posisjon:
- Mekaniske klaffer: Krever livslang antikoagulasjon med Warfarin (DOAK er kontraindisert). Trombose kan føre til akutt klaffesvikt (obstruksjon) eller embolisering. TEE og gjennomlysning (fluoroskopi) brukes for å diagnostisere redusert bevegelighet i klaffe-bladene.
- Biologiske klaffer: Har lavere tromboserisiko, men kan rammes av «subklinisk trombose» (HALT – Hypoattenuated Leaflet Thickening) som kan oppdages med CT. Dette behandles ofte med en periode med antikoagulasjon.
Hjertesvulster
Primære hjertesvulster er sjeldne, men viktige differensialdiagnoser ved hjerneslag hos yngre pasienter.
Myxom
Den vanligste benigne hjertesvulsten hos voksne. 75 % er lokalisert i venstre atrium, festet til fossa ovalis via en stilk. De kan bli store og fylle hele atriet, og gir symptomer via tre mekanismer: embolisering (tumorfragmenter eller tromber), obstruksjon av mitralklaffen (synkope/dyspné) og konstitusjonelle symptomer (feber, vekttap grunnet IL-6 produksjon). Behandlingen er kirurgisk eksisjon.
Papillært fibroelastom (PFE)
En liten, benign svulst som ligner en sjøanemone («frond-like»). Den har høy affinitet for hjerteklaffene (aorta > mitral) og sitter ofte på nedstrøms side av klaffen (aortaside av aortaklaffen). På grunn av sin skjøre struktur og overflate, er den svært emboligen. Kirurgisk fjerning anbefales ofte hvis pasienten har hatt symptomer eller hvis tumoren er stor/mobil.
Emboli fra aorta
Ateromatose i aorta ascendens og aortabuen er en viktig årsak til hjerneslag og perifer emboli. Komplekse plakk defineres ved:
- Tykkelse > 4 mm.
- Ulcerasjon.
- Mobile komponenter (trombe/debris).
TEE er den foretrukne metoden for å visualisere disse plakkene, selv om det er en blindsone («blind spot») distalt for aorta ascendens/proksimalt for arcus grunnet luftrøret. Epiaortisk ultralyd under hjertekirurgi er gullstandarden. Behandlingen er primært aggressiv lipidsenkning (statiner) og platehemming.
Paradoksal embolisme
Dette refererer til en embolus som oppstår i venesystemet (DVT), passerer gjennom en intrakardiell shunt (høyre-til-venstre) og havner i systemsirkulasjonen. For at dette skal skje kreves tre elementer: (1) en venøs kilde til trombose, (2) en unormal kommunikasjon (PFO, ASD, VSD eller pulmonal AV-fistel), og (3) en trykkgradient som favoriserer høyre-til-venstre shunt (permanent eller transient, f.eks. ved hoste/Valsalva).
PFO (persisterende foramen ovale)
PFO er en tunnel-lignende kommunikasjon mellom atriene som finnes hos ca. 25 % av befolkningen. Det er ikke en defekt i vevet (som en ASD), men en manglende sammenvoksing av septum primum og septum secundum. Under normale fysiologiske forhold er venstre atrietrykk høyere enn høyre, og klaffen holdes lukket. Ved tilstander som øker høyre atrietrykk (Valsalva, lungeemboli, pulmonal hypertensjon) kan shunten åpne seg.
Diagnostikk: PFO påvises best med TEE kombinert med kontrastvæske (agitated saline/bobletest). Pasienten bes om å utføre Valsalva-manøver når kontrasten når høyre atrium. Positiv test defineres ved at bobler sees i venstre atrium innen 3 hjertesykluser etter at høyre atrium er fylt.
ASA (atrieseptumaneurisme)
ASA defineres som en ekskursjon av septumvevet på > 10 mm (eller totalt > 15 mm) fra midtlinjen under hjertesyklusen. Kombinasjonen av PFO og ASA er assosiert med betydelig høyere risiko for gjentatte hjerneslag enn PFO alene.
Kryptogent hjerneslag og PFO-lukking
Hos pasienter under 60 år med kryptogent hjerneslag (hvor annen årsak er utelukket) og påvist PFO, anbefales nå ofte perkutan lukking av PFO med en paraply-enhet («device closure»). Studier har vist at dette reduserer risikoen for residiv sammenlignet med kun medisinsk behandling. RoPE-score (Risk of Paradoxical Embolism) kan brukes til å sannsynliggjøre om PFOen er årsaken til slaget eller et tilfeldig funn.
Lungeemboli (PE)
Lungeemboli skiller seg fra de overnevnte tilstandene ved at embolien havner i lungekretsløpet, ikke i systemkretsløpet. Det er en akutt tilstand som krever rask diagnostikk og behandling.
Ekkokardiografi ved lungeemboli: Selv om CT lungeangiografi er gullstandarden for diagnose, er ekko avgjørende for å vurdere hemodynamisk konsekvens og risiko. Tegn på betydelig lungeemboli inkluderer:
- Dilatasjon av høyre ventrikkel: RV/LV-ratio > 1,0 (høyre ventrikkel er større enn venstre).
- D-formet venstre ventrikkel: Septum flates ut i systole/diastole på kortaksesnitt grunnet trykk/volum-belastning i høyre side.
- McConnells tegn: Akinesi av den frie veggen i høyre ventrikkel, men med bevart kontraktilitet helt i apex. Dette anses som relativt spesifikt for akutt PE.
- 60/60-tegn: Pulmonal akselerasjonstid < 60 ms og samtidig toppsyklist gradient over trikuspidalklaffen < 60 mmHg (taler for akutt trykkstigning fremfor kronisk).
- Mobil trombe i høyre hjerte (TiR – Thrombus in Transit): Et akutt og farlig funn som krever umiddelbar behandling (trombolyse eller kirurgi).
Klassifisering av lungeemboli
Klinisk alvorlighetsgrad avgjør behandlingen:
- Høyrisiko (Massiv) PE: Pasient med sjokk eller hypotensjon (systolisk BT < 90 mmHg). Krever vanligvis reperfusjonsbehandling (trombolyse).
- Intermediær risiko (Submassiv) PE: Hemodynamisk stabil, men med tegn på høyre ventrikkel-belastning (på ekko/CT) og/eller forhøyede biomarkører (Troponin/BNP).
- Lavrisiko PE: Ingen tegn på høyre ventrikkel-belastning eller myokardskade. Kan ofte behandles poliklinisk.
Differensialdiagnoser ved dilatert høyre ventrikkel må alltid vurderes, spesielt kroniske lungesykdommer (KOLS) og pulmonal hypertensjon, hvor høyre ventrikkelvegg ofte er fortykket (hypertrofi), i motsetning til den tynnveggede dilatasjonen ved akutt PE.
Referanser
1. Global, regional og nasjonal alders- og kjønnsspesifikk dødelighet for 282 dødsårsaker i 195 land og territorier, 1980-2017: en systematisk analyse for den globale sykdomsbyrdestudien 2017. Samarbeidspartnere for GBD 2017 Causes of Death
2. Saric et al: Guidelines for the Use of Echocardiography in the Evaluation of a Cardiac Source of Embolism. Journal of the American Society of Echocardiography (2016).
3. Di Biase: Trombogene og arytmogene roller i venstre atriums vedheng ved atrieflimmer – kliniske implikasjoner. Circulation 2018
4. Di Biase: Does the Left Atrial Appendage Morphology Correlate With the Risk of Stroke in Patients With Atrial Fibrillation? Results From a Multicenter Study. JACC 2012.
5. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation.
6. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism.