Medfødt hjertesykdom og GUCH (Grown Up Congenital Heart disease)
Ekkokardiografi ved medfødt hjertesykdom (CHD) og medfødt hjertesykdom hos voksne (GUCH)
Overlevelsen ved medfødt hjertesykdom (CHD) har økt dramatisk de siste tiårene takket være fremskritt innen barnekardiologi og hjertekirurgi. Dette har resultert i en økt forekomst av medfødt hjertesykdom i befolkningen generelt, slik at de fleste klinikere jevnlig vil møte pasienter med medfødt hjertesykdom, enten på legevakten, sengeposten eller poliklinikken. Omtrent 95 % av alle tilfeller av medfødt hjertesykdom når i dag voksen alder (Mandalenakis et al.). Det største spranget i overlevelse har blitt observert blant tilfeller med de mest komplekse misdannelsene, som tidligere var forbundet med høy mortalitet i barnealder.
Selv de alvorligste misdannelsene har blitt gjenstand for rutinepraksis og reparasjon. Behandlingsrepertoaret omfatter primær kirurgi, flertrinns palliasjon, kateterintervensjoner og avansert medisinsk behandling. Voksne med medfødt hjertesykdom behandles for det meste på spesialiserte GUCH-klinikker (Grown Up Congenital Heart disease / ACHD), men kardiologer og indremedisinere må ha kjennskap til de grunnleggende hemodynamiske prinsippene.
Forekomst av medfødt hjertesykdom (CHD)
Medfødt hjertesykdom (CHD) er den vanligste klassen av større medfødte misdannelser. Medfødt hjertesykdom forekommer hos ca. 1 % av alle levendefødte og 10 % av aborterte fostre, uten betydelige geografiske variasjoner. Omtrent 25 % av alle barn med medfødt hjertesykdom har «kritisk hjertefeil» som må opereres eller interveners i løpet av sitt første leveår (Triedman et al.).
Ifølge European Society of Cardiology (ESC) har 2800 voksne per 1 million individer medfødt hjertefeil. Halvparten av disse har moderate eller kompliserte defekter som krever livslang oppfølging ved ekspertentre; den resterende tredjedelen har milde defekter (Baumgartner et al.). I USA fødes det årlig ca. 40 000 barn med medfødt hjertefeil (Triedman et al.).
Forekomsten av medfødt hjertesykdom i den voksne befolkningen vil fortsette å øke i takt med at overlevelsestiden forlenges og befolkningen eldes.
Neonatal screening med pulsoksymetri
Majoriteten av alle medfødte hjertefeil oppdages tidlig i spedbarns- eller barnealder. Av åpenbare grunner blir mer komplekse defekter vanligvis diagnostisert tidligere på grunn av symptomer som cyanose, hjertesvikt eller bilyder. Defekter som fører til redusert oksygenmetning, oppdages vanligvis ved nyfødtscreening med pulsoksymetri (POX), som er rutine i alle vestlige land, inkludert Norge. Ifølge en Cochrane-gjennomgang vil rundt seks av 10 000 tilsynelatende friske nyfødte ha kritisk hjerte- og karsykdom, og pulsoksymetritesten vil korrekt identifisere fem av disse med kritisk hjerte- og karsykdom (Plana et al.). Mindre defekter, som små VSD-er eller ASD-er, kan gå ubemerket hen i mange år. Av og til kan større defekter, spesielt atrieseptumdefekter, gå upåaktet hen til voksen alder og først presentere seg med redusert funksjonsnivå eller arytmi.
Ekkokardiografi ved medfødt hjertesykdom
Ekkokardiografi er den primære bildediagnostiske modaliteten hos alle pasienter med mistanke om eller kjent medfødt hjertesykdom. Metoden gir detaljert morfologisk og funksjonell informasjon uten strålebelastning. De aller fleste tilfeller kan karakteriseres presist ved hjelp av ekkokardiografi alene eller i kombinasjon med andre modaliteter.
Sammenlignet med voksne med ervervet hjertesykdom, krever den ekkokardiografiske evalueringen ved CHD en systematisk, segmentell tilnærming («Sequential Segmental Analysis»). Man må definere hjertets stilling i brystkassen, situs viscerum atriale (organplassering), forbindelsene mellom vener og atriene (venøs retur), atrioventrikulære koblinger (AV-kobling), ventrikkelmorfologi, ventrikulo-arterielle forbindelser (VA-kobling) og forholdet mellom de store arteriene.
Ventrikkelfunksjonen evalueres ved hjelp av ejeksjonsfraksjon (LVEF), fraksjonell forkortelse (FS – mindre pålitelig ved regionale veggbevegelsesforstyrrelser), slagvolum og myokardtykkelse. Ved høyre ventrikkel (RV), som ofte er den affiserte ventrikkelen ved CHD, benyttes parametere som TAPSE, S’-bølge og «fractional area change» (FAC). Strain-avbildning (GLS) brukes også rutinemessig for å visualisere regional myokardfunksjon og -mekanikk, og har vist seg å ha prognostisk verdi ved flere tilstander. Belastningsforhold (preload/afterload) og hjertefrekvens kan i betydelig grad påvirke vurderingen av ventrikkelfunksjonen.
Kontrastekkokardiografi (Bubble-test): Ved mistanke om intrakardielle shunter (f.eks. PFO eller ASD) er injeksjon av agitert saltvann (bobletest) en verdifull tilleggsundersøkelse. Passasje av bobler fra høyre til venstre atrium innen 3-5 hjertesykluser indikerer en intrakardiell kommunikasjon. Ved Valsalvas manøver kan sensitiviteten for å påvise PFO økes betraktelig.
Transøsofageal ekkokardiografi (TEE) er ofte nødvendig for å visualisere bakre strukturer som atrieseptum, lungevener, venstre aurikkel og hjerteklaffer i detalj, spesielt hos voksne pasienter med dårlig innsyn ved transthorakal ekkokardiografi (TTE). Intraoperativ TEE er standard ved kirurgisk lukking av defekter.
Mange pasienter krever evaluering med andre metoder, f.eks. hjerte-MR (CMR) for nøyaktig volumetrisk måling av høyre ventrikkel og vurdering av ekstrakardielle kar (f.eks. coarctatio), hjerte-CT, ergospirometri (anstrengelsestesting) for funksjonell kapasitet, og hjertekateterisering for trykkmåling og intervensjon.
Prinsipper for behandling av medfødt hjertesykdom og GUCH
Komplekse misdannelser krever ofte intervensjon (kirurgisk eller kateterbasert intervensjon) tidlig i livet. Målet er oftest reparasjon, men hos noen er kun palliasjon (lindring) mulig (f.eks. Fontan-sirkulasjon ved univentrikulært hjerte). I tillegg til misdannelsen utvikler disse pasientene ofte assosierte komplikasjoner over tid («late complications»). Slike komplikasjoner omfatter hjertesvikt, ventrikulære arytmier (f.eks. ventrikulær takykardi relatert til arrvev i ventriklene), supraventrikulære arytmier (f.eks. atrieflimmer eller intra-atriell re-entry takykardi, IART), pulmonal hypertensjon, arteriell (systemisk) hypertensjon, tromboembolisme og endokarditt.
Behandlingen av disse komplikasjonene følger konvensjonelle retningslinjer og prinsipper, men med spesifikke tilpasninger. Dessverre er det utført få store randomiserte studier på denne pasientpopulasjonen, og de fleste anbefalingene er derfor basert på ekstrapolering av studier som er utført på andre pasientpopulasjoner eller ekspertkonsensus (ESC Guidelines for the management of ACHD). For eksempel følger behandlingen av hjertesvikt ved systemisk venstre ventrikkel de samme prinsippene som behandlingen av HFREF. Ved svikt i en systemisk høyre ventrikkel (f.eks. ved TGA operert med atrieswitch) er evidensen for konvensjonell sviktbehandling svakere.
Arytmier er den hyppigste årsaken til sykehusinnleggelse hos voksne med CHD. Selv etter at hjertefeilen er kirurgisk korrigert, gjenstår arrvev og restdefekter som substrat for arytmi. Fordi personer med GUCH ofte har nedsatt hjertefunksjon og stive ventrikler, kan selv milde arytmier og tap av atriell transport (ved atrieflimmer) føre til akutt dekompensasjon eller alvorlig hemodynamisk forverring.
Pasienter med GUCH som har hatt plutselig synkope, bør vurderes nøye, siden de har økt risiko for hjertestans og plutselig død. De misdannelsene som er forbundet med størst risiko, er Fallots tetrade, transposisjon av de store arteriene (TGA), CCTGA (kongenitalt korrigert transposisjon av de store arteriene), medfødt aortastenose og enkelt ventrikkel (UVH, univentrikulært hjerte).
ASD (atrieseptumdefekt)
Atrieseptumdefekt (ASD) muliggjør kommunikasjon mellom atriene. Siden compliance i venstre ventrikkel er lavere enn i høyre ventrikkel, og trykket i venstre atrium normalt er marginalt høyere enn i høyre, vil blodet strømme fra venstre atrium til høyre atrium (venstre-til-høyre shunt). Shuntingen av blod fører til volumoverbelastning av høyre atrium og høyre ventrikkel, samt økt flow i lungekretsløpet. Over tid fører dette til dilatasjon av høyre hjertehalvdel. Tilstander som øker trykket i venstre atrium (systemisk hypertensjon, venstre ventrikkel-svikt, mitralregurgitasjon) vil forverre shuntingen.
Volumoverbelastning i høyre ventrikkel fører til utbuling av septum inn i venstre ventrikkel («septal flattening»). Dette gir venstre ventrikkel et D-formet utseende i PSAX (parasternalt kortaksesnitt), spesielt i slutten av diastolen (ved volumoverbelastning) eller gjennom hele syklusen (ved trykkoverbelastning). Som følge av volumoverbelastning øker slagvolumet i høyre ventrikkel. Dersom lungekarene utsettes for høyt trykk og flow over lang tid, kan PVR (pulmonal vaskulær motstand) øke. Hvis PVR blir så høy at trykket i høyre side overstiger trykket på venstre side, snur shunten (høyre-til-venstre). Pasienten blir da cyanotisk. Denne irreversible tilstanden kalles Eisenmengers syndrom og kontraindiserer lukking av defekten.
Estimering av shuntstørrelse ved ASD
Shuntstørrelsen (Qp/Qs) beregnes ved å estimere blodstrømmen gjennom lunge- (Qp) og systemisk (Qs) sirkulasjon. Dette gjøres ved å sammenligne slagvolumene i høyre og venstre ventrikkel (forutsatt ingen klaffelekkasjer). Slagvolumet i høyre ventrikkel beregnes ved hjelp av en pulsbølgedoppler (PW) plassert i truncus pulmonalis eller RVOT. Venstre ventrikkels slagvolum beregnes med pulsbølgedoppleren plassert i LVOT. Det er kritisk å måle diameteren på utløpstraktatene nøyaktig, da feil her kvadreres i formelen.
Slagvolum i venstre ventrikkel (SVLVOT):
SVLVOT = arealLVOT × VTILVOT
Slagvolum i høyre ventrikkel (SVRVOT):
SVRVOT = arealRVOT × VTIRVOT
Shuntstørrelsen (Qp/Qs) beregnes ved hjelp av følgende formel:
SVRVOT / SVLVOT
Hvis slagvolumet i pulmonalis er 120 ml og i aorta er 40 ml, beregnes shuntstørrelsen som:
120 / 40 = 3
Dette uttrykkes som en 3:1-shunt («3 til 1-shunt»). En Qp/Qs > 1.5 anses vanligvis som en signifikant shunt som indikerer behov for lukking. Beregningen er usikker ved signifikant pulmonal regurgitasjon og aortaregurgitasjon, siden disse tilstandene gjør at slagvolumet over klaffen ikke representerer netto systemisk eller pulmonal flow.
Typer av atrieseptumdefekt (ASD)
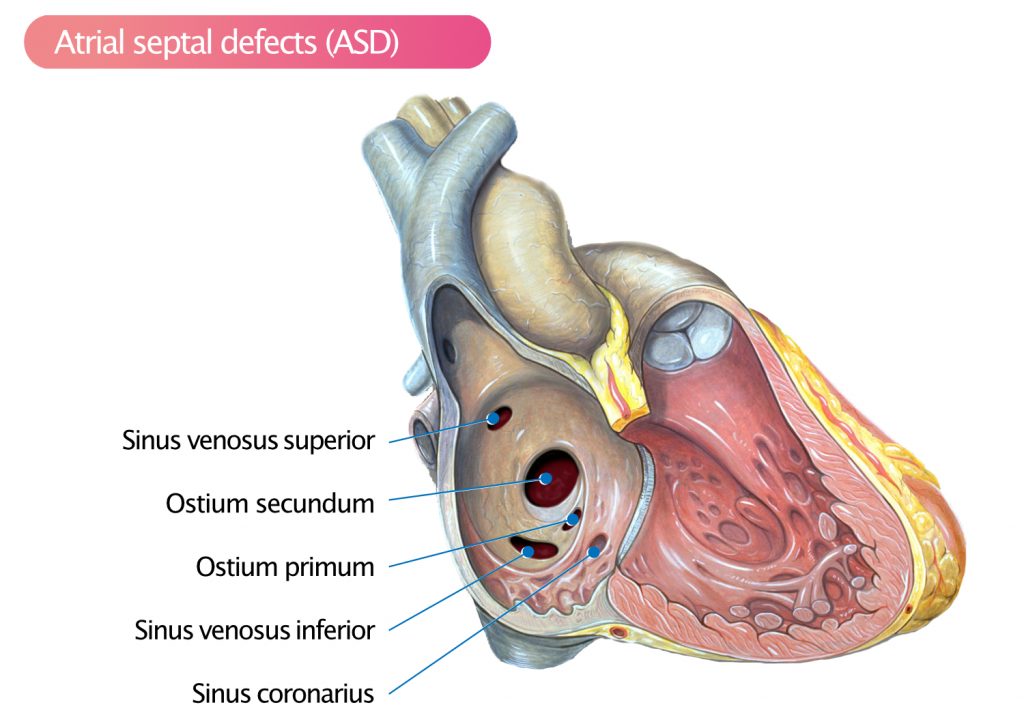
Atrieseptumdefekt (ASD) er – nest etter bikuspid aortaklaff – den vanligste medfødte hjertefeilen hos voksne. ASD deles inn i fire hovedtyper basert på embryologisk opprinnelse og lokalisasjon (figur 1):
- Secundum-defekt (ostium secundum-defekt)
- Primum-defekt (ostium primum-defekt)
- Sinus venosus-defekt (superior og inferior)
- Sinus coronarius-defekt (unroofed coronary sinus)
Secundum-defekt
Omtrent 80 % av alle atrieseptumdefekter er secundumdefekter, som er lokalisert i fossa ovalis (midt i atrieseptum). Secundumdefekter oppstår grunnet manglende dekning av foramen ovale. Det kan foreligge flere secundumdefekter (fenestrert septum). Transthorakal ekkokardiografi (TTE) kan ofte visualisere ASD-er, spesielt fra subcostalt snitt der ultralydstrålene treffer septum vinkelrett, men transøsofageal ekkokardiografi (TEE) er ofte nødvendig for nøyaktig måling av størrelse og felger («rims») før eventuell kateterbasert lukking.
Primum-defekt
Primumdefekter utgjør 15 % av alle ASD-er. Disse defektene er lokalisert i nedre del av atrieseptum, nær det atrioventrikulære planet, og er en del av spekteret av atrioventrikulære septumsdefekter (AVSD). Primumdefekter er nesten alltid ledsaget av defekter i AV-klaffene, typisk en spalte («cleft») i mitralklaffens fremre seil, noe som kan føre til betydelig mitralinsuffisiens. Det er viktig å skille denne fra secundum-ASD, da primum-defekter ikke kan lukkes med kateter, men krever kirurgi.
Sinus venosus-defekt
Sinus venosus-defekter er ikke defekter i selve atrieseptum, men manglende skillevegg mellom vena cava og lungevenene. Den vanligste formen påvirker innmunningen av vena cava superior (SV-ASD superior, ca. 5 %) og er ofte assosiert med partiell abnorm venøs retur (PAPVR) fra høyre øvre lungevene. Defekter mot vena cava inferior er sjeldne (< 1 %). Disse defektene er vanskelige å se på standard TTE, og TEE eller CT/MR er ofte nødvendig for diagnose. Mistanken bør vekkes ved uforklarlig høyre ventrikkel-dilatasjon.
Defekt i sinus coronarius
Koronarsinusdefekt (< 1 %) er sjelden og er lokalisert i taket av sinus coronarius der den løper bak venstre atrium. Dette resulterer i en kommunikasjon mellom venstre atrium og sinus coronarius (som tømmer seg i høyre atrium). Defekten kan være total («unroofed coronary sinus») og er ofte assosiert med persisterende venstre vena cava superior (PLSVC). Klinisk mistanke kan oppstå hvis pasienten har lav oksygenmetning (hvis shunt til venstre atrium) eller dilatert sinus coronarius.
Prognose ved ASD
ASD er vanligvis asymptomatisk gjennom barneårene. Etter 40 års alder har pasientene imidlertid en tendens til å utvikle symptomer på høyre hjertesvikt (dyspné, ødemer) og redusert funksjonsnivå. Supraventrikulære arytmier (atrieflimmer, atrieflutter) er svært vanlig grunnet atriedilatasjon. Alvorlig pulmonal hypertensjon (Eisenmenger) er sjelden (< 5 %) i dagens medisinske virkelighet, men moderat trykkstigning er ikke uvanlig. Paradoksale embolier (blodpropp fra vene til arteriesiden gjennom ASD) kan forårsake hjerneslag.
Ved ekkokardiografi er høyre ventrikkels belastning (volumbelastning med paradoksal septumbevegelse) det viktigste indirekte funnet som alltid skal trigge jakt på en ASD.
Ventrikkelseptumdefekt (VSD)
Ventrikkelseptumdefekt (VSD) er den vanligste medfødte hjertefeilen ved fødsel, men mange lukkes spontant. VSD kan foreligge isolert eller i kombinasjon med mer komplekse hjertefeil (f.eks. Fallots tetrade, transposisjon av de store arteriene, AVSD). Jo større defekten er, desto større er den hemodynamiske påvirkningen (Qp/Qs), og desto tidligere stilles diagnosen.
VSD fører primært til volumbelastning på venstre ventrikkel og venstre atrium, til tross for at blodet shuntes til høyre side. Dette skyldes at blodet resirkulerer gjennom lungene og returnerer til venstre hjertehalvdel. Høyre ventrikkel fungerer hovedsakelig som en kanal for shunten og blir ikke nødvendigvis dilatert med mindre det foreligger pulmonal hypertensjon. En stor VSD gir utjevning av trykket mellom ventriklene, noe som raskt fører til pulmonal hypertensjon og Eisenmengers syndrom hvis det ikke korrigeres.
Med kontinuerlig bølgedoppler (CW) kan strømningen gjennom en VSD brukes til å beregne trykkgradienten mellom ventriklene. Ved en liten, restriktiv VSD vil hastigheten være høy (ofte > 4 m/s), som reflekterer den store trykkforskjellen mellom LV og RV. En lav hastighet (< 2-3 m/s) ved en VSD kan være et illevarslende tegn på at trykket i høyre ventrikkel er patologisk forhøyet (utjevnet trykk).
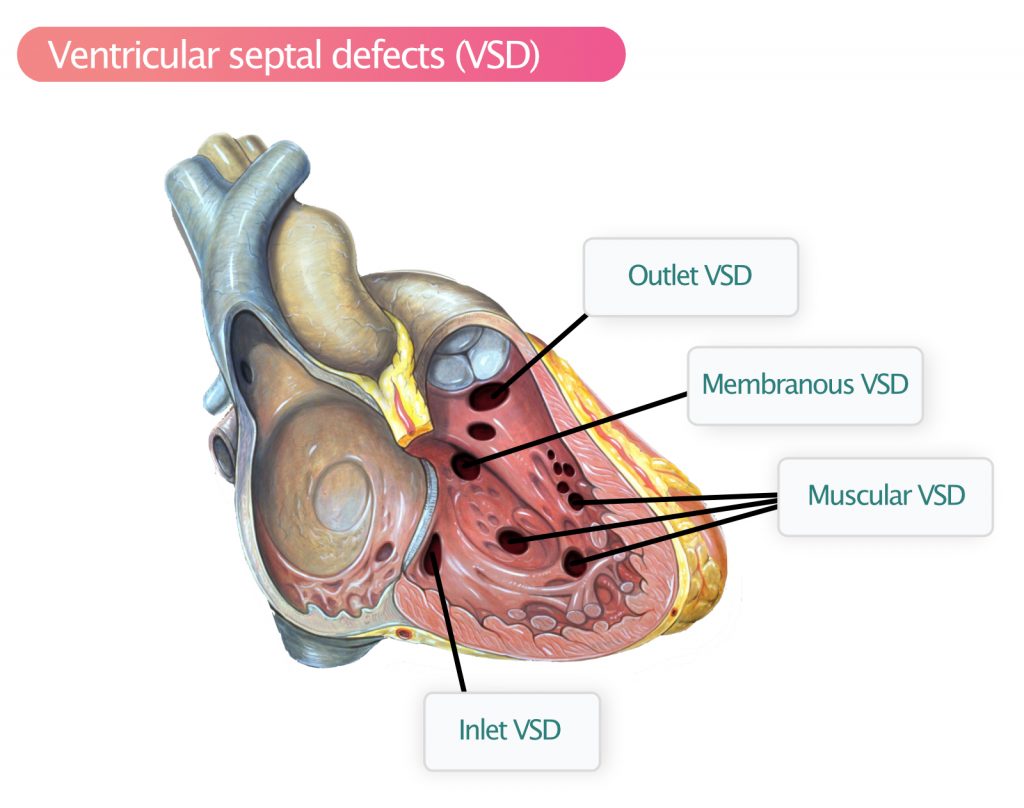
Basert på plasseringen av VSD-en defineres følgende typer (figur 2):
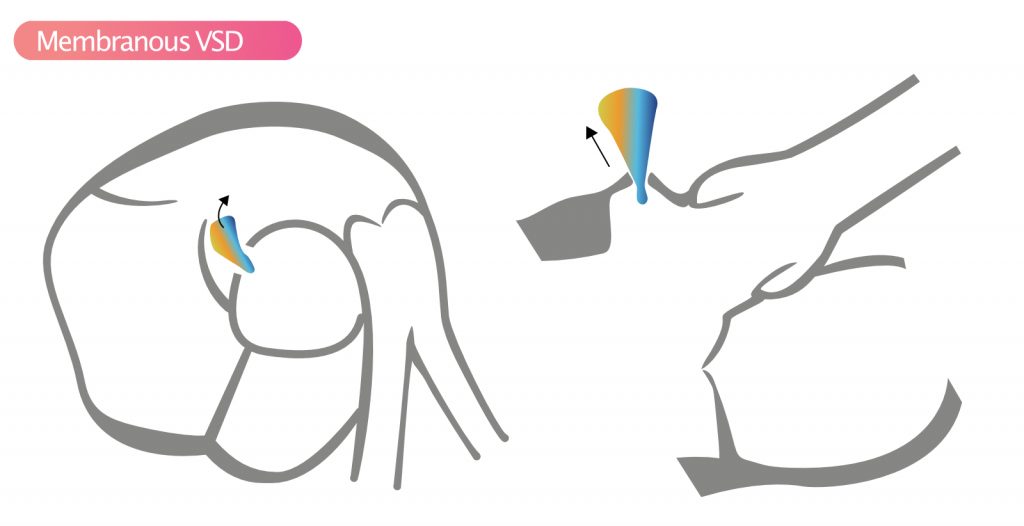
- Membranøs VSD (Perimembranøs) – Den vanligste (80 %) typen VSD. Den affiserer den membranøse delen av ventrikkelseptum, nær aortaklaffen og trikuspidalklaffen. Disse defektene sees best i parasternale bilder, særlig i SAX klokken 10. Spontan lukking er vanlig ved dannelse av aneurismatisk vev fra trikuspidalklaffen («aneurysm of the membranous septum»). Samtidig aortaregurgitasjon kan oppstå hvis aortakuspene prolaberer inn i defekten.
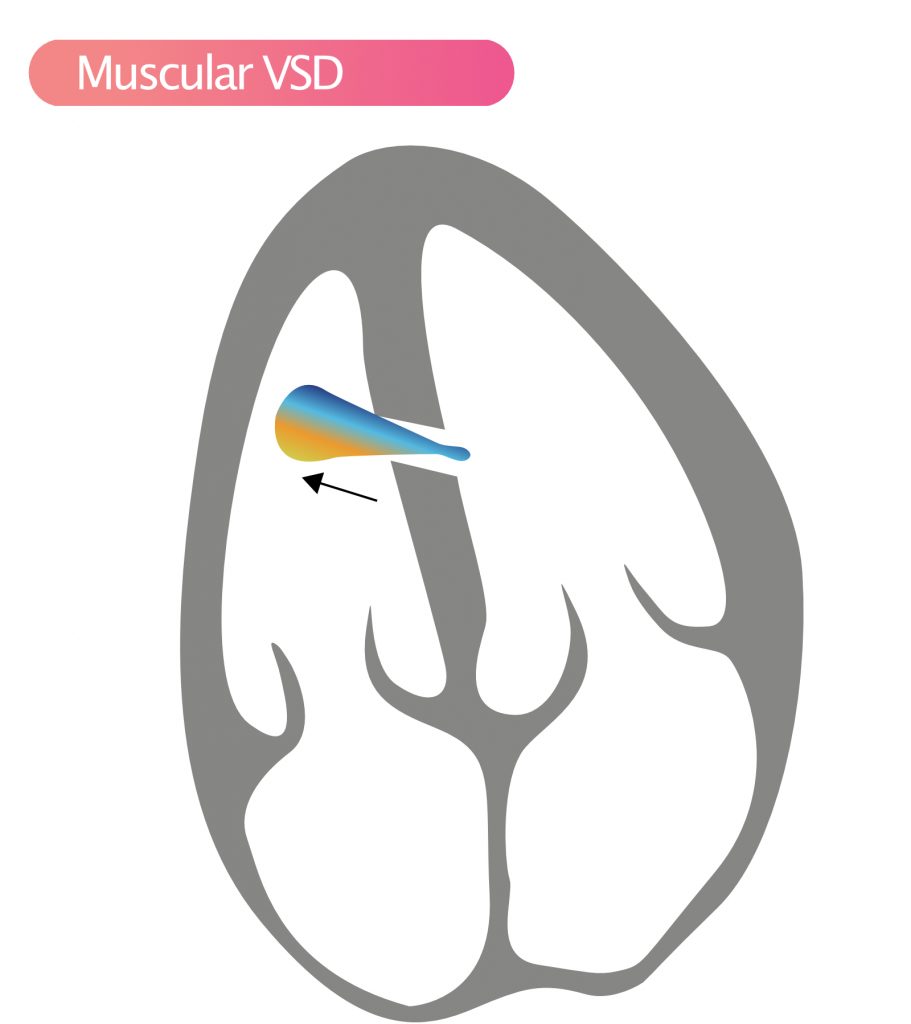
- Muskulær VSD (15 %) – Muskulære VSD kan finnes hvor som helst i de muskulære segmentene i septum (apikalt, midt-muskulært). Det kan foreligge flere defekter («Swiss cheese septum»). Spontan lukking er svært vanlig i barnealder. Muskulær VSD kan sees i apikal firekammervisning (A4C) og kortakset visning (SAX).
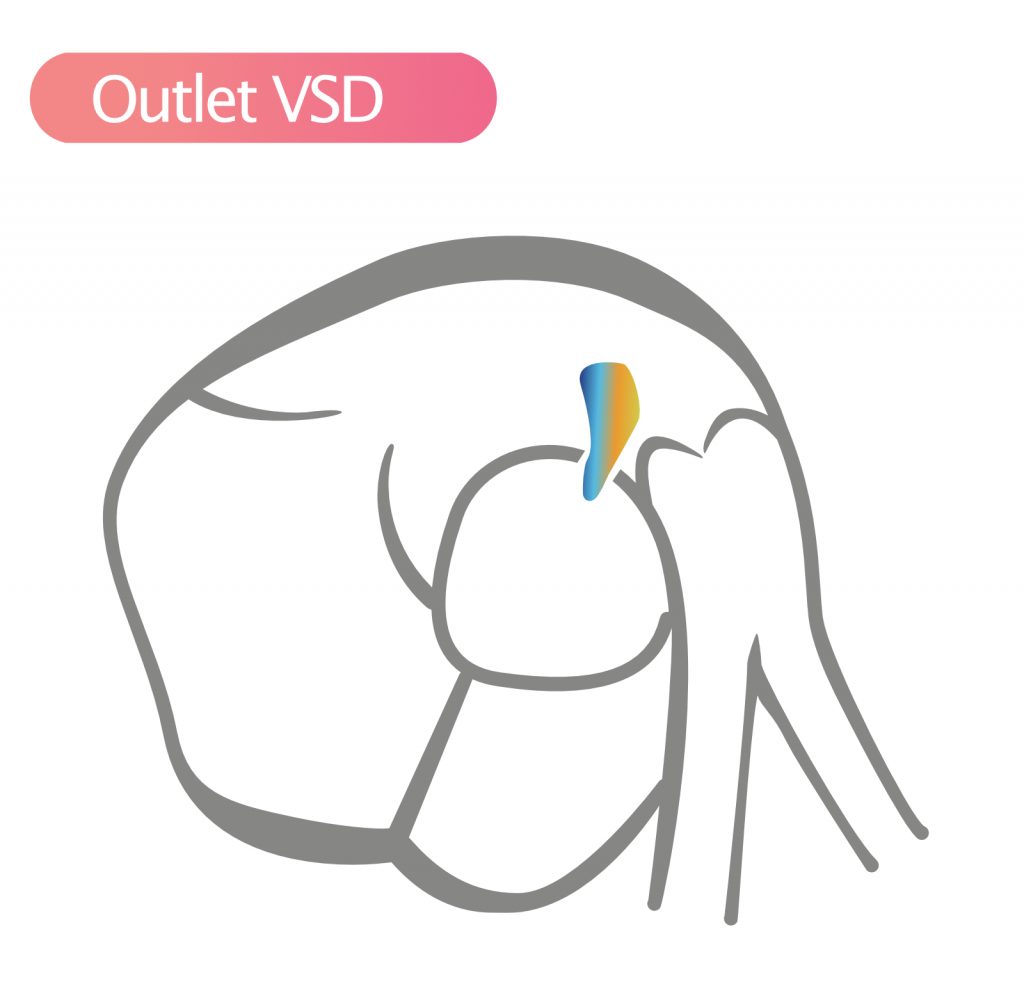
- Utløps-VSD (Outlet / Supracristal / Doubly committed) (5 %) – Denne VSD-en ses i SAX-visning og er lokalisert klokken 2 (høyre skulder), like under både aortaklaffen og pulmonalklaffen. Fordi støtten til høyre coronare aortakusp er svekket, er det høy risiko for progressiv aortaregurgitasjon. Spontan lukking er sjelden, og disse opereres ofte tidlig for å spare aortaklaffen. Denne typen er vanligere i asiatiske populasjoner.
- Inlet VSD (Inflow) (< 1 %) – Inflow VSD er lokalisert posteriort i innstrømningen av septum, nær trikuspidalklaffen. Det er typisk ved Downs syndrom og er en del av AVSD-komplekset.
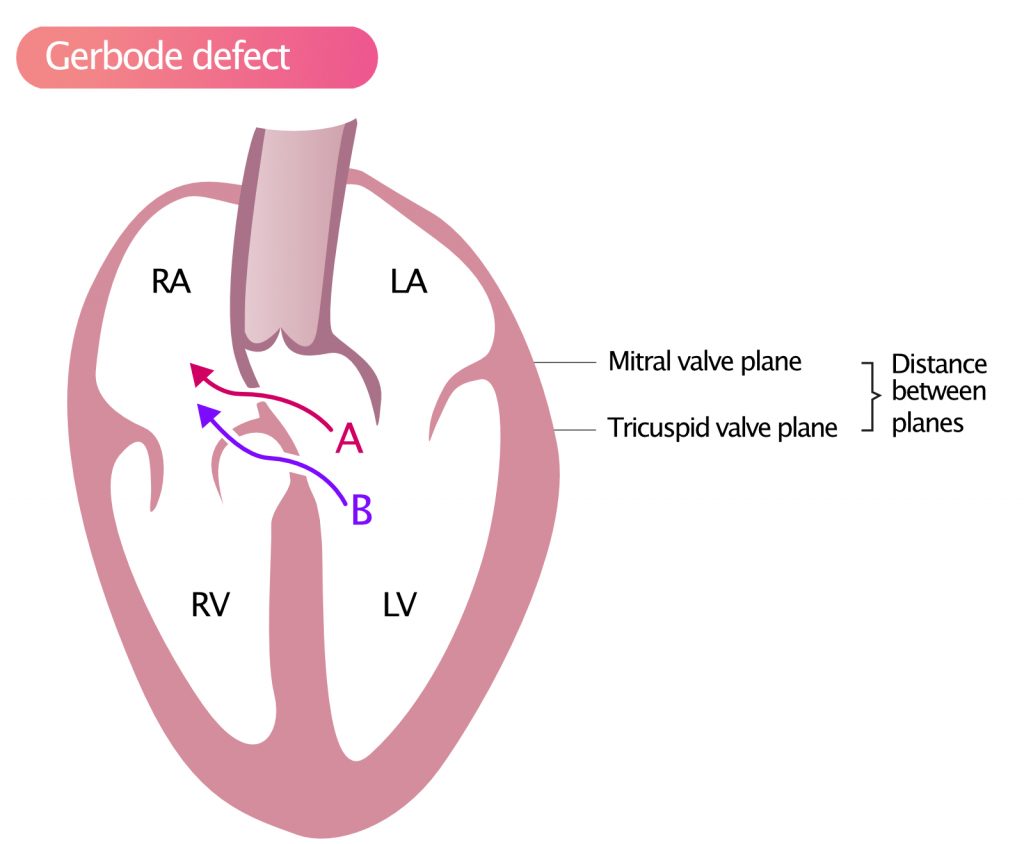
Gerbode-defekt
Siden trikuspidalklaffens septale blad normalt er festet mer apikalt enn mitralklaffens fremre blad, er det en del av septum (atrioventrikulært septum) som skiller venstre ventrikkel fra høyre atrium. En VSD i dette området kan forårsake direkte blodshunting fra venstre ventrikkel til høyre atrium (LV-RA shunt), som vist i figur 6. Denne typen defekt kalles Gerbode-defekt. Dopplersignalet kan forveksles med en trikuspidalinsuffisiens (TI) på grunn av den høye hastigheten (systolisk gradient LV-RA), men strålen starter typisk senere i systolen eller har en annen retning enn en typisk TI.
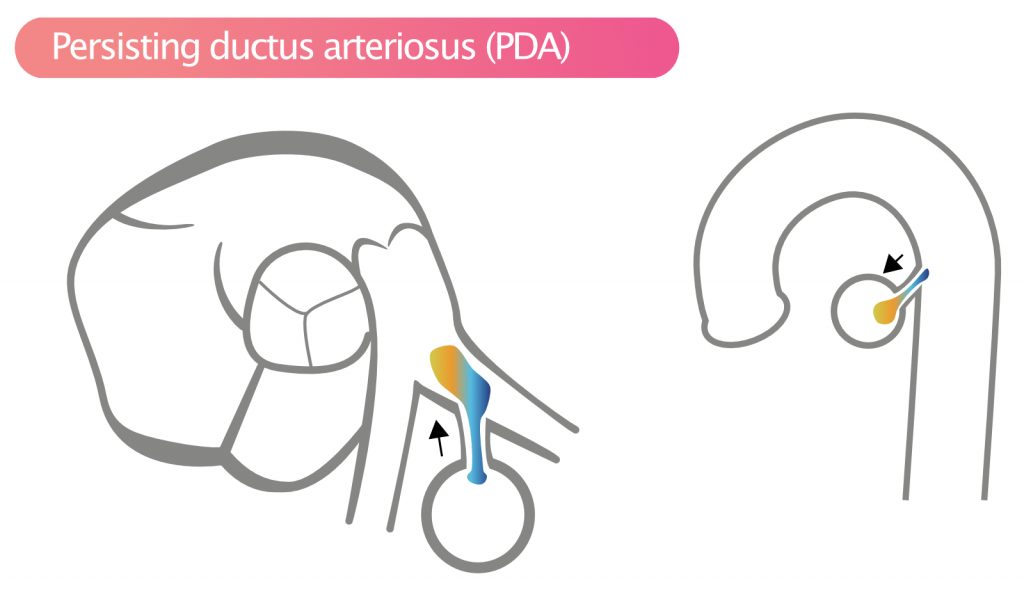
Persisterende ductus arteriosus (PDA)
Ductus arteriosus er en normal fetal karforbindelse mellom lungepulsåren (ved bifurkasjonen) og aorta descendens (distalt for venstre arteria subclavia). Persisterende ductus arteriosus (PDA) innebærer at denne forbindelsen ikke lukker seg etter fødselen. PDA er sjelden som nyoppdaget tilstand i voksen alder, men kan forekomme. Defekten fører til volumbelastning på venstre hjertekammer og venstre atrium (grunnet økt lungevenøs retur) og risiko for utvikling av pulmonal hypertensjon.
PDA sees best med fargedoppler i suprasternal visning («crab view») eller parasternal kortakset visning (SAX) med fokus på lungearterien. Blodstrømmen gjennom PDA går fra aorta (høyt trykk) til truncus pulmonalis (lavt trykk) gjennom hele hjertesyklusen, men mest i systolen. Dette gir et kontinuerlig dopplersignal («maskinlyd»). Ved høyt lungetrykk kan strømmen bli rent systolisk eller reversert (høyre-til-venstre ved Eisenmenger).
Coarctatio aortae (CA)
Coarctatio aortae innebærer en innsnevring av aorta, oftest lokalisert like distalt for avgangen av venstre arteria subclavia (ved isthmus aortae). Tilstanden er ofte assosiert med bikuspid aortaklaff. Hos voksne er diagnosen ofte mistenkt på grunn av sekundær hypertensjon.
Ekkokardiografisk kan innsnevringen visualiseres fra suprasternal view. 2D-bilder kan være utfordrende, men fargedoppler avslører turbulent strømning over innsnevringen. Kontinuerlig bølgedoppler (CW) avslører økte hastigheter, og typisk for en signifikant stenose er et «sagtan-mønster» med forlenget diastolisk «run-off» (strømning fortsetter inn i diastolen fordi trykket distalt for stenosen forblir lavere enn proximalt). Abdominal aorta bør undersøkes for pulsatilitet; ved signifikant coarctatio vil den abdominale strømningsprofilen være «dempet» (parvus et tardus) med tap av tidlig diastolisk tilbakestrømning.

Ebsteins anomali
Normalt er trikuspidalklaffens septale innfesting plassert litt mer apikalt (opptil 8 mm/m2) enn mitralklaffen. Ebsteins anomali innebærer at trikuspidalklaffens septale og posteriore seil er forskjøvet (displassert) betydelig nedover i høyre ventrikkel, mens det fremre seilet er stort og seilformet («sail-like») (figur 9). Det klassiske diagnosekriteriet er en forskyvning på > 20 mm eller > 8 mm/m2 hos voksne.
Dette fører til at en del av høyre ventrikkel blir «atrialisert» (fungerer som en del av atriet), noe som reduserer størrelsen på den funksjonelle høyre ventrikkelen. Som regel foreligger det en mer eller mindre uttalt trikuspidalklaffregurgitasjon. Pasienter med Ebsteins anomali har ofte en ASD (eller PFO) som tillater høyre-til-venstre shunt ved høyt atrietrykk (cyanose), og de har høy forekomst av aksessoriske ledningsbaner (WPW-syndrom).

Fallots tetrade (ToF)
Fallots tetrade (Tetralogy of Fallot, ToF) er den vanligste årsaken til cyanotisk hjertefeil hos barn, og den hyppigste diagnosen hos reparerte voksne med GUCH. Tetraden består av fire elementer: 1) stor VSD, 2) overridende aorta, 3) pulmonal stenose (RVOT-obstruksjon) og 4) høyre ventrikkel-hypertrofi. Nesten alle voksne med ToF er operert.
Det viktigste ekkokardiografiske funnet hos voksne, reparerte ToF-pasienter, er pulmonalregurgitasjon (PR). Etter reparasjon (hvor RVOT ofte utvides med en patch) blir lungeklaffen inkompetent. Alvorlig PR tolereres godt i mange år, men fører til slutt til alvorlig dilatasjon og svikt av høyre ventrikkel. Timing for lungeklaffimplantasjon (kirurgisk eller perkutan) er en av de viktigste avgjørelsene i oppfølgingen av disse pasientene, og baseres ofte på RV-volumer målt ved MR eller ekko.
Transposisjon av de store arteriene (TGA og CCTGA)
Transposisjon av de store arteriene (TGA) innebærer at aorta og lungearterien har byttet plass. Man skiller mellom to hovedformer som er fundamentalt forskjellige:
D-TGA (Komplett transposisjon)
Ved klassisk TGA (d-TGA) er det atrioventrikulær konkordans (RA til RV, LA til LV), men ventrikulo-arteriell diskordans (RV til Aorta, LV til Pulmonalis). Dette gir to parallelle sirkulasjoner hvor oksygenfattig blod pumpes ut i kroppen. Uten en shunt (ASD, VSD, PDA) er tilstanden uforenlig med liv.
Historisk ble disse pasientene operert med atriell switch (Mustard eller Senning-prosedyre), hvor blodet omdirigeres på atrienivå. Dette fører til at høyre ventrikkel (RV) fungerer som systemisk pumpekammer livet ut. RV er ikke bygget for systemisk trykk over tid og svikter ofte i voksen alder («systemic RV failure»). I dag behandles nyfødte med arteriell switch (Jatene-prosedyre), hvor de store karene kobles riktig, slik at venstre ventrikkel blir systemisk pumpe. Langtidsresultatene er betydelig bedre.
L-TGA / CCTGA (Korrigert transposisjon)
Kongenitalt korrigert transposisjon (CCTGA eller l-TGA) kalles «double discordance». Her har både ventriklene og de store karene byttet plass. Blodet går fra høyre atrium -> morfologisk venstre ventrikkel -> lungearterien (normal oksygenering). Blodet fra lungene går til venstre atrium -> morfologisk høyre ventrikkel -> aorta. Sirkulasjonen er altså fysiologisk «korrigert» uten kirurgi, og pasientene kan være asymptomatiske langt opp i voksen alder. Problemet er imidlertid at den morfologiske høyre ventrikkel må pumpe mot systemisk trykk, noe den over tid kan svikte av. I tillegg er trikuspidalklaffen (som sitter i systemisk posisjon) utsatt for lekkasje, og pasientene har høy risiko for total AV-blokk.
Referanser
- Overlevelse hos barn og unge voksne med medfødt hjertefeil i Sverige. Mandalenakis Z et al. JAMA Intern Med. 2017;177 (2):224-230.
- Trender innen medfødt hjertesykdom – det neste tiåret. Triedman et al. Circulation. 2016;133:2716-2733
- Plana et al. Pulsoksymetri for diagnostisering av kritiske medfødte hjertefeil. Cochrane Collaboration.