Hypertrofisk kardiomyopati (HCM) og hypertrofisk obstruktiv kardiomyopati (HOCM)
Hypertrofisk kardiomyopati (HCM): fra patofysiologi til ekkokardiografi
Hypertrofisk kardiomyopati (HCM) er en primær, ofte arvelig hjertemuskelsykdom definert ved tilstedeværelsen av venstre ventrikkelhypertrofi (LVH) som ikke kan forklares utelukkende av abnorme belastningsforhold. Hypertrofisk kardiomyopati må differensieres fra sekundær hypertrofi forårsaket av økt etterbelastning (afterload). Økt ventrikulær belastning er hyppigst forårsaket av systemisk hypertensjon eller aortastenose. Ved hypertensjon medfører den økte systemiske motstanden at ventrikkelen må generere et høyere trykk for å pumpe blod ut i aorta under systolen. Ved aortastenose foreligger det en mekanisk obstruksjon i selve aortaklaffen grunnet redusert åpningsareal. Både aortastenose og hypertensjon fører til økt veggstress, som ventrikkelen kompenserer for ved å utvikle konsentrisk hypertrofi (Laplaces lov).
Hypertrofisk kardiomyopati innebærer venstre ventrikkelhypertrofi under normale belastningsforhold, eller hypertrofi som er disproporsjonal i forhold til en eventuell underliggende belastningstilstand.
Anbefalt lesning
– Forholdet mellom ventrikkeltrykk og ventrikkelvolum: Forbelastning, etterbelastning, slaggvolum, veggspenning og Frank-Starlings lov
– Myokardets mekanikk
Det er klinisk avgjørende å skille mellom hypertrofisk kardiomyopati og adaptiv hypertrofi forårsaket av hemodynamisk belastning («hypertensivt hjerte» eller «idrettshjerte»). Hypertensiv hjertesykdom er langt vanligere, og tilstandene kan sameksistere. En betydelig andel av befolkningen har høyt blodtrykk, og aortastenose har høy prevalens i den eldre befolkningen. Pasientkarakteristika, EKG-funn, familiemønster og fordelingen av hypertrofien på ekkokardiografi brukes til å skille HCM fra sekundære former. Ved økt belastning bør man mistenke hypertrofisk kardiomyopati dersom graden av hypertrofi er disproporsjonal i forhold til belastningen (f.eks. septum > 15 mm ved mild hypertensjon). Sannsynligheten for hypertrofisk kardiomyopati er omvendt relatert til alder ved diagnose; jo yngre pasienten er, desto høyere er sannsynligheten for en genetisk etiologi fremfor en livsstilsbetinget årsak.
De genetiske mekanismene ved HCM er komplekse og involverer oftest mutasjoner i gener som koder for sarkomerproteiner. Nedarvingen er som regel autosomal dominant, men med varierende penetrans og uttrykk. Det er også viktig å merke seg at noen genvarianter kan gi en fenotype som forverres av hypertensjon, noe som kompliserer det kliniske bildet ytterligere.
Tilstedeværelse av systemisk hypertensjon eller aortastenose utelukker ikke hypertrofisk kardiomyopati, men krever en nøye vurdering av om hypertrofien står i forhold til belastningen.
Klinisk presentasjon og symptomer
Det kliniske spekteret ved HCM er svært bredt, fra helt asymptomatiske individer som oppdages ved tilfeldighet eller familiescreening, til pasienter med alvorlig hjertesvikt eller plutselig død som første manifestasjon. De vanligste symptomene inkluderer:
- Dyspné: Det hyppigste symptomet, ofte forårsaket av diastolisk dysfunksjon med forhøyet fyllingstrykk i venstre ventrikkel, og eventuelt obstruksjon i utløpskanalen.
- Brystsmerter (angina): Kan forekomme både ved hvile og anstrengelse, selv uten koronarstenoser. Årsaken er ofte mikrovaskulær dysfunksjon, økt muskelmasse med økt oksygenbehov, og kompresjon av intramurale arterioler.
- Palpitasjoner: Som følge av supraventrikulære arytmier (særlig atrieflimmer) eller ventrikulære ekstrasystoler.
- Presynkope og synkope: Alvorlige varselsymptomer som kan skyldes ventrikulære arytmier, ledningsforstyrrelser, eller hemodynamisk kollaps grunnet obstruksjon i utløpstrakt ved anstrengelse.
Epidemiologiske aspekter ved hypertrofisk kardiomyopati (HCM)
Hypertrofisk kardiomyopati rammer menn og kvinner, men diagnostiseres noe hyppigere hos menn. Tradisjonelt har prevalensen i den generelle befolkningen vært estimert til ca. 1:500 (0,2 %), men nyere data som inkluderer genotype-positive/fenotype-negative individer og bruk av høysensitiv bildediagnostikk (MR), antyder at prevalensen kan være så høy som 1:200. Hypertrofisk kardiomyopati er en ledende årsak til plutselig hjertedød (SCD) blant unge individer (< 35 år). Blant idrettsutøvere i USA er HCM den vanligste årsaken til SCD, mens i enkelte europeiske regioner (som Veneto, Italia) er arytmogen høyre ventrikkel kardiomyopati (ARVC) hyppigere. Dagens anbefalinger for screening av idrettsutøvere legger stor vekt på EKG og anamnese for å avdekke kardiomyopati.
Hypertrofisk kardiomyopati er den vanligste årsaken til plutselig hjertedød blant konkurranseidrettsutøvere i mange populasjoner.
Ekkokardiografi ved hypertrofisk kardiomyopati (HCM)
Ekkokardiografi er hjørnesteinen i diagnostikken. Hypertrofien ved HCM er karakteristisk asymmetrisk, i motsetning til den mer symmetriske hypertrofien man ser ved hypertensjon eller «idrettshjerte». Asymmetrisk septal hypertrofi (ASH) er den vanligste formen, men apikal hypertrofi, midtventrikulær hypertrofi og isolert hypertrofi av lateralveggen forekommer også.
Hypertrofisk kardiomyopati og ventrikkelgeometri
Selv om den klassiske formen er asymmetrisk, medfører HCM en økning i myokardmassen som reduserer volumet i venstre ventrikkel («cavity obliteration»). Dette har hemodynamiske likhetstrekk med konsentrisk hypertrofi, der fortykket myokardium stjeler plass fra ventrikkelhulen. Det reduserte endediastoliske volumet betyr at ejeksjonsfraksjonen (EF) ofte er normal eller supranormal (> 65-70 %) for å opprettholde et adekvat slagvolum (figur 1). En EF i nedre normalområdet (f.eks. 50-55 %) hos en pasient med uttalt HCM kan derfor være et tegn på begynnende systolisk svikt.
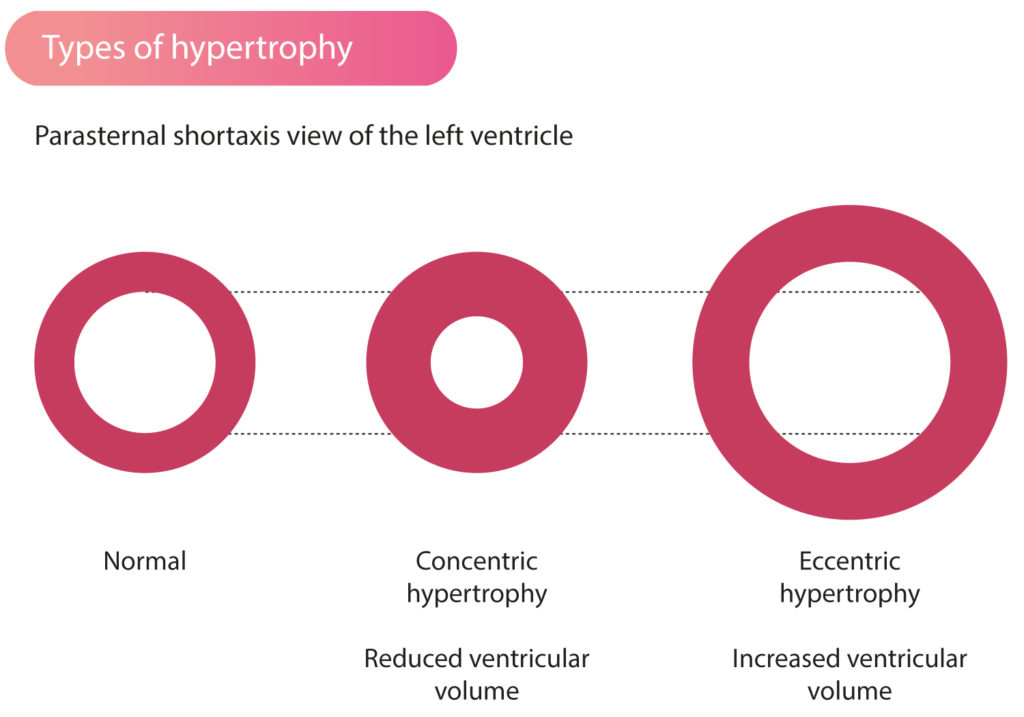
Motsatsen til denne geometrien er eksentrisk hypertrofi, som ofte observeres hos utholdenhetsutøvere. Eksentrisk hypertrofi kjennetegnes av en proporsjonal økning i kammerstørrelse og veggtykkelse. Idrettsutøvere har typisk økt ventrikkelvolum og en ejeksjonsfraksjon som kan være i nedre normalområde i hvile. Idrettsutøverens hjerte kompenserer med store slagvolum fremfor høy EF.
Definisjon og diagnostiske kriterier
Den kliniske diagnosen HCM baseres på påvisning av økt veggtykkelse i en eller flere segmenter av venstre ventrikkel som ikke kan forklares av andre årsaker. Målinger gjøres i parasternalt langaksesnitt (PLAX) og systematiske kortaksesnitt (PSAX) fra base til apex:
- Maksimal veggtykkelse (oftest septum eller inferolateralt).
Diagnostiske grenseverdier (i henhold til ESC-retningslinjer):
- Voksne: Veggtykkelse ≥ 15 mm.
- Barn: Veggtykkelse > 2 standardavvik (Z-score > 2) for kroppsoverflate.
- Pårørende: Hos familiemedlemmer av HCM-pasienter kan en tykkelse på 13–14 mm være diagnostisk.
Idrettsutøvere kan ha fysiologisk hypertrofi («gråsone» 13-15 mm). Differensialdiagnostikken mot HCM kan være utfordrende. Bruk av Global Longitudinal Strain (GLS) er nyttig; ved HCM ser man ofte redusert strain i de hypertrofiske segmentene (f.eks. septum), mens idrettshjerter har normal strain. I tillegg kan kardiometabolske sykdommer (som Fabrys sykdom) og amyloidose gi lignende bilder. Følgende trekk styrker mistanken om HCM:
- Asymmetrisk hypertrofi (vs. konsentrisk ved hypertensjon/amyloidose).
- Liten venstre ventrikkel (< 45 mm endediastolisk).
- Forstørret venstre atrium (grunnet diastolisk dysfunksjon og ev. mitrallekkasje).
- Redusert GLS, særlig i basale septum.
- Obstruksjon i LVOT.
- Positiv familieanamnese eller genfeil.
Tabell 1 presenterer en oversikt over tilstander som kan etterligne HCM (fenokopier).
Tabell 1. Fenokopitilstander for hypertrofisk kardiomyopati
| Fenotype | Fenotypisk ledetråd |
| AMPK-mediert glykogenlagring (PRKAG2) |
Normal eller redusert systolisk funksjon, uttalt hypertrofi, kort PR-intervall/pre-eksitasjon (WPW) |
| Pompes sykdom |
Autosomal recessiv, glykogenose, muskelsvakhet, makroglossia, «kort» PR-intervall |
| Anderson-Fabrys sykdom |
X-bundet lysosomal lagringssykdom. Konsentrisk LVH. Angiokeratomer, hypohidrose, nyresvikt, parestesier, lav T1-mapping på MR. |
| Danons sykdom |
X-bundet dominant, massiv hypertrofi, muskelsvakhet, kognitiv svikt, pre-eksitasjon |
| Amyloidose (AL eller ATTR) | Eldre pasienter. Lav QRS-spenning tross tykke vegger, «apical sparing» på strain, bi-atrial dilatasjon |
| Kearns-Sayre syndrom | Mitokondriesykdom. Oftalmoplegi, pigmentretinopati, ledningsforstyrrelser |
| Friedreichs ataksi | Autosomal recessiv, ataksi, sensorisk nevropati |
| Noonan/LEOPARD-syndromer |
Rasopatier. Pulmonalstenose, hypertrofi, lentigines, pterygium colli, kortvoksthet |
CK = kreatinkinase; LGE = late gadolinium enhancement; WPW = Wolff-Parkinson-White.
Kardial MR (CMR) i utredningen
Kardial MR har blitt en integrert del av utredningen ved mistenkt HCM. MR gir en overlegen fremstilling av morfologi, spesielt i områder som er vanskelige å visualisere med ekko (f.eks. anterolateral vegg og apex). Videre er MR gullstandarden for å kvantifisere myokardfibrose ved hjelp av Late Gadolinium Enhancement (LGE). Utbredelsen av LGE er en viktig prognostisk markør; betydelig fibrose (> 15 % av LV-massen) er assosiert med økt risiko for plutselig død og progresjon til hjertesvikt.
Hypertrofisk obstruktiv kardiomyopati (HOCM)
Ved hypertrofisk kardiomyopati er det avgjørende å kartlegge om det foreligger en dynamisk obstruksjon i venstre ventrikkels utløpskanal (LVOT). Omtrent en tredjedel har obstruksjon i hvile, og ytterligere en tredjedel får obstruksjon ved provokasjon (Valsalva eller fysisk anstrengelse). Tilstanden defineres som Hypertrofisk obstruktiv kardiomyopati (HOCM) når gradienten i LVOT er ≥ 30 mmHg. En gradient på ≥ 50 mmHg regnes som hemodynamisk signifikant og er terskelen for invasiv behandling ved symptomer.
HOCM med systolisk anterior bevegelse (SAM)
Mekanismen bak LVOT-obstruksjon er sammensatt. Septumhypertrofi innsnevrer utløpskanalen og endrer blodstrømmen. Den høye strømningshastigheten skaper en sugkraft (Venturi-effekt) og/eller drag-kraft som trekker mitralklaffens fremre seil inn i utløpskanalen mot septum. Dette fenomenet kalles systolisk anterior bevegelse (SAM). Resultatet er en dynamisk obstruksjon som øker motstanden for venstre ventrikkel (figur 2).
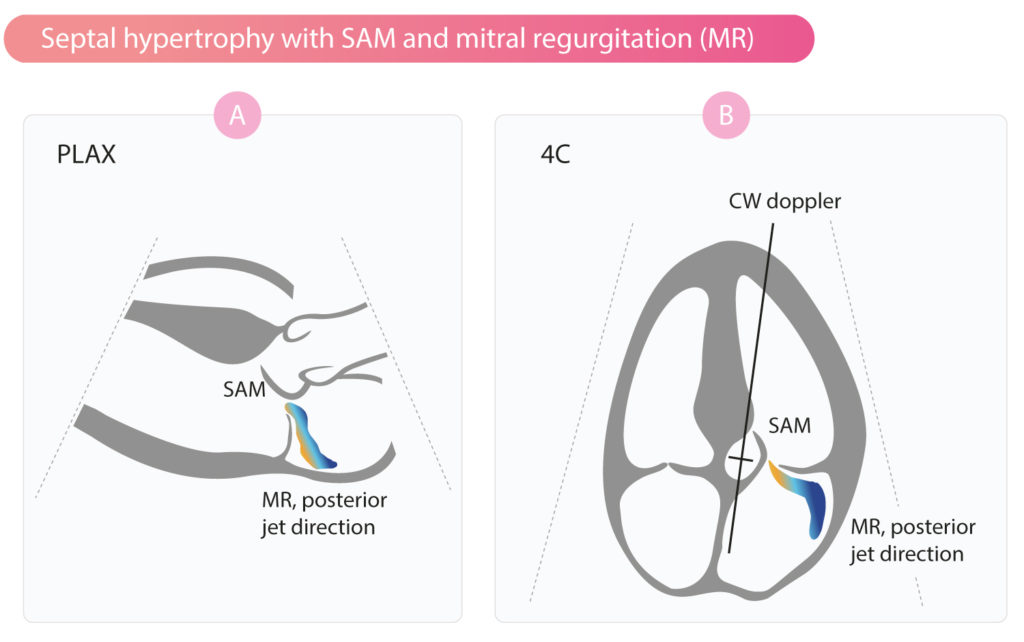
Hvis SAM er uttalt, oppstår «septal contact» der mitralklaffen fysisk berører septum midt i systolen. Dette kan også føre til at aortaklaffen lukker seg midt i systolen («mid-systolic notch» på M-mode) grunnet det plutselige trykkfallet distalt for obstruksjonen.
Mitralinsuffisiens er en direkte konsekvens av SAM. Fordi fremre mitralseil trekkes ut av stilling, oppstår det en lekkasjeåpning posteriort (figur 2). Lekkasjen er typisk rettet bakover og lateralt i venstre atrium.

Kontinuerlig bølgedoppler (CW) er essensielt for å kvantifisere obstruksjonen (figur 2 og 3). Spektralkurven ved HOCM har en karakteristisk «dolkform» med sent systolisk toppunkt (late peaking), da obstruksjonen blir verre mot slutten av systolen når ventrikkelen tømmes. Dette skiller den fra den mer symmetriske, parabelformede kurven ved aortastenose (figur 3).
Det er en klassisk feilkilde å forveksle CW-signalet fra LVOT-obstruksjonen med signalet fra mitralinsuffisiensen. MR-signalet varer lenger (starter ved lukking av mitral og varer til åpning) og har ofte høyere hastighet (> 5-6 m/s). Video 1 viser HOCM med SAM.
Obstruksjonen er dynamisk og svært avhengig av belastningsforholdene (preload og afterload) samt kontraktilitet. Faktorer som øker gradienten inkluderer:
- Redusert preload: Hypovolemi, Valsalva-manøver, diuretika, reising fra liggende til stående.
- Redusert afterload: Vasodilatasjon (f.eks. ved ACE-hemmere).
- Økt kontraktilitet: Fysisk anstrengelse, sympatisk aktivering, inotrope legemidler (digoxin, beta-agonister).
SAM forårsaker mitralinsuffisiens (MR)
Som nevnt er MR ved HOCM oftest sekundær til SAM. Hvis lekkasjen er sentral eller rettet anteriort, bør man mistenke primær mitralklaffsykdom i tillegg til HCM, noe som er viktig for valg av kirurgisk strategi.
Apikal og midtventrikulær hypertrofi
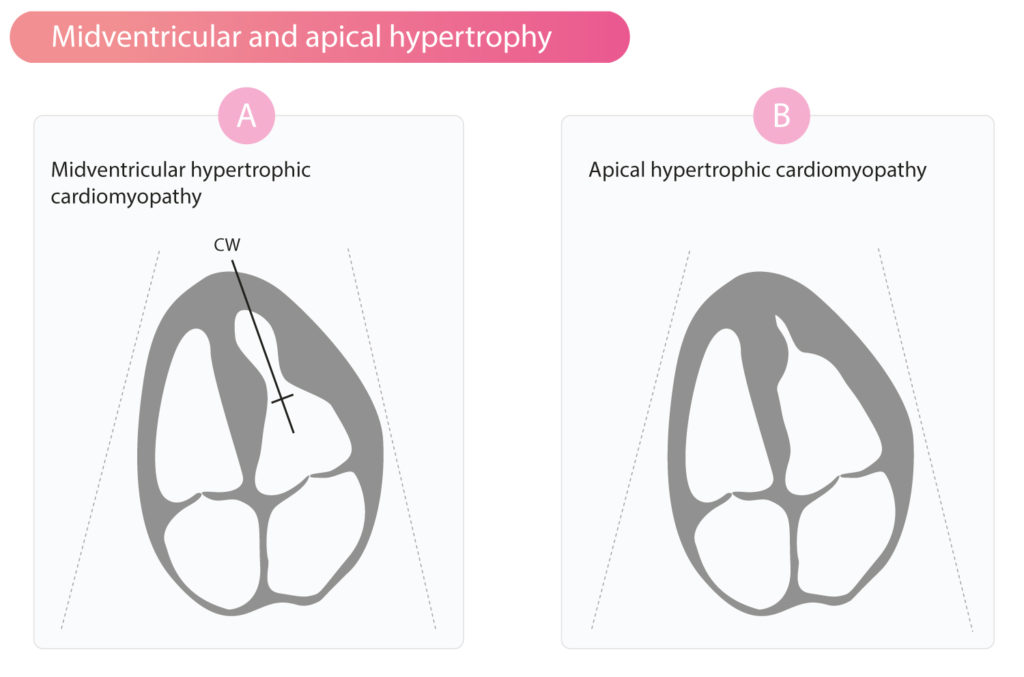
HCM kan manifestere seg med obstruksjon på andre nivåer enn utløpstrakten. Ved midventrikulær hypertrofi oppstår obstruksjonen midt i ventrikkelen («timeglassform»), noe som kan gi opphav til apikale aneurismer. Dette påvises ved CW-doppler der gradienten måles midt i kaviteten (figur 4A). Ved apikal hypertrofi («Yamaguchi-syndrom») er hypertrofien begrenset til apex. Dette gir ventrikkelhulen et karakteristisk «spar-ess» (Ace of Spades) utseende i diastole ved kontrast-ekko eller ventrikulografi, som vist i figur 4B. Apikal HCM er ofte oversett ved standard ekkokardiografi hvis man ikke fokuserer på apex. Pasienter med apikal HCM har ofte dype, negative T-bølger («gigantiske T-bølger» > 10 mm) i de prekordiale avledningene (V3-V6) på EKG.
Diastolisk funksjon ved hypertrofisk kardiomyopati
Diastolisk dysfunksjon er nærmest universelt til stede ved HCM og er en hovedårsak til symptomer som dyspné. Det hypertrofiske myokardiet har redusert relaksasjonsevne og økt stivhet (redusert compliance), noe som krever høyere fyllingstrykk. Ekkokardiografisk ser man ofte:
- Forlenget isovolumetrisk relaksasjonstid (IVRT).
- Redusert e’ (vevsdoppler) i mitralringen.
- Økt E/e’-ratio (korrelerer med fyllingstrykk).
- Venstre atriedilatasjon (Volumindeks > 34 ml/m²).
Behandling og oppfølging
Behandlingen av HCM har som mål å lindre symptomer og forebygge plutselig hjertedød.
Medikamentell behandling: For symptomatiske pasienter (særlig med obstruksjon) er ikke-vasodilaterende betablokkere (f.eks. metoprolol eller bisoprolol) førstevalg. De reduserer hjertefrekvensen (gir lenger fyllingstid) og reduserer kontraktiliteten (minsker LVOT-gradienten). Alternativer er kalsiumblokkere av typen Verapamil eller Diltiazem. For pasienter med vedvarende obstruksjon kan Disopyramid legges til. En ny klasse legemidler, myosin-hemmere (f.eks. Mavacamten), retter seg direkte mot sykdomsmekanismen ved å redusere hyperkontraktilitet og har vist lovende resultater for obstruktiv HCM.
Invasiv behandling (Septumreduserende terapi): Pasienter med HOCM som forblir symptomatiske (NYHA klasse III-IV) tross optimal medisinering, og som har en LVOT-gradient > 50 mmHg, kan vurderes for:
- Kirurgisk myektomi (Morrow-prosedyre): Kirurgen fjerner en del av det hypertrofiske septum via aorta. Dette er «gullstandarden».
- Alkoholseptumablasjon (ASA): Kontrollert infarkt i septum indusert ved injeksjon av alkohol i en septalarterie via kateter.
Plutselig hjertedød (SCD) og risikovurdering
Selv om de fleste med HCM har normal forventet levetid, er sykdommen en viktig årsak til plutselig hjertestans. Risikostratifisering er derfor essensielt. European Society of Cardiology (ESC) anbefaler bruk av HCM Risk-SCD kalkulatoren for å beregne 5-års risiko for hjertestans. Denne danner grunnlaget for beslutning om implantasjon av hjertestarter (ICD) som primærprofylakse.
ICD anbefales sterkt (Klasse I) hos pasienter som har overlevd hjertestans eller vedvarende VT (sekundærprofylakse). Ved primærprofylakse vurderes ICD hvis 5-års risikoen er ≥ 6 % (høy risiko), og kan vurderes ved risiko mellom 4-6 %.
Tabell 2. Risikofaktorer som inngår i totalvurderingen (basert på ESC og AHA guidelines)
| Klassiske risikofaktorer |
| Tidligere hjertestans eller spontan vedvarende VT |
| Familiehistorie med plutselig hjertestans (særlig hos nære slektninger < 40 år) |
| Uforklart synkope (særlig siste 6 mnd) |
| Ikke-vedvarende ventrikulær takykardi (NSVT) på Holter |
| Maksimal venstre ventrikkel veggtykkelse ≥ 30 mm |
| Abnorm blodtrykksrespons under arbeidstest (manglende stigning eller fall) |
| Andre faktorer som påvirker risiko (MR og Genetikk) |
| Omfattende fibrose på MR (LGE > 15 % av LV masse) |
| Venstre ventrikkel ejeksjonsfraksjon (LVEF) < 50 % |
| Apikalt aneurisme |
Fallgruver
SAM forekommer også hos personer som ikke har HOCM. Pasienter med hypertensiv hjertesykdom kan utvikle SAM i forbindelse med hypovolemi eller bruk av inotrope medikamenter (f.eks. dobutamin under stress-ekko). Det er også viktig å unngå vasodilaterende midler (som ACE-hemmere, nitroglyserin og dihydropyridin-kalsiumblokkere) hos pasienter med betydelig LVOT-obstruksjon, da dette kan forverre gradienten og utløse synkope.
Nedenfor følger supplerende materiale beregnet på lesere som er interessert i genene som forårsaker HCM. Ca. 40-60 % av pasienter med HCM har en identifiserbar mutasjon i sarkomergener. Se Marian et al. for detaljer (1).
Etablerte kausale gener for HCM
Etablert kausalt gen for HCM (store familier)
| Gen | Protein | Funksjon |
| MYH7 |
β-Myosin tung kjede |
ATPase-aktivitet, kraftgenerering. Hyppig årsak (ca 15-25%). |
| MYBPC3 |
Myosin-bindende protein C |
Strukturelt protein og regulator av hjertesammentrekning. Hyppig årsak (ca 15-25%). |
| TNNT2 |
Hjerte troponin T |
Regulator av aktomyosininteraksjon. Assosiert med mild hypertrofi men høy arytmirisiko. |
| TNNI3 |
Hjertets troponin I |
Inhibitor av aktomyosin-interaksjon |
| TPM1 | α-Tropomyosin | Plasserer troponinkomplekset på hjertets aktin |
| ACTC1 |
Hjerte α-aktin |
Aktomyosin interaksjon |
| MYL2 |
Regulatorisk myosin lettkjede |
Myosin tungkjede 7-bindende protein |
| MYL3 |
Essensiell myosin lettkjede |
Myosin tungkjede 7-bindende protein |
| CSRP3 | Cystein- og glycinrikt protein 3 | Muskel-LIM-protein (MLP), et Z-diskprotein |
Sannsynlige kausale gener for HCM (små familier)
| Gen | Protein | Funksjon |
| FHL1 |
Fire-og-en-halv LIM-domener 1 |
Muskelutvikling og hypertrofi |
| MYOZ2 | Myozenin 2 (calsarcin 1) | Z-diskprotein |
| PLN | Fosfolamban |
Regulator av kalsium i sarkoplasmatisk retikulum |
| TCAP | Tcap (teletonin) | Titin-kappeprotein |
| TRIM63 | Muskelringfingerprotein 1 |
E3-ligase av proteasom ubiquitinsystem |
| TTN | Titin | Sarkomerfunksjon |
Gener assosiert med HCM (små familier og sporadiske tilfeller)
| ACTN2 | Aktinin, α2 | Z-diskprotein |
| ANKRD1 | Ankyrin repetisjonsdomene 1 |
En negativ regulator av hjertigener |
| CASQ2 | Kalsekvestrin 2 | Kalsiumbindende protein |
| CAV3 | Caveolin 3 | Et caveolae-protein |
| JPH2 | Junctophilin-2 | Intracellulær kalsiumsignalering |
| LDB3 | Lim-domene-binding 3 | Z-diskprotein |
| MYH6 | Myosin tungkjede α |
Sarkomer protein som uttrykkes i lave nivåer i det voksne menneskehjertet |
| MYLK2 | Myosin lettkjede-kinase 2 | Fosforylerer myosin lettkjede 2 |
| NEXN | Nexilin | Z-skiveprotein |
| TNNC1 | Hjertetroponin C |
Kalsiumsensitiv regulator av myofilamentfunksjon |
| VCL | Vinculin | Z-diskprotein |
Referanser
Elliott PM, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy.