Hjertesvikt: Årsaker, typer, diagnose, behandling og håndtering
Hjertesvikt
Hjertesvikt er et betydelig globalt folkehelseproblem og en av de hyppigste årsakene til sykehusinnleggelse i den vestlige verden. Mens forekomsten av koronar hjertesykdom og akutt hjerteinfarkt har blitt redusert med omtrent 50 % i løpet av de siste tiårene, har prevalensen av hjertesvikt holdt seg stabil eller økende. Nye data indikerer en bekymringsfull økning i forekomsten av hjertesvikt også blant yngre voksne (Nabel et al., Savarese et al.). Dette representerer et paradoks, særlig i lys av de markante forbedringene i behandlingen av arteriell hypertensjon og iskemisk hjertesykdom, som tradisjonelt anses som de viktigste etiologiske faktorene. Det antas at den aldrende befolkningen, økt overlevelse etter hjerteinfarkt, samt den økte forekomsten av fedme, diabetes og dysglykemi driver frem hjertesviktpandemien. Det er nå bred enighet om at hjertesvikt utgjør en av de hyppigste og mest alvorlige komplikasjonene ved diabetes (Shah et al., McMurray et al.).
Den farmakologiske behandlingen av hjertesvikt gjennomgikk en revolusjon i løpet av 1980- og 1990-årene. Introduksjonen av ACE-hemmere (angiotensinkonverterende enzym) og etter hvert betablokkere endret prognosen dramatisk. Da pionerene Waagstein, Hjalmarsson og Swedberg foreslo å bruke betablokkere – som har negative inotrope og negative kronotrope effekter – ved hjertesvikt, møtte de massiv skepsis i fagmiljøet. Deres banebrytende arbeid viste imidlertid at betablokkere ikke bare lindrer symptomer, men også reverserer venstre ventrikkels remodellering og reduserer dødeligheten betydelig. Senere ble angiotensinreseptorblokkere (ARB) og mineralokortikoidreseptorantagonister (MRA) etablert som standardbehandling. Etter en periode med færre nyvinninger, kom PARADIGM-HF-studien i 2014, som introduserte ARNI (Angiotensin-Neprilysin Inhibitors). De siste årene har introduksjonen av SGLT2-hemmere (natrium-glukose-kotransportør 2-hemmere) ytterligere sementert «de fire søylene» i moderne hjertesviktbehandling.
Til tross for medisinske fremskritt er hjertesvikt fortsatt en alvorlig tilstand med høy mortalitet. Femårsoverlevelsen etter første sykehusinnleggelse for hjertesvikt er ca. 50–60 %, noe som er dårligere enn ved mange vanlige kreftformer (Stewart et al.). Tilstanden er sterkt invalidiserende med betydelig redusert livskvalitet. Omtrent halvparten av pasientene med hjertesvikt dør plutselig som følge av maligne ventrikulære arytmier (ventrikkeltakykardi, ventrikkelflimmer), mens den andre halvparten dør av pumpesvikt. Tidlig diagnose, optimal titrering av medisiner og bruk av moderne apparatbehandling (ICD/CRT) er avgjørende for å bedre prognosen.
I henhold til gjeldende retningslinjer fra European Society of Cardiology (ESC) og American Heart Association (AHA)/American College of Cardiology (ACC), klassifiseres hjertesvikt i tre kategorier basert på venstre ventrikkels ejeksjonsfraksjon (LVEF): HFpEF, HFmrEF og HFrEF. Historisk sett er nesten all evidensbasert behandling utviklet for HFrEF (hjertesvikt med redusert ejeksjonsfraksjon). HFpEF (hjertesvikt med bevart ejeksjonsfraksjon) har lenge vært en terapeutisk utfordring, men nyere studier med SGLT2-hemmere har vist lovende resultater også for denne gruppen. HFmrEF (hjertesvikt med lett redusert ejeksjonsfraksjon), tidligere kalt «mid-range», representerer en mellomgruppe som ofte behandles likt som HFrEF.
Tabell 1. Klassifisering av hjertesvikt (ESC Guidelines).
| Type | Beskrivelse | Ejeksjonsfraksjon (%) |
|---|---|---|
| HFrEF | Hjertesvikt med redusert ejeksjonsfraksjon (Reduced) | ≤40% |
| HFmrEF | Hjertesvikt med lett redusert ejeksjonsfraksjon (Mildly Reduced) | 41-49% |
| HFpEF | Hjertesvikt med bevart ejeksjonsfraksjon (Preserved) | ≥50% |
Ved HFrEF er venstre ventrikkels systoliske funksjon (kontraktilitet) betydelig nedsatt. Ved HFpEF foreligger kliniske tegn på hjertesvikt til tross for normal eller nær normal pumpeevne (EF ≥50 %); her er problemet primært fyllingsmotstand og diastolisk dysfunksjon. HFmrEF utgjør en «gråsone», men pasientene i denne gruppen har ofte en underliggende iskemisk etiologi og deler mange trekk med HFrEF-populasjonen.
Patofysiologien bak HFpEF er kompleks og heterogen, ofte drevet av komorbiditeter som hypertensjon, fedme og atrieflimmer. Diastolisk dysfunksjon (stivt hjerte) er et kardinaltegn.
Majoriteten av pasienter med hjertesvikt er multimorbide. Vanlige ledsagende sykdommer inkluderer iskemisk hjertesykdom, atrieflimmer, kronisk nyresykdom (CKD), anemi, jernmangel, KOLS og diabetes. Det kardiorenale syndromet, hvor hjertesvikt og nyresvikt gjensidig forverrer hverandre, er spesielt utfordrende klinisk og assosiert med dårlig prognose. Polyfarmasi er regelen snarere enn unntaket, noe som krever nøye oppfølging med tanke på interaksjoner og bivirkninger.
Epidemiologi ved hjertesvikt
- Prevalensen av hjertesvikt er ca. 1–2 % i den voksne befolkningen i utviklede land, men stiger bratt med alderen.
- Blant personer over 70 år har mer enn 10 % hjertesvikt.
- Livstidsrisikoen for å utvikle hjertesvikt er ca. 20 % for en 40-åring, og risikoen øker ytterligere ved tilstedeværelse av hypertensjon.
- Hjertesvikt er den hyppigste årsaken til sykehusinnleggelse hos personer over 65 år.
- Selv om insidensen av HFrEF kan være stabil eller synkende, er forekomsten av HFpEF økende, sannsynligvis drevet av demografiske endringer og livsstilsfaktorer.
- Prognosen er fortsatt alvorlig; mortaliteten er høyere enn ved tarmkreft, brystkreft og prostatakreft.
Prognose
Tabell 2. Langtidsoverlevelse etter sykehusinnleggelse for hjertesvikt.
| Tid siden sykehusinnleggelse | Overlevelse (%) |
|---|---|
| 1 år | ca. 70-75% |
| 5 år | ca. 50-60% |
Dødeligheten ved alvorlig hjertesvikt (NYHA klasse IV) er svært høy uten avansert behandling (f.eks. transplantasjon eller LVAD). Plutselig hjertedød er den vanligste dødsårsaken hos pasienter med mildere symptomer (NYHA II), mens pasienter med alvorlig svikt oftere dør av progredierende pumpesvikt.
Årsaker til hjertesvikt
Mekanismer for hjertesvikt
Hjertesvikt er ikke en enkeltstående sykdom, men et klinisk syndrom som oppstår som sluttstadiet av mange ulike hjertesykdommer. Etiologien kan grovt inndeles i:
- Myokardial sykdom: Iskemisk hjertesykdom, toksisk skade, inflammasjon eller genetiske kardiomyopatier.
- Unormale belastningsforhold: Hypertensjon (trykkbelastning), klaffefeil (volum- eller trykkbelastning).
- Arytmier: Både takykardier og bradykardier.
Koronararteriesykdom og hjerteinfarkt
Iskemisk hjertesykdom er den dominerende årsaken til HFrEF i vestlige land. Et stort hjerteinfarkt (STEMI) fører til tap av viabelt myokard, arrdannelse og endret geometri i venstre ventrikkel. Også gjentatte mindre infarkter eller kronisk iskemi («hibernating myocardium») kan føre til sviktende pumpefunksjon.
Hypertensjon
Hypertensjon er en folkesykdom og en ledende risikofaktor for utvikling av både HFrEF og spesielt HFpEF. Vedvarende høyt blodtrykk øker etterbelastningen (afterload), noe som tvinger venstre ventrikkel til å hypertrofiere (LVH) for å opprettholde veggspenningen. Over tid blir ventrikkelveggen stivere (diastolisk dysfunksjon), og i senere stadier kan ventrikkelen dilatere og miste kontraktilitet.
Diabetes og metabolsk sykdom
Diabetes type 2 er en uavhengig risikofaktor for hjertesvikt. Pasienter med diabetes har 2-5 ganger økt risiko for å utvikle hjertesvikt sammenlignet med ikke-diabetikere. Diabetisk kardiomyopati er en tilstand preget av interstitiell fibrose og ventrikkelstivhet, uavhengig av koronarsykdom og hypertensjon. Optimal glukosekontroll er viktig, men valget av antidiabetika er avgjørende; SGLT2-hemmere har vist seg å forebygge hjertesvikt hos risikopasienter.
Arytmier som forårsaker hjertesvikt
Atrieflimmer er den vanligste arytmien ved hjertesvikt. Sammenhengen er toveis: hjertesvikt disponerer for atrieflimmer gjennom atriedilatasjon og økt fyllingstrykk, og atrieflimmer forverrer hjertesvikt gjennom tap av atriokontraksjon («atrial kick») og rask, uregelmessig ventrikkelaksjon.
Takykardi-indusert kardiomyopati er en potensielt reversibel årsak til hjertesvikt som oppstår ved vedvarende høy hjertefrekvens (f.eks. ukontrollert atrieflimmer eller ventrikulære ekstrasystoler >10-20 % av totale slag). Frekvenskontroll eller ablasjon kan ofte normalisere venstre ventrikkelfunksjon.
Strukturell hjertesykdom
Klaffefeil er en viktig årsak til hjertesvikt, spesielt hos eldre:
- Aortastenose (AS): Gir trykkbelastning og LVH.
- Mitralinsuffisiens (MR): Gir volumoverbelastning. Kan være primær (klaffefeil) eller sekundær til ventrikkeldilatasjon ved hjertesvikt (funksjonell MR), noe som skaper en ond sirkel.
Hjertetoksisitet
Rusmidler
Alkoholisk kardiomyopati er en form for dilatert kardiomyopati som kan reverseres ved totalavholdenhet i tidlig fase. Kokain og amfetamin kan forårsake akutt vasospasme, iskemi, samt direkte toksisk myokardskade og fibrose.
Kreftmedisiner og strålebehandling
Kardio-onkologi er et voksende felt. Antracykliner (f.eks. Doxorubicin) er velkjent for å kunne gi irreversibel myokardskade, ofte doseavhengig. Nyere målrettede terapier (f.eks. HER2-hemmere som Trastuzumab) kan gi reversibel svikt. Immunterapi (check-point-hemmere) kan i sjeldne tilfeller utløse fulminant myokarditt.
Genetiske årsaker til hjertesvikt
Ved idiopatisk kardiomyopati, spesielt hos unge pasienter, bør genetisk utredning vurderes. Mutasjoner i gener som koder for sarkomerproteiner (f.eks. titin, myosin, troponin) eller cytoskjelettet (f.eks. lamin A/C) er vanlige funn ved familiær dilatert kardiomyopati (DCM).
Andre årsaker til hjertesvikt
- Infiltrative sykdommer: Amyloidose (både AL- og transthyretin-amyloidose) er en underdiagnostisert årsak til HFpEF og restriktiv kardiomyopati, spesielt hos eldre menn med karpaltunnelsyndrom og lumbal spinalstenose i anamnesen.
- Immunologiske/Inflammatoriske: Sarkoidose, SLE, kjempecellemyokarditt.
- Endokrine: Tyreoideasykdommer (både hypo- og hypertyreose), feokromocytom.
- Høy-output svikt: Alvorlig anemi, tyreotoksikose, arteriovenøse shunter (f.eks. dialysefistel), Beriberi (tiaminmangel).
Remodellering av hjertet
Hjertets remodellering er den sentrale patofysiologiske prosessen ved progresjon av hjertesvikt. Det innebærer endringer i genekspresjon, molekylære mekanismer og cellulær struktur som fører til endringer i hjertets størrelse, form og funksjon. Ved HFrEF ser man typisk en dilatasjon av venstre ventrikkel, veggfortynning og endring fra en elliptisk til en mer sfærisk form. Dette reduserer pumpeeffektiviteten og øker veggspenningen, som igjen stimulerer til ytterligere remodellering.
Prosessen drives i stor grad av nevrohormonell aktivering, primært det sympatiske nervesystemet (SNS) og renin-angiotensin-aldosteron-systemet (RAAS). Mens disse systemene akutt opprettholder blodtrykk og perfusjon, er kronisk aktivering maladaptiv og direkte toksisk for myokard. Behandling med RAAS-blokkere (ACEi/ARB/ARNI), betablokkere og MRA har som hovedmål å reversere denne prosessen («reverse remodeling»).
Symptomer på hjertesvikt
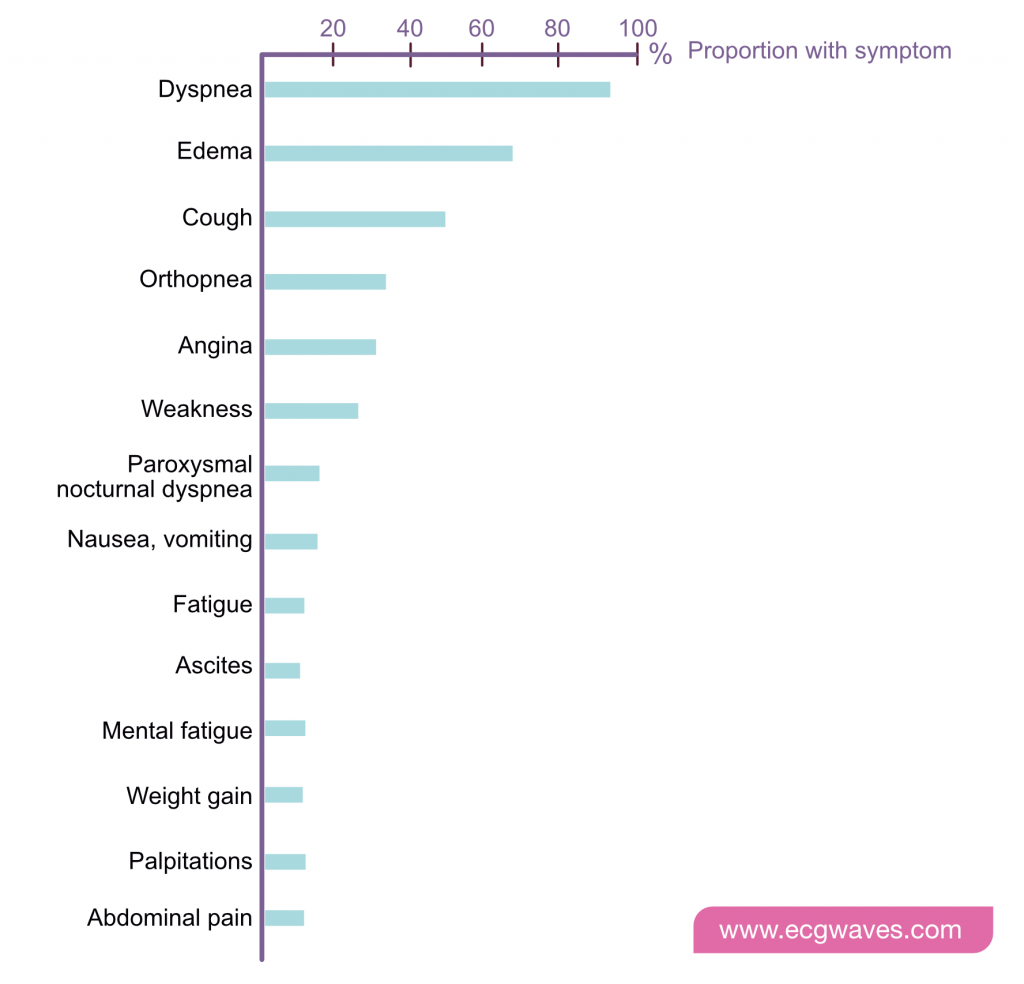
Kardinalsymptomene ved hjertesvikt er dyspné og tretthet, som begrenser fysisk utfoldelse, samt væskeretensjon som kan føre til lungeødem og perifere ødemer. Den kliniske presentasjonen varierer fra asymptomatisk nedsatt venstre ventrikkelfunksjon til kardiogent sjokk.
Typiske symptomer
- Dyspné ved anstrengelse: Ofte det tidligste symptomet.
- Ortopné: Dyspné i liggende stilling, lindres ved å bygge opp med puter (øker venøs retur og lungekongestion når man ligger flatt).
- Paroksysmal nattlig dyspné (PND): Pasienten våkner med lufthunger og angst, må sitte opp eller gå til vinduet for å få luft. Spesifikt for hjertesvikt.
- Redusert fysisk yteevne og fatigue: Skyldes redusert minuttvolum og perfusjon til skjelettmuskulatur.
- Perifere ødemer: Symmetriske hevelser rundt ankler og legger, som forverres utover dagen.
Akutt vs. Kronisk hjertesvikt
Pasienter med kronisk hjertesvikt kan oppleve akutt forverring (dekompensering), ofte utløst av faktorer som infeksjon, manglende etterlevelse av medisiner/diett (salt/væske), iskemisk hendelse, arytmi (atrieflimmer) eller bruk av NSAIDs. Ved akutt hjertesvikt dominerer ofte tegn på stuvning (lungeødem) og/eller hypoperfusjon (kald svette, lavt blodtrykk, oliguri).
NYHA funksjonsklassifisering
NYHA-klassifiseringen er et subjektivt mål på pasientens funksjonsnivå og symptomer, men har sterk prognostisk verdi og brukes til å styre behandling (f.eks. indikasjon for CRT/ICD/ARNI).
Tabell 3. New York Heart Associations (NYHA) funksjonsklassifisering
| NYHA-klasse | Definisjon |
|---|---|
| I | Ingen begrensning av fysisk aktivitet. Vanlig fysisk belastning gir ikke symptomer. |
| II | Lett begrensning av fysisk aktivitet. Ingen symptomer i hvile. Vanlig fysisk aktivitet (gå i trapper, oppoverbakke) gir symptomer. |
| III | Markert begrensning av fysisk aktivitet. Ingen symptomer i hvile. Mindre enn vanlig aktivitet (gå på flatmark, av- og påkledning) gir symptomer. |
| IV | Symptomer i hvile. Enhver fysisk aktivitet forverrer ubehaget. Pasienten er ofte sengeliggende eller bundet til stol. |
Kliniske funn ved undersøkelse
- Halsvenestuvning: Økt trykk i vena jugularis externa (eller interna) reflekterer økt høyresidig fyllingstrykk. Hepatojugulær refluks (trykk mot leveren gir vedvarende stuvning på halsen) er et tidlig tegn på høyresidig svikt.
- Lungeauskultasjon: Knatrelyder (krepitasjoner), oftest basalt bilateralt, indikerer lungeødem. Merk at ved kronisk hjertesvikt kan lymfedrenasjen ha kompensert, slik at pasienten har høyt fyllingstrykk uten hørbare knatrelyder («tørt lungeødem» på auskultasjon). Pleuravæske gir dempning ved perkusjon.
- Hjerteauskultasjon: Tredje hjertelyd (S3), «ventrikkelgalopp», er et spesifikt tegn på volumoverbelastning og sviktende ventrikkel hos voksne. Bilyder kan avsløre klaffefeil (f.eks. systolisk bilyd ved mitralinsuffisiens).
- Perifere ødemer: «Pitting»-ødemer over ankler, pretibialt eller over sacrum hos sengeliggende.
- Hepatomegali og ascites: Tegn på langtkommet høyresidig svikt.
Diagnostisering av hjertesvikt
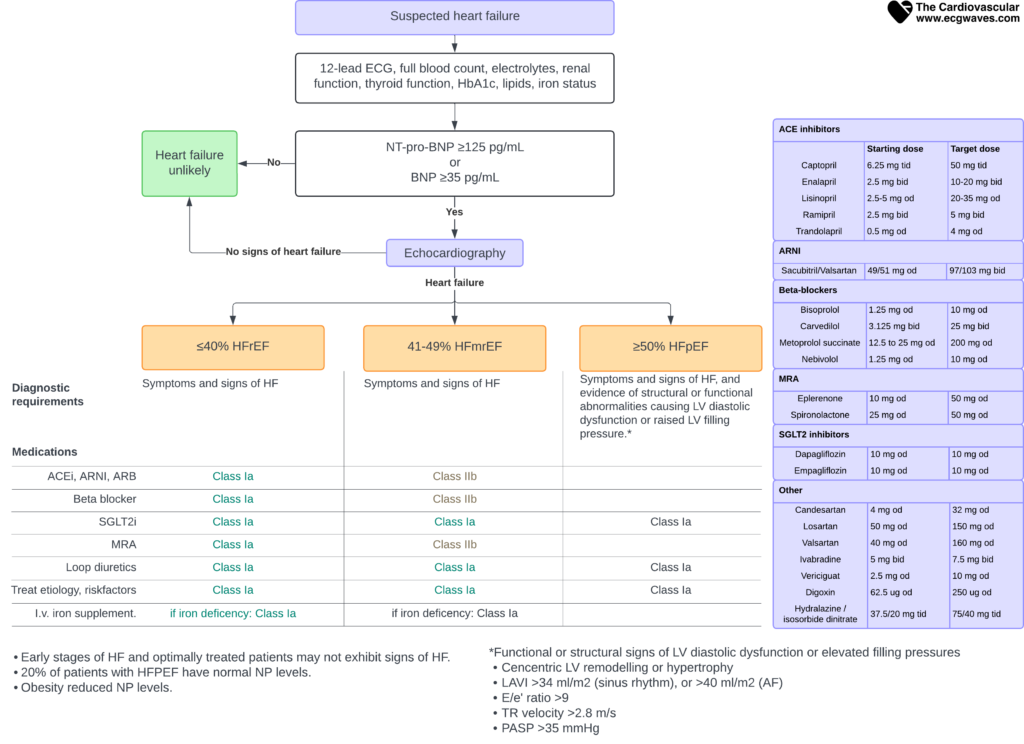
Diagnostikken baserer seg på en kombinasjon av kliniske symptomer, objektive funn og spesialundersøkelser. Mistanken vekkes i primærhelsetjenesten, men endelig diagnose og fenotyping krever oftest ekkokardiografi.
Figur 2. Diagnostisk flytskjema ved mistanke om hjertesvikt.
Biomarkører: NT-proBNP og BNP
Måling av natriuretiske peptider er den viktigste innledende testen («rule-out» test). Disse peptidene frigjøres fra myokard ved strekk og økt veggspenning. Lave verdier gjør hjertesvikt svært usannsynlig.
En normal NT-proBNP (<125 pg/mL) utelukker hjertesvikt med høy sikkerhet (høy negativ prediktiv verdi). Høye verdier krever bekreftelse med ekkokardiografi, da flere tilstander enn hjertesvikt kan gi stigning.
Tabell 4. Beslutningsgrenser for NT-proBNP
| Klinisk situasjon | Terskelverdi for utelukkelse |
|---|---|
| Ikke-akutt (poliklinisk/fastlege) | NT-proBNP < 125 pg/mL |
| Akutt (sykehusinnleggelse) | NT-proBNP < 300 pg/mL |
Vær oppmerksom på at:
- Atrieflimmer gir i seg selv forhøyet NT-proBNP (terskelverdiene bør tolkes med forsiktighet).
- Fedme kan gi falskt lave verdier.
- Nyresvikt gir økte verdier pga. redusert utskillelse.
- Pasienter på ARNI (Entresto) vil ha falskt forhøyet BNP (men ikke NT-proBNP), derfor er NT-proBNP foretrukket ved oppfølging av disse pasientene.
EKG ved hjertesvikt
EKG bør tas av alle. Et helt normalt EKG gjør diagnosen systolisk hjertesvikt svært lite sannsynlig. Se etter tegn på tidligere hjerteinfarkt (Q-bølger), venstre ventrikkelhypertrofi, venstre grenblokk (LBBB) og arytmier (spesielt atrieflimmer).
Ekkokardiografi
Ekkokardiografi er gullstandarden for diagnose og klassifisering. Undersøkelsen gir svar på:
- LVEF (Ejeksjonsfraksjon): Avgjør om det er HFrEF, HFmrEF eller HFpEF.
- Strukturelle forhold: Ventrikkelstørrelse, veggtykkelse (hypertrofi), atriestørrelse.
- Diastolisk funksjon: Vurderes ved E/e’-ratio, trikuspidalretur-hastighet og atriestørrelse.
- Klaffefunksjon: Stenose eller insuffisiens.
Hjerte-MR
MR av hjertet er nyttig ved vanskelige ekkoforhold og er suverent for å avklare etiologi (vevskarakteristikk). Det kan skille mellom iskemisk arrvev, inflammasjon (myokarditt) og infiltrative sykdommer som amyloidose eller hemokromatose.
Behandling av hjertesvikt
Målet med behandlingen er todelt: 1) Bedre prognosen (overlevelse) og 2) Redusere symptomer og sykehusinnleggelser. Moderne behandling av HFrEF baserer seg på «De fire søylene», som alle bør titreres opp til måldoser så raskt som mulig.
Behandling av HFrEF (LVEF ≤40%)
De fire grunnpilarene i medisinsk behandling er:
- RAAS-hemmer: Fortrinnsvis ARNI (sakubitril/valsartan) eller ACE-hemmer.
- Betablokker.
- Mineralokortikoidreseptorantagonist (MRA).
- SGLT2-hemmer.

Diuretika
Diuretika (f.eks. Furosemid, Bumetanid) er avgjørende for symptomlindring ved væskeretensjon (ødemer, dyspné), men har ingen bevist effekt på langtidsoverlevelse alene. Dosen justeres etter klinisk respons («tørrvekt»). Kombinasjon av loop-diuretika og tiazider (f.eks. Metolazon) kan være nødvendig ved diuretikaresistens, men krever nøye elektrolyttovervåkning.
ACE-hemmere (ACEi) og Betablokkere
Disse legemidlene utgjorde lenge grunnstammen i behandlingen. De bør startes i lave doser og titreres opp til måldose (eller maksimal tolerert dose) med 2-4 ukers mellomrom. Betablokkere (Bisoprolol, Karvedilol, Metoprolol depot) skal kun startes når pasienten er hemodynamisk stabil (ikke ved akutt dekompensering med hypoperfusjon).
Aldosteronantagonister (MRA)
Spironolakton eller Eplerenon anbefales til alle symptomatiske pasienter (NYHA II-IV) med EF ≤40 % til tross for behandling med ACEi og betablokker. Viktig: Monitorer kalium og nyrefunksjon, spesielt ved oppstart og doseøkning.
SGLT2-hemmere
Dapagliflozin og Empagliflozin representerer det største gjennombruddet i hjertesviktbehandling på mange år. Opprinnelig utviklet som diabetesmedisiner, viste studiene DAPA-HF og EMPEROR-Reduced at disse reduserer risikoen for død og sykehusinnleggelse ved hjertesvikt betydelig, uavhengig av om pasienten har diabetes eller ikke. Virkningsmekanismen er ikke fullt klarlagt, men inkluderer natriurese, redusert preload/afterload og bedret myokardiell energiomsetning. De har en klasse I-anbefaling, krever ingen opptitrering (fast dose 10 mg x 1) og tåles godt.
ARNI (Sakubitril/Valsartan)
ARNI er overlegen ACE-hemmere når det gjelder reduksjon av mortalitet og sykehusinnleggelse (PARADIGM-HF). ESC-retningslinjene anbefaler ARNI som erstatning for ACE-hemmer hos pasienter som fortsatt har symptomer, men det åpnes også for å starte ARNI direkte (de novo) hos sykehusinnlagte pasienter («PIONEER-HF» studien). Husk 36 timers utvaskingsperiode ved bytte fra ACE-hemmer for å unngå angioødem.
Behandling av HFpEF (LVEF ≥50%)
Tidligere fantes ingen behandling med dokumentert effekt på overlevelse ved HFpEF. Dette har endret seg. Resultater fra store studier (DELIVER, EMPEROR-Preserved) har vist at SGLT2-hemmere (Dapagliflozin, Empagliflozin) reduserer risikoen for sykehusinnleggelse og kardiovaskulær død også hos denne pasientgruppen. SGLT2-hemmere er derfor nå en Klasse I-anbefaling for alle pasienter med hjertesvikt, uavhengig av ejeksjonsfraksjon.
For øvrig rettes behandlingen mot:
- Symptomlindring med diuretika ved væskeretensjon.
- Behandling av komorbiditet: Aggressiv blodtrykkskontroll, frekvenskontroll ved atrieflimmer, og behandling av iskemi.
Andre behandlinger
Jernmangel og behandling
Jernmangel er svært vanlig ved hjertesvikt (opptil 50 % av pasientene) og er assosiert med redusert funksjonsevne og økt risiko for sykehusinnleggelse, uavhengig av om pasienten har anemi. Alle pasienter med hjertesvikt bør screenes med Ferritin og Transferrinmetning (TSAT). Intravenøs jernbehandling (f.eks. med jernkarboksymaltose eller jern-derisomaltose) anbefales for å bedre symptomer og livskvalitet hos pasienter med Ferritin <100 µg/L, eller Ferritin 100-299 µg/L hvis TSAT <20 %.
Apparatbehandling (CRT og ICD)
Resynkroniseringsbehandling (CRT)
Hos pasienter med HFrEF og bredt QRS-kompleks (særlig venstre grenblokk, LBBB) er kontraksjonen i venstre ventrikkel asynkron, noe som reduserer pumpeeffekten ytterligere. CRT innebærer at man legger inn en ekstra ledning til venstre ventrikkel (via sinus coronarius) for å stimulere begge ventriklene samtidig. Dette bedrer symptomer, reverserer remodellering og øker overlevelsen.
Sterkest indikasjon: Sinusrytme, LBBB morfologi, og QRS-bredde ≥150 ms (Klasse I anbefaling). Ved QRS 130-149 ms eller ikke-LBBB er indikasjonen svakere.
Implanterbar hjertestarter (ICD)
ICD forebygger plutselig død ved å behandle maligne arytmier. Indikasjonen er sterkest ved iskemisk etiologi (etter hjerteinfarkt). Ved ikke-iskemisk kardiomyopati er effekten på totaldødelighet mer omdiskutert etter DANISH-studien, men ICD anbefales fortsatt til utvalgte pasienter, særlig yngre med lav komorbiditet.
- Sekundærprofylakse: Etter gjennomgått hjertestans eller dokumentert alvorlig ventrikkeltakykardi.
- Primærprofylakse: Ved symptomatisk hjertesvikt (NYHA II-III) og LVEF ≤35 % til tross for minst 3 måneders optimal medisinsk behandling.
Utvalgte referanser og retningslinjer
McDonagh TA, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021.
Heidenreich PA, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. J Am Coll Cardiol. 2022.
McMurray JJV, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction (DAPA-HF). N Engl J Med 2019.
Packer M, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure (EMPEROR-Reduced). N Engl J Med 2020.
Anker SD, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction (EMPEROR-Preserved). N Engl J Med 2021.