Beregning av hemodynamiske parametere ved hjelp av ultralyd
Hemodynamikk er læren om fysikkens lover som styrer blodstrømmen i det kardiovaskulære systemet. Forståelse av disse fysiske prinsippene er fundamentalt i moderne ekkokardiografi. Mens konvensjonell todimensjonal (2D) ekkokardiografi gir anatomisk informasjon, er det Doppler-teknikker som muliggjør kvantifisering av fysiologiske variabler som hastigheter, volumer, og trykkgradienter. Disse teknikkene gjør det mulig å beregne nær alle klinisk relevante hemodynamiske parametere non-invasivt. Historisk sett, før Doppler-teknologiens inntog, var høyresidig hjertekateterisering (med Swan-Ganz-kateter/lungearteriekateter) gullstandarden for hemodynamisk vurdering. I dag anses hemodynamiske målinger basert på Doppler-ekkokardiografi som svært pålitelige og korrelerer godt med invasive målinger, forutsatt korrekt teknisk utførelse. Doppler-metodikk har derfor i stor grad erstattet diagnostisk kateterisering for rutinemessig evaluering av klaffesykdom og intrakardiale trykk.
Denne artikkelen gjennomgår de sentrale hemodynamiske prinsippene og hvordan disse anvendes klinisk for å beregne slagvolum (SV), hjerteminuttvolum (CO), intrakardiale trykk, samt kvantifisering av stenosealvorlighet og regurgitasjonsvolumer. Disse beregningene baserer seg på matematiske ligninger avledet fra fluidmekanikk, tilpasset for klinisk bruk. For indremedisinere og kardiologer er det essensielt å forstå begrensningene og feilkildene i disse prinsippene for å kunne tolke ekkokardiografiske funn korrekt. I moderne ultralydmaskiner utføres de komplekse beregningene automatisk, men validiteten avhenger av undersøkerens evne til å innhente optimale rådata.
Dopplereffekten
Det grunnleggende prinsippet for alle hastighetsmålinger i ekkokardiografi er dopplereffekten, som er detaljert beskrevet i egne kapitler (se Dopplereffekten og Doppler-ekkokardiografi). Nedenfor følger en oppsummering fokusert på den hemodynamiske applikasjonen.
Dopplereffekten utnyttes til å bestemme blodlegemenes hastighet og retning relativt til ultralydproben. Dette fenomenet oppstår fordi lydbølger som treffer et objekt i bevegelse (i dette tilfellet erytrocytter), reflekteres med en endret frekvens. Når ultralydbølger treffer erytrocytter som beveger seg mot lydkilden (transduseren), komprimeres bølgene, og signalet reflekteres med en høyere frekvens enn den utsendte frekvensen. Motsatt vil erytrocytter som beveger seg bort fra lydkilden, reflektere lydbølger med en lavere frekvens. Differansen mellom utsendt frekvens (f0) og reflektert frekvens (fr) kalles dopplerforskyvning (Doppler shift).
Erytrocytter fungerer som spredere av ultralydsignalet (Rayleigh-spredning). Størrelsen på dopplerforskyvningen er direkte proporsjonal med blodstrømmens hastighet. I klinisk praksis konverterer ultralydmaskinen denne frekvensforskyvningen til hastighet (m/s) og presenterer det visuelt som et spektraldiagram eller fargekodet bilde (figur 1).

Doppler-ligningen og vinkelens betydning
Forholdet mellom dopplerforskyvningen og blodets hastighet beskrives av Doppler-ligningen. Denne ligningen inkorporerer blodstrømningshastigheten (v), frekvensen til den utsendte ultralyden (fe), frekvensen til den reflekterte ultralyden (fr), ultralydhastigheten i vevet (c) og cosinus til insonasjonsvinkelen (vinkelen mellom blodstrømmens retning og ultralydstrålen, cos θ). Doppler-ligningen kan uttrykkes slik for å løse for hastighet:
v = [c × (fr – fe)] / [2 × fe × cos ϴ]
Lydens hastighet (c) i bløtvev og blod antas å være konstant (1540 m/s). Det mest kritiske elementet for operatøren er vinkelen ϴ (theta). For nøyaktig hastighetsberegning må ultralydstrålen være parallell med blodstrømmen (dvs. ϴ = 0° eller 180°). Ettersom cosinus til 0° er 1, forenkles formelen og feilkilden minimeres. Dersom vinkelen mellom strålen og blodstrømmen øker, vil den målte hastigheten underestimeres betydelig. Ved en vinkel på 20° er feilen ca. 6 %, mens ved 60° underestimeres hastigheten med 50 %. I kardiologisk ultralyd korrigeres det sjelden for vinkel; i stedet tilstreber man optimale akustiske vinduer for å oppnå parallellitet.
Klinisk nøkkelpunkt: Hastigheten og retningen til blodstrømmen beregnes ved hjelp av Doppler-ligningen. For å unngå underestimering av hastigheter (f.eks. ved aortastenose), må ultralydstrålen justeres slik at den er mest mulig parallell med blodstrømmen.
Blodstrømningsprofiler i hjerte og blodårer
Forståelse av strømningsprofiler er nødvendig for korrekte volum- og trykkberegninger. En væske som strømmer i en rett sylinder med glatte vegger ved lave hastigheter, har laminær strømning. Dette innebærer at væsken beveger seg i parallelle lag som ikke blandes. Friksjon mot karveggen gjør at hastigheten er lavest langs kanten og høyest i midten. Dette resulterer typisk i en parabolsk hastighetsprofil (figur 2A).
I hjertet, spesielt i venstre ventrikkels utløpstakt (LVOT) og i aorta ascendens, ser man ofte en flat profil («plug flow») snarere enn en ren parabolsk profil. Her beveger størstedelen av blodvolumet seg med tilnærmet samme hastighet tvers over karets diameter, kun med en smal sone av lavere hastighet langs veggene. Dette forenkler beregningen av slagvolum, da hastigheten målt i midten av karet (med pulset Doppler) er representativ for gjennomsnittshastigheten i hele tverrsnittet.
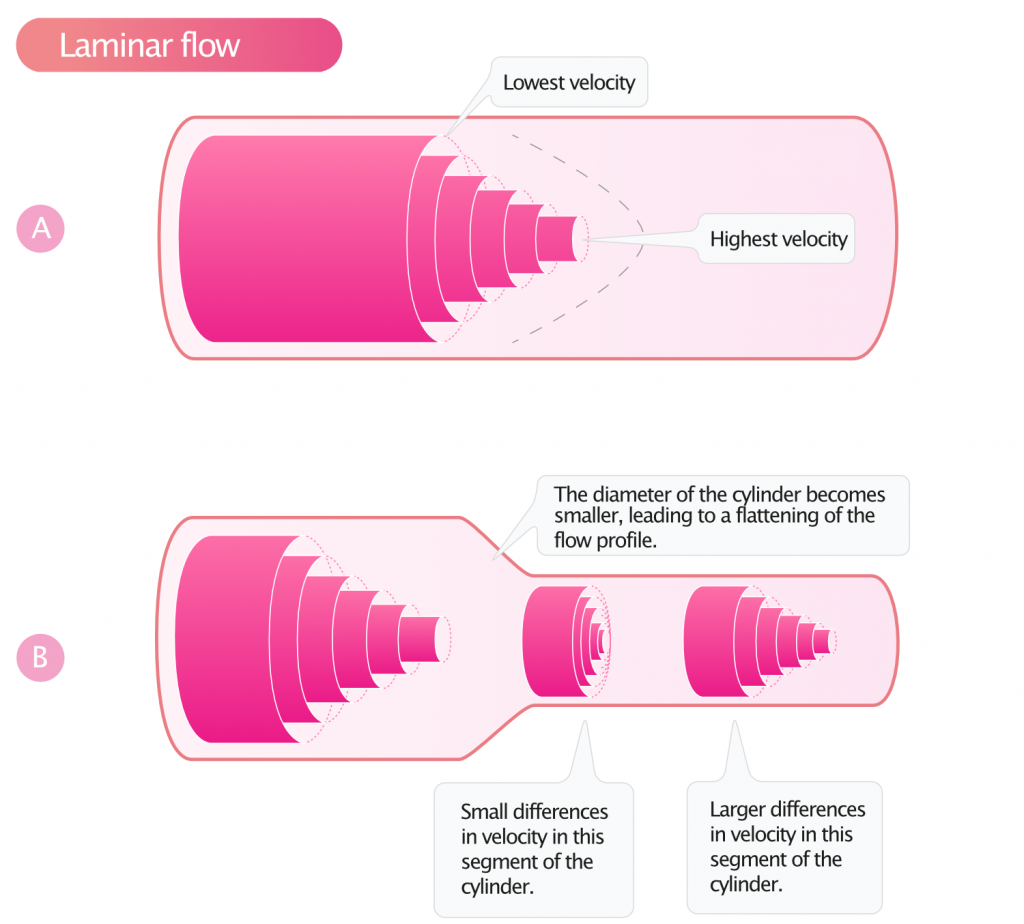
Figur 2B illustrerer hvordan strømningsprofilen endrer seg når sylinderdiameteren minker. I henhold til kontinuitetsprinsippet vil en reduksjon i tverrsnittsareal medføre en økning i hastighet for å opprettholde samme volumstrøm. Som illustrert, flates hastighetsprofilen ut når diameteren blir mindre («inlet effect»).
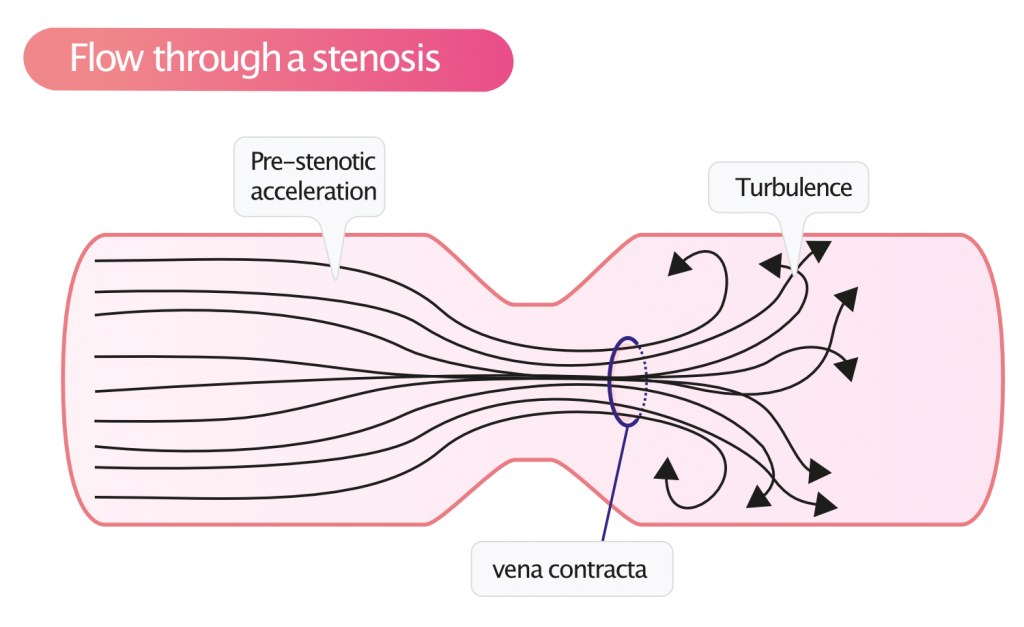
Disse prinsippene er særlig relevante ved vurdering av klaffestenoser og regurgitasjoner. En stenose (innsnevring) vil tvinge blodet til å akselerere for å opprettholde flyten («flow conservation»). Dette fenomenet danner grunnlaget for kvantifisering av stenoser. Uansett etiologi eller lokalisasjon har stenoser karakteristiske effekter på blodstrømmen:
- Pre-stenotisk akselerasjon: Hastigheten øker like før innsnevringen.
- Vena contracta: Dette er det smaleste punktet i blodstrålen («jet-en»), som oppstår like distalt for den anatomiske åpningen. Her er hastigheten høyest (maksimal hastighet, Vmax) og det effektive arealet (Effective Orifice Area, EOA) minst. Måling av bredden på vena contracta er en nyttig metode for å semikvantifisere alvorlighetsgraden av både stenoser og lekkasjer (regurgitasjoner).
- Post-stenotisk turbulens: Etter å ha passert vena contracta, utvider strålen seg i mottakerkammeret eller karet. Dette skaper virvler og kaotisk strømning, kjent som turbulens. På farge-Doppler fremstår dette som en «mosaikk» av farger (aliasing og varians), og på spektral-Doppler ses spektral breddeøkning («spectral broadening»).
Jo mer uttalt stenosen er (dvs. jo mindre åpningen er), desto større er trykkfallet over stenosen og desto høyere blir hastigheten i vena contracta.
Bernoullis ligning: Fra hastighet til trykk
For å omsette målte hastigheter til klinisk nyttige trykkgradienter, benyttes Bernoullis prinsipp. Prinsippet beskriver bevaring av energi i en strømmende væske. Når blod passerer gjennom en stenose, øker den kinetiske energien (hastigheten) på bekostning av den potensielle energien (trykket). Dette resulterer i et trykkfall over stenosen.
Den komplette Bernoulli-ligningen er kompleks og inkluderer faktorer for konvektiv akselerasjon, strømningsakselerasjon og viskøs friksjon. I klinisk kardiologi kan vi imidlertid forenkle denne betydelig fordi bidragene fra akselerasjon og viskøs friksjon er ubetydelige ved stenoser i hjertet. Den forenklede Bernoulli-ligningen er det vi bruker daglig:
ΔP = 4 × v2
Hvor ΔP er trykkgradienten (i mmHg) og v er den maksimale hastigheten over stenosen (i m/s) målt med kontinuerlig Doppler (CW). For eksempel, hvis topphastigheten over aortaklaffen måles til 4 m/s, er den maksimale trykkgradienten: 4 x 42 = 64 mmHg. Denne formelen er sentral for vurdering av alvorlighetsgrad ved aortastenose, pulmonalstenose, og for å estimere lungetrykk via trikuspidalregurgitasjon.
Trykkgjenvinning (Pressure Recovery)
Det er viktig å være klar over fenomenet trykkgjenvinning. Etter at blodet har passert vena contracta og hastigheten avtar, vil noe av den kinetiske energien omdannes tilbake til potensiell energi (trykk). Dette betyr at trykket lenger distalt i karet er noe høyere enn trykket akkurat i vena contracta. Doppler måler det maksimale trykkfallet i vena contracta, mens et kateter som plasseres distalt for stenosen vil måle gradienten etter at trykkgjenvinning har skjedd. Ved små aorta ascendens-diametre (< 30 mm) kan dette føre til at Doppler overestimerer gradienten sammenlignet med invasiv måling.
Kontinuitetsprinsippet og beregning av arealer
Kontinuitetsligningen er basert på loven om massens bevarelse: Det som strømmer inn i et rørsystem må strømme ut, forutsatt at det ikke er lekkasjer. Dette betyr at slagvolumet som passerer gjennom to ulike tverrsnitt i hjertet (f.eks. LVOT og aortaklaffen) må være likt.
Areal1 × VTI1 = Areal2 × VTI2
Hvor VTI (Velocity Time Integral) representerer slagdistansen (hvor langt en blodsøyle beveger seg per slag). Ved å omarrangere denne ligningen kan vi beregne åpningsarealet til en stenotisk klaff (Areal2), for eksempel ved aortastenose (AVA), så lenge vi kan måle de tre andre parameterne:
- Areal1: Tverrsnittsarealet av LVOT (beregnet ut fra diameter: π × r2).
- VTI1: Strømningshastigheten i LVOT (målt med pulset Doppler, PW).
- VTI2: Strømningshastigheten over aortaklaffen (målt med kontinuerlig Doppler, CW).
Kontinuitetsligningen er «gullstandarden» for arealberegning ved aortastenose og er mindre avhengig av hemodynamiske endringer (som flow-rate) enn trykkgradienter alene.