Ejeksjonsfraksjon (EF): Fysiologi, måling og klinisk evaluering
Ventrikulær ejeksjonsfraksjon (EF)
I flere tiår har ejeksjonsfraksjon (EF) vært den dominerende metoden for å vurdere venstre ventrikkels systoliske funksjon og pumpeevne. Parameteren er sentral i både diagnostikk, prognostisk vurdering og valg av behandling ved hjertesykdom. Ejeksjonsfraksjonen er konseptuelt enkel å beregne: Hvis venstre ventrikkel inneholder 100 ml blod ved slutten av diastolen (endediastolisk volum, EDV) og 40 ml pumpes ut i aorta under systolen (slagvolum, SV), er ejeksjonsfraksjonen 40 %. Ejeksjonsfraksjonen representerer altså slagvolumet (SV) uttrykt som en prosentandel av det endediastoliske volumet:
EF (%) = (SV / EDV) × 100
EF = ejeksjonsfraksjon
Siden slagvolumet (SV) er differansen mellom det endediastoliske volumet (EDV) og det endesystoliske volumet (ESV), kan EF formelt uttrykkes som:
EF (%) = [ (EDV – ESV) / EDV ] × 100
Det er viktig å merke seg at EF er en fraksjon og ikke et absolutt mål på blodmengde. En pasient kan ha normal EF, men likevel et lavt slagvolum dersom ventrikkelen er liten (small ventricle) eller ved uttalt konsentrisk hypertrofi. Motsatt kan en dilatert ventrikkel opprettholde et normalt slagvolum selv med betydelig redusert EF.
Normalverdier og klassifisering av hjertesvikt
Studier av friske personer viser at gjennomsnittlig ejeksjonsfraksjon normalt ligger mellom 63 % og 69 %, men varierer noe med alder og kjønn (kvinner har ofte noe høyere verdier enn menn). Europeiske (ESC) og amerikanske (AHA/ACC) retningslinjer definerer den nedre normalgrensen for ejeksjonsfraksjon til 50–55 %. I klinisk praksis anses ofte verdier ≥ 50 % som bevart systolisk pumpefunksjon.
Klassifisering av hjertesvikt baseres i dag primært på EF, noe som er avgjørende for valg av medikamentell behandling:
- Hjertesvikt med redusert EF (HFrEF): EF ≤ 40 %. Dette er den klassiske systoliske hjertesvikten hvor behandlingsgevinsten av nevrohormonell blokkade er best dokumentert.
- Hjertesvikt med lett redusert EF (HFmrEF): EF 41–49 %. En «gråsone» hvor pasienter ofte deler karakteristika med både HFrEF og HFpEF.
- Hjertesvikt med bevart EF (HFpEF): EF ≥ 50 %. Pasienter har symptomer på svikt og tegn på økt fylningstrykk (diastolisk dysfunksjon), men normal tømmingsfraksjon.
| Gjennomsnittlig ejeksjonsfraksjon (friske) | 63 % til 69 % |
| Normalt område (klinisk) | ≥ 50-55 % |
| Lett redusert (Mildly Reduced) | 41-49 % |
| Redusert (Reduced) | ≤ 40 % |
Ejeksjonsfraksjon undersøkes rutinemessig i hvile. Dette avslører ikke venstre ventrikkels funksjonelle reservekapasitet. For å avdekke latent svikt kan det være nødvendig å måle ejeksjonsfraksjonen under belastning, for eksempel ved en stressekkokardiografi (arbeidstest eller dobutamin). Ejeksjonsfraksjonsreserve er differansen mellom hvile-EF og den EF som genereres under maksimal belastning. Manglende økning i EF under belastning er et tidlig tegn på myokard dysfunksjon.
Effekten av for- og etterbelastning på ejeksjonsfraksjon
EF er ikke et direkte mål på kontraktilitet (myokards iboende evne til sammentrekning), men et mål på kammerfunksjon som er sterkt avhengig av hemodynamiske forhold, spesielt for- og etterbelastning.
- Preload (forspenning): En økning i preload (f.eks. ved økt venøs retur i supin stilling eller ved væskeinfusjon) vil via Frank-Starling-mekanismen øke slagvolumet og dermed ofte øke EF.
- Afterload (etterbelastning): En økning i afterload (f.eks. ved hypertensiv krise eller aortastenose) vil redusere tømmingen av ventrikkelen og føre til lavere EF, selv om kontraktiliteten er uendret.
Dette har store kliniske implikasjoner. Ved for eksempel alvorlig mitralinsuffisiens vil en stor del av blodet regurgitere til venstre atrium (lavtrykkssystem), noe som reduserer den totale etterbelastningen ventrikkelen arbeider mot. Dette fører til en «kunstig» forhøyet EF. En EF på 55 % kan i denne settingen representere betydelig myokardskade, og kirurgi bør ofte vurderes før EF faller under normalområdet. Motsatt kan en pasient med ukontrollert hypertensjon presentere med lav EF som normaliseres når blodtrykket (afterload) senkes.
Ideelt sett bør ejeksjonsfraksjonen vurderes under pasientens «normale» belastningsforhold. Ved varierende målinger over tid bør man alltid sjekke blodtrykket ved undersøkelsestidspunktet for å vurdere om endringen skyldes endret afterload («afterload mismatch») eller reell endring i kontraktilitet.
Ejeksjonsfraksjon og venstre ventrikkels volum
Forholdet mellom ventrikkelstørrelse og EF er essensielt for å forstå hjertets hemodynamikk. Idrettsutøvere har ofte store ventrikkeldimensjoner (eksentrisk remodellering) og kan ha en EF i nedre normalområde (f.eks. 50-52 %) i hvile. Dette er fysiologisk; det store endediastoliske volumet sørger for at slagvolumet blir stort nok til å dekke kroppens behov selv med en lavere tømmingsfraksjon.
Motsatt ser man ved konsentrisk hypertrofi (små ventrikkelvolumer med tykke vegger) at EF ofte er høy (65-75 %). Her må tømmingsfraksjonen være høy for å opprettholde et normalt slagvolum når EDV er lite. Hvis en pasient med uttalt hypertrofi får en EF på «normale» 50 %, indikerer dette faktisk en betydelig reduksjon i systolisk funksjon («paradoksalt normal» EF).
Betydningen av ventrikkelstørrelse blir spesielt tydelig ved hypertrofisk kardiomyopati (HCM/HOCM). Personer med HCM kan ha normal eller supranormal ejeksjonsfraksjon (>70 %), til tross for manifest hjertesvikt. Patologien her er ofte redusert fylning (lite EDV) og diastolisk svikt, snarere enn manglende tømmingsevne. Derfor er EF en dårlig markør for sykdomsgrad ved HCM.
Nedsatt ejeksjonsfraksjon
En rekke tilstander kan føre til redusert ejeksjonsfraksjon. Kardiomyopati (dilatert, iskemisk, toksisk), hjerteklaffsykdom, ukontrollert diabetes, langvarig hypertensjon, arytmier (f.eks. tachykardi-indusert kardiomyopati) og iskemisk hjertesykdom er blant de vanligste årsakene.
AORTAINSUFFISIENS (REGURGITASJON) – Ved lekkasje i aortaklaffen strømmer blod tilbake til venstre ventrikkel i diastolen. Dette gir en volumoverbelastning. Ventrikkelen kompenserer ved å dilatere (øke EDV) for å opprettholde systemisk slagvolum iht. Frank-Starlings lov. I den kompenserte fasen er EF normal eller lett forhøyet pga. det store totale slagvolumet. Over tid fører veggspenningen til remodellering og fibrose. Når ventrikkelen ikke lenger klarer å kompensere, faller EF. På dette stadiet er myokardskaden ofte irreversibel.
KORONARSJKDOM – Ved koronarsykdom kan redusert EF skyldes to hovedmekanismer: 1) Irreversibel skade (arrvev) etter hjerteinfarkt, eller 2) «Stunned» eller «hibernating» myokard, hvor vevet er levende men funksjonelt nedsatt pga. akutt eller kronisk iskemi. Sistnevnte kan potensielt reverseres ved revaskularisering (PCI/CABG).
Nevrohormonell aktivering ved hjertesvikt med redusert ejeksjonsfraksjon
Når EF faller og hjerteminuttvolumet reduseres, aktiveres kroppens kompensasjonsmekanismer for å opprettholde blodtrykk og organperfusjon. Høytrykksbaroseptorer i aortabuen, sinus caroticus og venstre ventrikkel registrerer fallet i trykk/volum og signaliserer til vasomotorsenteret i hjernestammen. Dette utløser en kaskade av responser (Figur 2).
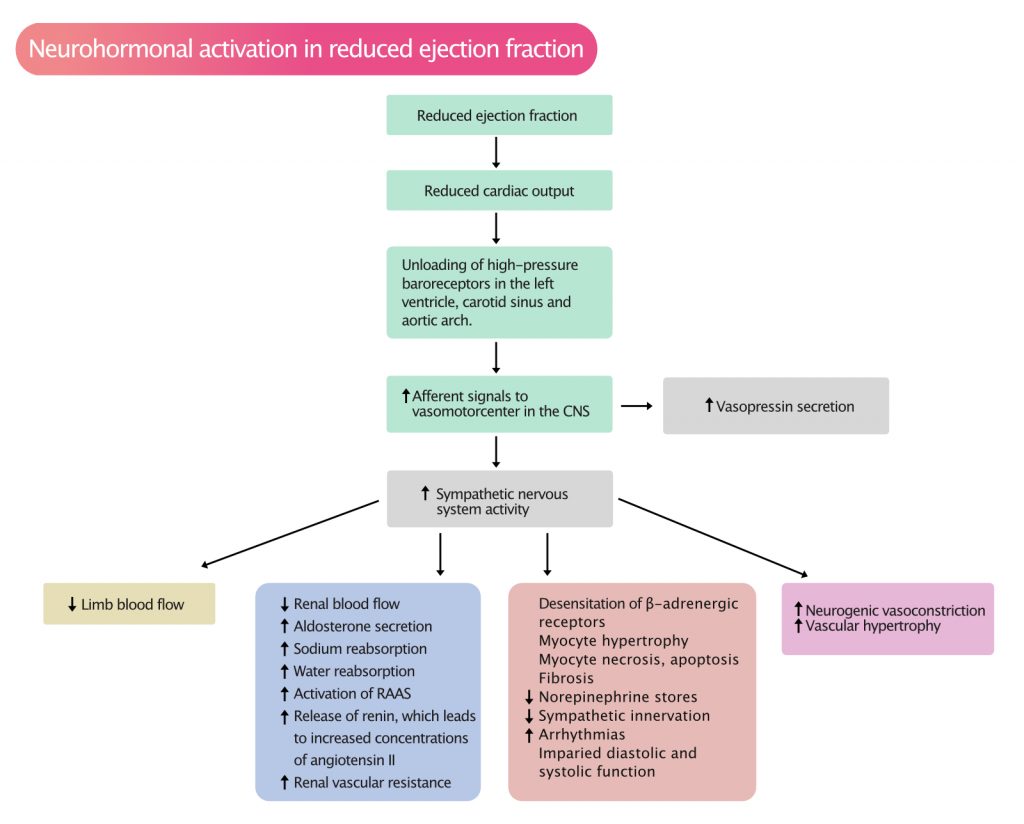
De sentrale nevrohormonelle systemene inkluderer:
- Det sympatiske nervesystemet (SNS): Økt noradrenalin gir økt hjertefrekvens og kontraktilitet (positiv inotropi). Dette er gunstig akutt, men kronisk aktivering er kardiotoksisk og fører til beta-reseptor nedregulering, arytmier og celledød (apoptose). Betablokkere motvirker denne prosessen.
- Renin-Angiotensin-Aldosteron-Systemet (RAAS): Redusert nyreperfusjon stimulerer reninfrigjøring. Dette fører til dannelse av Angiotensin II (kraftig vasokonstriksjon) og Aldosteron (salt- og vannretensjon). Resultatet er økt blodvolum (preload) og økt karmotstand (afterload), som ytterligere belaster et sviktende hjerte. ACE-hemmere, ARB og aldosteronantagonister (MRA) er hjørnesteiner i behandlingen for å bryte denne sirkelen.
- Natriuretiske peptider (NP-systemet): Som respons på veggstrekk skiller hjertet ut ANP og BNP. Disse virker vasodilaterende og vanndrivende, og fungerer som kroppens «naturlige brems» mot RAAS og SNS. Ved kronisk svikt er imidlertid denne motvekten utilstrekkelig. Moderne behandling med ARNI (Sacubitril/Valsartan) styrker dette systemet ved å hindre nedbrytningen av natriuretiske peptider.
Visuell estimering av ejeksjonsfraksjon
Ejeksjonsfraksjon kan estimeres visuelt («eyeballing»). Klinikeren vurderer summen av veggbevegelse og veggfortykkelse i alle segmenter fra flere projeksjoner. Selv om metoden er subjektiv, viser studier (Gudmundsson et al.) at visuell estimering utført av erfarne kardiologer korrelerer godt med kvantitative metoder. Det er imidlertid betydelig inter-observatør variasjon, og metoden er mindre egnet for å oppdage små endringer over tid (f.eks. ved monitorering av kardiotoksisitet ved kjemoterapi).
Beregning av ejeksjonsfraksjon med kvantitative metoder
Objektiv måling er gullstandarden. Tidligere ble M-mode (Teichholz metode) mye brukt. Denne baserer seg på en enkelt dimensjon i ventrikkelen og antar en normal geometrisk form (prolert ellipsoide). Ved infarkt (regional veggbevegelsesforstyrrelse) eller endret ventrikkelgeometri (f.eks. kuleformet ventrikkel ved dilatert kardiomyopati) gir M-mode feilaktige resultater og bør unngås. I dag er 2D- og 3D-ekkokardiografi de foretrukne metodene.
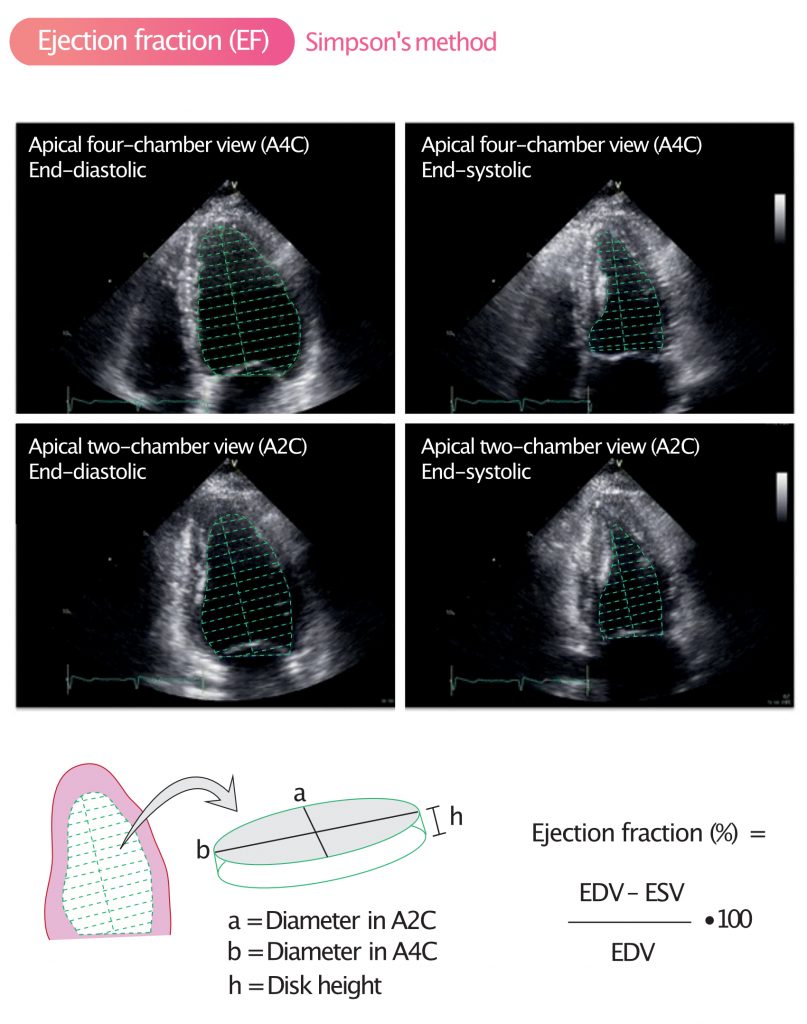
Simpsons biplanmetode (2D)
Dette er den nåværende standardmetoden for 2D-ekko. Metoden kalles også «skivemetoden» (method of disks). Prinsippet er at ventrikkelvolumet beregnes ved å summere opp en stabel av tynne, sylindriske skiver fra basis til apeks.
For å utføre en korrekt Simpsons biplan måling:
- Bilder tas i apikalt firekammer- (A4C) og tokammersnitt (A2C).
- Man tracer (tegner opp) overgangen mellom blod og endokard (interface) i slutten av diastolen og slutten av systolen.
- Papillemuskler skal inkluderes i ventrikkelvolumet (dvs. tracet legges på innsiden av disse).
- Lengden av ventrikkelen må være lik i begge plan for presis beregning.
EF (%) = [ (EDV – ESV) / EDV ] × 100
3D Ekkokardiografi
Moderne ultralydapparater tilbyr 3D-ekkokardiografi, som i økende grad anbefales av retningslinjene når bildekvaliteten tillater det. 3D-metoden er mer nøyaktig enn 2D Simpsons fordi den ikke baserer seg på geometriske antakelser og unngår feilkilder knyttet til avskjæring av planet (foreshortening). Volummålinger med 3D-ekko korrelerer bedre med MR, som regnes som «gullstandarden» for volummåling.
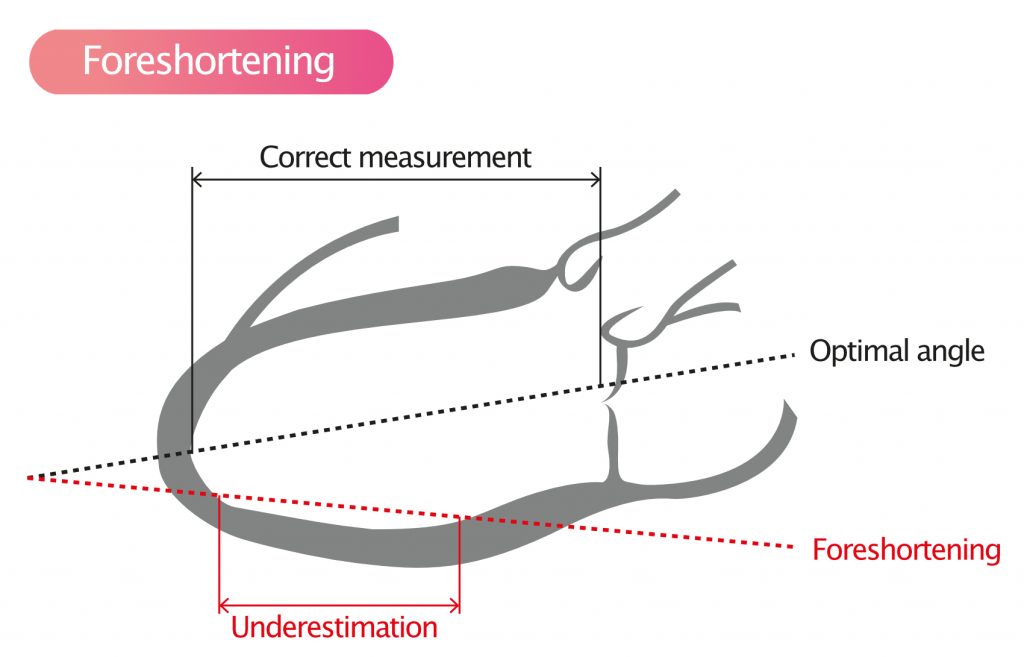
Feilkilder: Forkortning og bildekvalitet
Nøyaktigheten av EF-målinger står og faller på bildekvaliteten. En klassisk feilkilde ved apikale opptak er foreshortening (avskjæring av apeks). Dette skjer når proben plasseres for høyt på brystveggen («en ribbe for høyt»), slik at ultralydplanet ikke skjærer gjennom den sanne apeks (spissen av hjertet).
Konsekvensen er at man måler et tverrsnitt av ventrikkelen som er mindre enn den reelle lengdeaksen. Dette fører til en systematisk underestimering av ventrikkelvolumene (både EDV og ESV). Effekten på selve EF kan variere, men ofte overestimeres EF noe fordi de basale segmentene (som beveger seg mest) vektlegges relativt mer.
Bruk av ultralydkontrast (LVO): Dersom endokardgrensene ikke kan visualiseres tilfredsstillende i minst to segmenter, anbefales bruk av ultralydkontrast (Left Ventricular Opacification, LVO). Kontrastvæsken fyller venstre ventrikkel og gir en skarp avgrensning mellom blodvolum og myokard, noe som øker presisjonen av EF-målingen betydelig og reduserer inter-observatør variasjon.
Begrensninger ved EF og moderne parametere (GLS)
Selv om EF er «arbeidshesten» i kardiologien, har parameteren klare begrensninger. EF reduseres ofte sent i sykdomsforløpet. Ventrikkelen kan opprettholde normal tømming ved hjelp av kompensatorisk hypertrofi til tross for betydelig sykdom i muskelfibrene.
Global Longitudinal Strain (GLS) er en mer sensitiv metode som måler den langsgående deformasjonen (forkortningen) av myokardfibrene. Normal GLS er typisk mer negativ enn -20 %. Redusert GLS (f.eks. -15 %) kan avdekke subklinisk dysfunksjon lenge før EF faller, noe som er spesielt verdifullt ved kjemoterapi-indusert hjertesvikt, amyloidose, aortastenose og HFpEF. GLS er mindre avhengig av vinkelfeil, men krever god bildekvalitet.
Referanser
Lang RM et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015 Jan;28(1):1-39.e14.
Hartupee et al (2017): Nevrohormonell aktivering ved hjertesvikt med redusert ejeksjonsfraksjon. Nature Reviews Cardiology (2017).
Gudmundsson et al: Visuelt estimert venstre ventrikkels ejeksjonsfraksjon ved ekkokardiografi er nært korrelert med formelle kvantitative metoder (2005).