Tøyning, tøyningshastighet og speckle tracking: Myokardial deformasjon
Myokarddeformasjon: deformasjon, deformasjonshastighet og speckle tracking
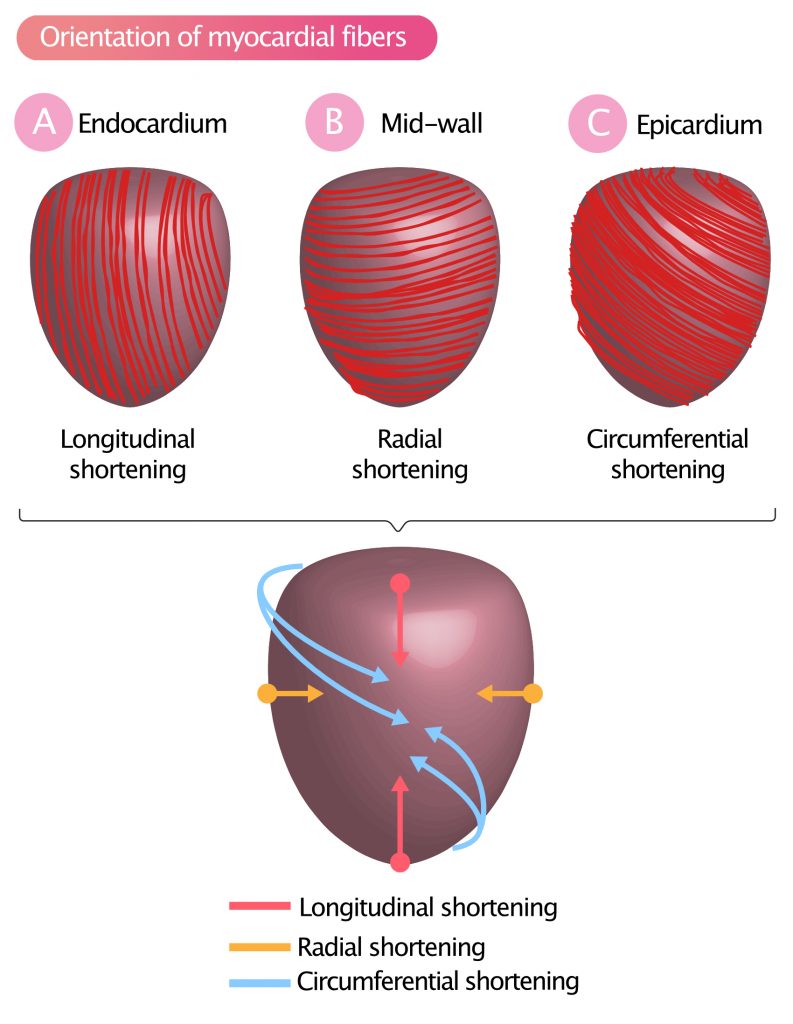
Som tidligere omtalt er venstre ventrikkelvegg en kompleks struktur som kan deles inn i tre funksjonelle lag: den indre foringen (endokard), et tykt muskellag (myokard) og en ytre foring (epikard). Myokardiet utgjør selve muskelmassen, der muskelfibrene er organisert i en intrikat, heliksformet arkitektur som endrer orientering gjennom veggtykkelsen. Fibrene vikler seg rundt hjertekammeret med ulik angulering, noe som muliggjør at venstre hjertekammer kan trekke seg sammen på en svært sofistikert og energieffektiv måte (figur 1). Denne arkitekturen er avgjørende for generering av det intraventrikulære trykket og slagvolumet.
Myokardfibrene som grenser til endokardiet (subendokardiale fibre), er orientert i en høyresidig heliks (nærmest longitudinelt) fra basis til apex. Disse fibrene står primært for den longitudinelle forkortningen (figur 1A), en bevegelse der basis trekkes ned mot apex, mens apex holder seg relativt stasjonært. Dette er den mest følsomme komponenten av ventrikkelfunksjonen og rammes ofte tidlig ved patologi.
Myokardfibrene i det midtre laget (midtveggen) er orientert sirkulært rundt kortaksen (circumferensielt). Sammentrekning i dette laget resulterer i en betydelig radial forkortning og veggtykkelseøkning, noe som betyr at diameteren på ventrikkelhulen minker og veggen blir tykkere innover mot hulrommet (figur 1B). Dette bidrar vesentlig til ejeksjonen.
Muskelfibrene som ligger inntil epikardiet (subepikardiale fibre), er orientert i en venstresidig heliks, ca. 60° i forhold til fibrene i midtveggen og nesten vinkelrett på de subendokardiale fibrene. Kontraksjon i dette laget resulterer, i samspill med de indre lagene, i en vridende (roterende) bevegelse av hele venstre ventrikkel – en bevegelse som kan sammenlignes med å vri opp en våt klut. Basalsegmentene roterer med klokken, mens apex roterer mot klokken. Denne torsjonen kalles sirkumferensiell forkortelse og rotasjon (figur 1C), og er avgjørende for en effektiv tømming under systolen samt for «sugeeffekten» (diastolisk recoil) under tidlig diastole.
Venstre ventrikkels totale pumpefunksjon er dermed avhengig av et komplekst mekanisk samspill mellom muskelfibrene i disse lagene. Tap av funksjon i ett lag, for eksempel ved subendokardiell iskemi, kan delvis kompenseres av de andre lagene, men vil endre deformasjonsmønsteret.
Tradisjonelle metoder for å undersøke venstre ventrikkels funksjon – f.eks. ejeksjonsfraksjon (LVEF), fraksjonell forkortning (FS) og slagvolum – er nyttige, men har begrensninger. De belyser ikke regionale variasjoner i kontraktil funksjon eller effektiviteten av de enkelte deformasjonskomponentene (longitudinell, radial og sirkumferensiell). Videre er EF svært lastavhengig (påvirkes av preload og afterload) og har lav sensitivitet for tidlig, subklinisk hjertesykdom. Metoder som ejeksjonsfraksjon kan derfor gi lett tilgjengelige parametere, men gir ofte ikke tilstrekkelig innsikt i venstre ventrikkels mekanikk, spesielt ved bevart EF (HFpEF).
Regionale forskjeller i kontraktil funksjon er av største kliniske betydning, særlig i utredning av myokardiskemi. Iskemisk kaskade tilsier at perfusjonsforstyrrelser fører til endret deformasjon før man ser endringer i EF eller EKG. Som et tydelig eksempel kan man tenke seg en pasient med iskemisk hjertesykdom som har normal ejeksjonsfraksjon, men nedsatt kontraktil funksjon i den nedre veggen. Dette funnet kalles inferior veggbevegelsesavvik (hypokinesi), og det kan være tegn på signifikant koronarsykdom eller gjennomgått hjerteinfarkt. Oppdagelsen av slike regionale utfall vil ha direkte konsekvenser for revaskularisering og medikamentell behandling, uavhengig av den globale ejeksjonsfraksjonen. Derfor er det viktig å bruke metoder som presist kan oppdage og karakterisere unormale veggbevegelser.
Det er utviklet avanserte metoder for kvantifisering av regional og global myokardfunksjon som går utover visuell vurdering («eyeballing»). Disse metodene analyserer bevegelse (hastighet) og deformasjon (endring i form/strain) av myokardiet gjennom hele hjertesyklusen. Deformasjonsavbildning, spesielt speckle tracking echocardiography (STE), har blitt implementert i klinisk praksis og anbefales nå i internasjonale retningslinjer (ESC/ASE) for en rekke tilstander, inkludert kardio-onkologi og klaffesykdommer. Dette kapittelet tar for seg de teoretiske og praktiske aspektene ved deformasjon (strain), deformasjonshastighet (strain rate) og myokardbevegelse.
Myokardbevegelse og Vevsdoppler (TDI)
Myokardbevegelse refererer til forflytningen av myokardvevet fra ett punkt til et annet i rommet. Under bevegelsen har alt myokard innenfor et lite, definert område (region of interest) tilnærmet samme hastighet. Bevegelsen karakteriseres av variabler som forflytning (displacement) og hastighet (velocity).
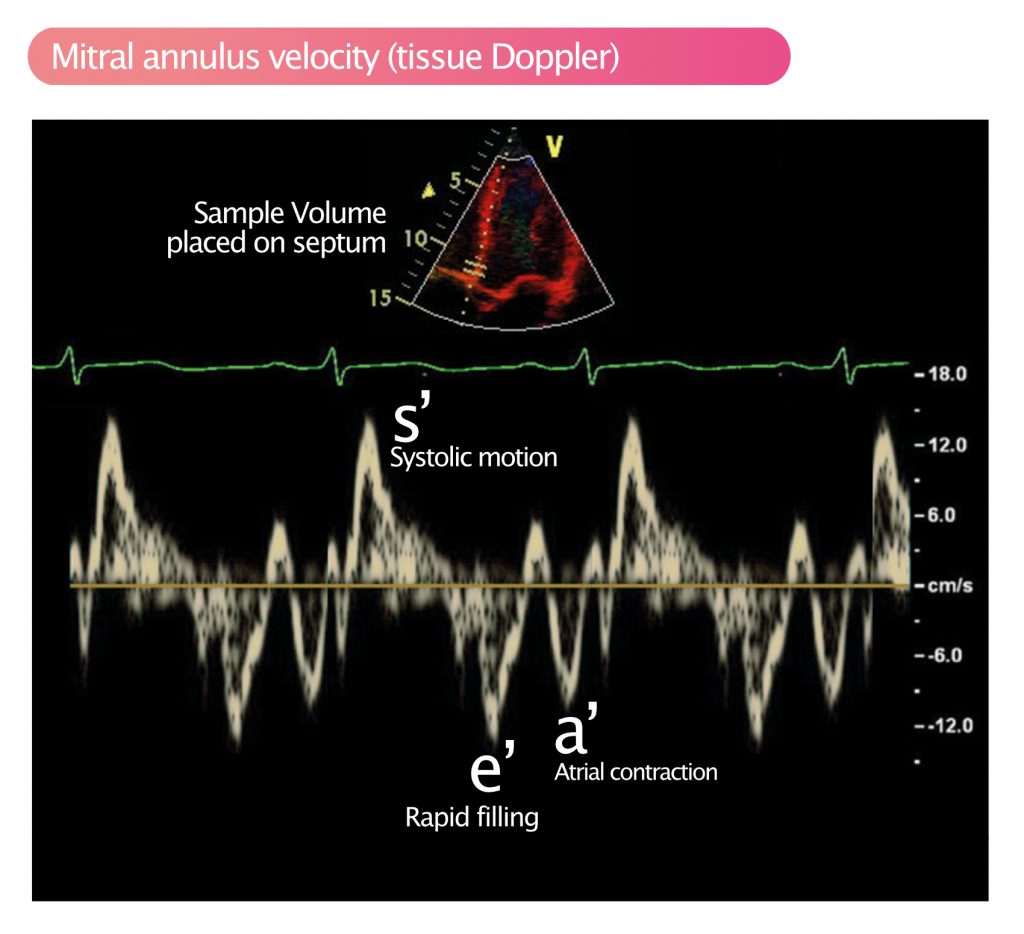
Myokardbevegelse og -hastighet måles tradisjonelt med vevsdoppler (Tissue Doppler Imaging, TDI) (se Pulsbølgedoppler). Vevsdoppler filtrerer bort signaler fra blodstrøm (høy hastighet, lav amplitude) og fokuserer på vevssignaler (lav hastighet, høy amplitude). Dette gjør det mulig å ta prøver av spesifikke regioner. Rutinemessig gjøres dette for å måle hastigheten til mitralklaffens annulus, som under systolen beveger seg mot apex (longitudinell kontraksjon) og deretter rekylerer tilbake til utgangsposisjonen i diastolen. Mitralringens hastighet (s’, e’, a’) er et robust mål på henholdsvis systolisk og diastolisk funksjon. Under systolen beveger basen seg mot apex, og maksimal systolisk hastighet (s’) korrelerer med global systolisk funksjon. Figur 2 viser måling av mitralringens hastighet med pulserende vevsdoppler.
Vevsdoppler i farger (Color TDI) kan også brukes til å studere regionale hastigheter over hele bildet samtidig. Fordelen er at man kan studere større områder av myokard og deretter post-prosessere data for å hente ut hastigheter, strain og strain rate. Dette går imidlertid ofte på bekostning av noe lavere tidsoppløsning (frame rate) sammenlignet med spektral (pulsed wave) vevsdoppler.
Begrensninger ved bruk av bevegelse (Tissue Velocity)
Den største ulempen med å bruke ren vevshastighet eller bevegelse som et mål på regional kontraktil funksjon, er fenomenet tethering (drag). Siden myokardiet er en sammenhengende struktur, påvirkes bevegelsen i ett segment direkte av bevegelsen i tilstøtende segmenter. Dette betyr at et ikke-fungerende, nekrotisk myokardsegment (f.eks. et arr etter hjerteinfarkt) fortsatt kan vise bevegelse kurver fordi det blir dratt med av friskt, kontraherende vev i nabosegmentene. Det døde vevet beveger seg passivt, men trekker seg ikke aktivt sammen.
Det følger av dette at måling av hastighet/bevegelse i et enkelt punkt kan være misvisende («maskert dysfunksjon»). Løsningen er å bruke deformasjon (strain) som et mål på funksjon. Begrunnelsen for å måle deformasjon er at dødt eller iskemisk myokard ikke vil deformeres (endre form/forkortes) normalt under systolen, uavhengig av om det passivt beveges av omgivelsene. Måling av deformasjon isolerer dermed den aktive kontraktiliteten i vevet.
Strain og Strain Rate: Fysiologi og definisjoner
Strain (tøyning) defineres som den fraksjonelle endringen i lengde av et myokardsegment i forhold til utgangslengden. I kardiologisk sammenheng innebærer dette forkortelse (negativ strain) eller forlengelse (positiv strain). Hovedformålet er å kvantifisere regional og global funksjon ved å måle graden av deformasjon (strain) og hastigheten deformasjonen skjer med (strain rate).
I et normalt hjerte bør strain og strain rate være relativt homogene i hele venstre ventrikkel, da synkron kontraksjon er nødvendig for effektiv pumping. Patologiske prosesser som iskemi, fibrose eller ledningsforstyrrelser (grenblokk) skaper heterogenitet (dyssynkroni) og redusert deformasjon.
Strain: Graden av deformasjon
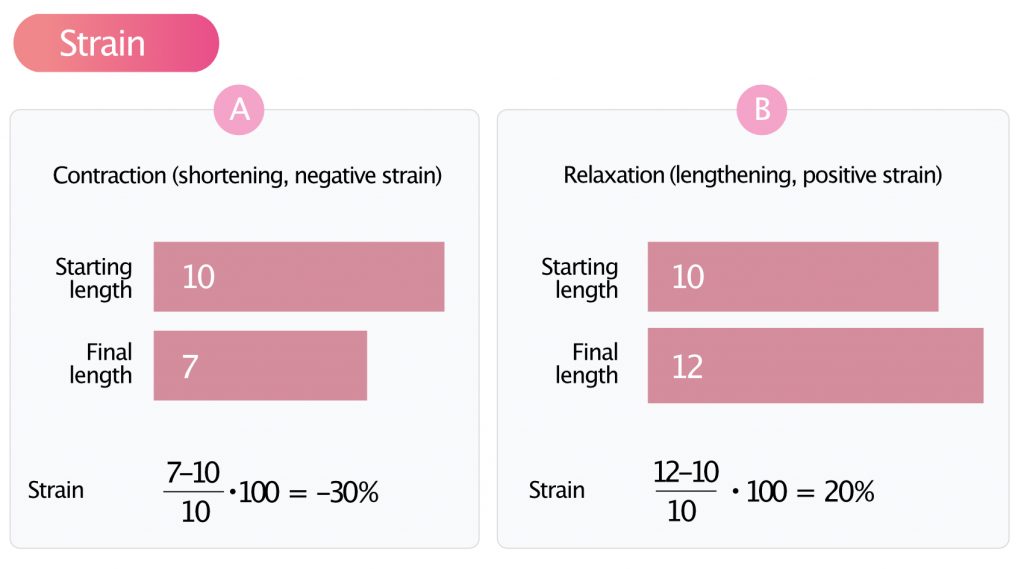
Strain er en dimensjonsløs størrelse som oftest uttrykkes i prosent (%). Den representerer den relative lengdeendringen fra den telediastoliske tilstanden (starten av syklus). Formelen for Lagrangisk strain er:
Strain (ε) = (L – L0) / L0 × 100%
L0 = opprinnelig myokardlengde (ved QRS-start); L = endelig lengde (ved endesystole).
Hvis den opprinnelige lengden på et myokardsegment er 10 mm og den endelige lengden ved endesystole er 12 mm (forlengelse/stretching), vil strain være +20 %. Hvis segmentet derimot trekker seg sammen til 7 mm, vil strain være -30 %. Siden myokardiet normalt trekker seg sammen i lengderetningen under systolen, angis longitudinell strain som negative verdier (f.eks. -20 %). Jo mer negativ verdien er (f.eks. -25 % vs -15 %), desto bedre er funksjonen. (NB: I klinisk dagligtale sier man ofte at «strain er redusert» når verdien er mindre negativ, f.eks. endret fra -20 % til -10 %, selv om tallet matematisk sett er større).
Strain kan måles i tre hovedretninger som korresponderer til myokardfibrenes orientering:
- Longitudinell strain: Forkortning langs hjerteaksen (base-til-apex). Normalt negativ verdi (ca. -18% til -22%).
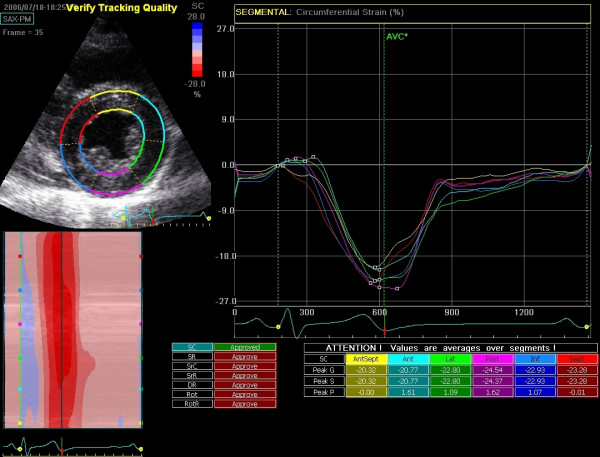
- Sirkumferensiell strain: Forkortning langs omkretsen i kortaksen. Normalt negativ verdi.
- Radial strain: Fortykkelse av veggen inn mot sentrum. Normalt positiv verdi (ettersom veggen blir tykkere).
Strain rate: Deformasjonshastigheten
Strain rate (SR) er den tidsderiverte av strain, altså hvor raskt deformasjonen skjer per tidsenhet. Enheten er invers sekund (1/s eller s-1). Mens strain sier noe om hvor mye hjertet trekker seg sammen (analogt med slagvolum), sier strain rate noe om hvor raskt det skjer (analogt med kontraktilitet/dP/dt).
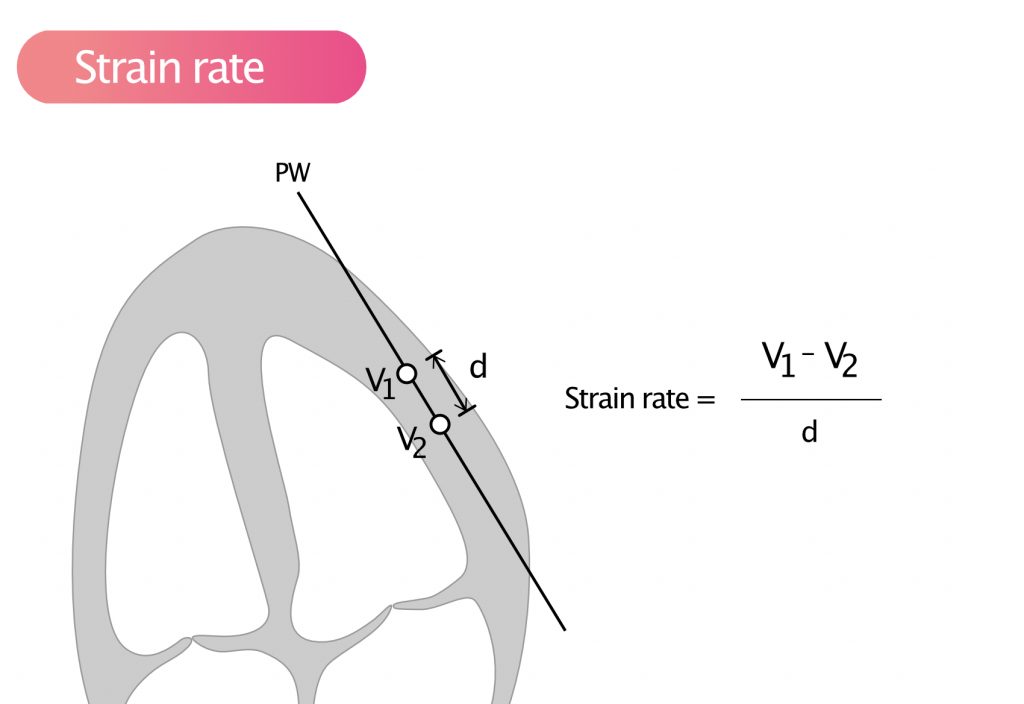
Strain Rate (SR) = (V1 – V2) / d
Basert på Doppler-prinsippet kan strain rate beregnes ved å måle hastighetsforskjellen (hastighetsgradienten) mellom to punkter (V1 og V2) med en kjent avstand (d) imellom (Figur 4). Hvis to punkter beveger seg med nøyaktig samme hastighet, er det ingen deformasjon mellom dem (SR = 0). Hvis punktet nærmest apex beveger seg saktere enn punktet nærmest basen, skjer det en forkortning (negativ SR).
Strain rate er mindre lastavhengig enn strain og EF, og er derfor en god indikator på myokardets iboende kontraktilitet. Ulempen er at signalet ofte inneholder mer støy (signal-til-støy-forholdet er lavere), noe som kan gjøre de kliniske målingene utfordrende.
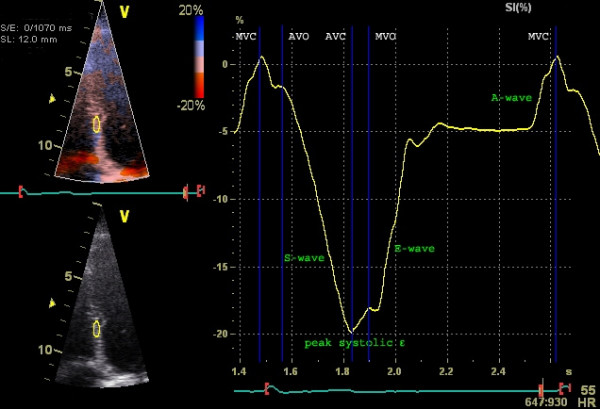
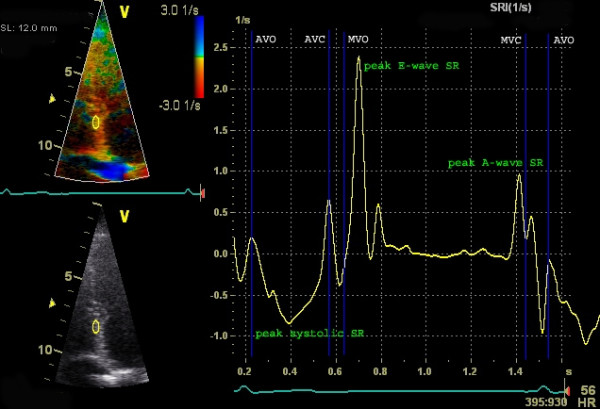
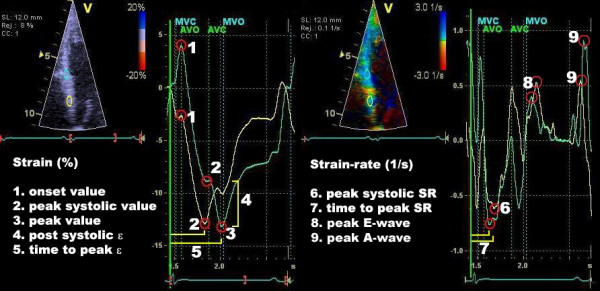
Tidligere ble vevsdoppler (TDI) brukt til å beregne strain. For å gjøre dette kreves en høy bildefrekvens (frame rate) på >100 FPS (gjerne opp mot 140-180 FPS). Fordelen med TDI-strain er den svært høye tidsoppløsningen. Ulempen er, som ved all Doppler-teknikk, at den er vinkelavhengig. Hvis ultralydstrålen ikke er parallell med bevegelsesretningen, underestimeres verdiene. Dessuten analyserer TDI kun ett segment om gangen, og radial/sirkumferensiell strain er vanskelig å måle nøyaktig. Disse begrensningene har ført til at speckle tracking i dag er den dominerende metoden for strain-måling i klinikken.
Speckle Tracking Echocardiography (STE)
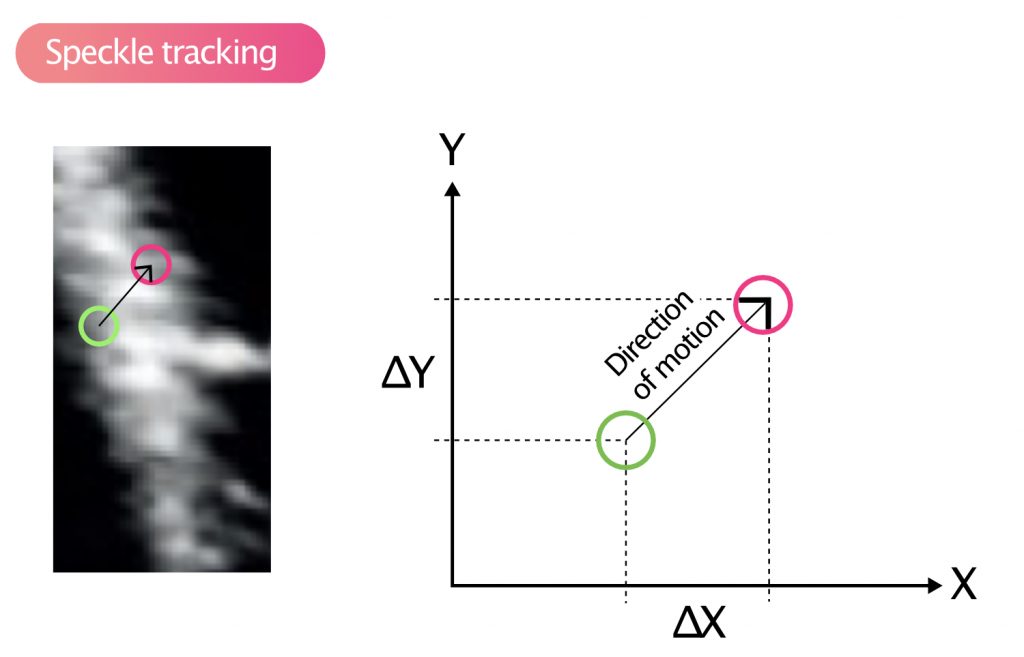
Speckles (noen ganger kalt akustiske markører) er betegnelsen på de gråtone-mønstrene som myokardvevet danner på et 2D-ultralydbilde. Myokardiet er ikke homogent; det består av proteiner, fibre og cellestrukturer som sprer ultralydbølgene. Dette skaper et unikt «fingeravtrykk» av lysere og mørkere punkter (speckles) som holder seg relativt stabilt gjennom hjertesyklusen (Figur 8).
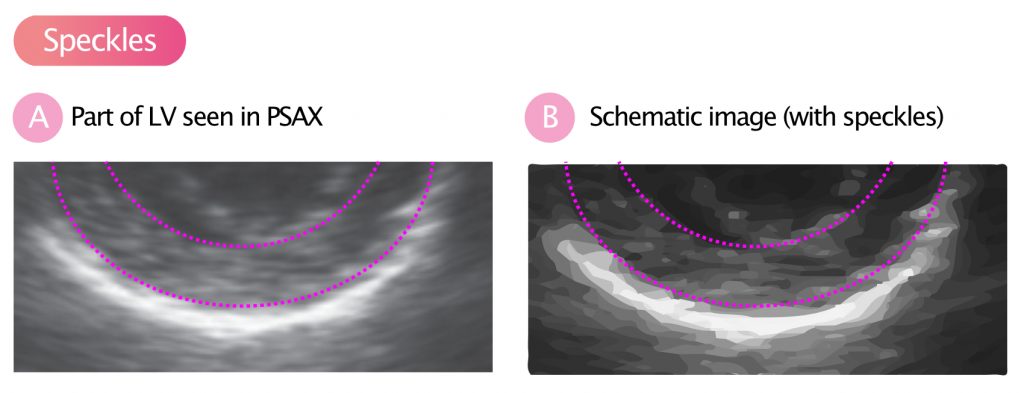
Prinsippet bak Speckle Tracking
Programvaren i ultralydmaskinen identifiserer disse mønstrene («kernels») og sporer (tracker) deres bevegelse fra bilde til bilde gjennom hele hjertesyklusen. Ved å vite bildefrekvensen og forflytningen, kan maskinen beregne hastighet, og ved å se på avstandsforholdet mellom flekkene, beregnes strain (Figur 9).
Strain = (L1 – L0) / L0
Fordeler med Speckle Tracking:
Metoden er vinkeluavhengig. Siden den sporer mønstre i et 2D-bilde, er man ikke avhengig av at ultralydstrålen treffer parallelt med bevegelsen. Dette gjør at man kan måle strain i alle segmenter (også apex) og i alle retninger (longitudinelt, radialt, sirkumferensielt).
Ulemper og tekniske krav:
Speckle tracking krever god bildekvalitet. Hvis bildet er «støyete» eller har dårlige grenser mot endokard, vil trackingen feile («poor tracking»). Metoden har også lavere tidsoppløsning enn vevsdoppler. Optimal bildefrekvens (frame rate) for speckle tracking er typisk mellom 40 og 80-90 FPS. For lav frame rate gir tap av informasjon mellom bildene (aliasing), mens for høy frame rate gir dårligere romlig oppløsning. Ved betydelig takykardi kan presisjonen reduseres.
Global og regional strain i klinikken
Moderne ultralydsystemer presenterer resultatene som både regionale kurver og en global verdi. Den vanligste visningen er det såkalte «Bullseye»-plottet (polart kart), som viser strain-verdiene for alle 17 segmenter i venstre ventrikkel i ett diagram.
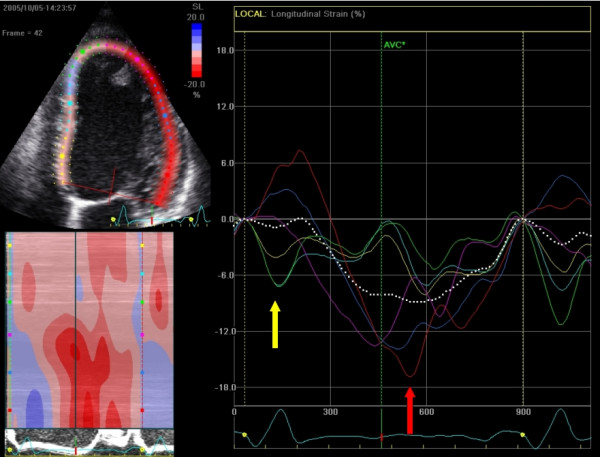
Global Longitudinell Strain (GLS)
Den viktigste parameteren i dagens kliniske praksis er Global Longitudinell Strain (GLS). GLS beregnes som gjennomsnittet av strain i alle segmenter fra de tre apikale snittene (AP4CH, AP2CH, AP3CH). Den longitudinelle deformasjonen er primært styrt av de subendokardiale fibrene, som er mest sårbare for iskemi, fibrose og toksisitet.
Normalverdier og klinisk nytte av GLS
GLS er en mer robust og reproduserbar markør for systolisk funksjon enn LVEF. Mens EF primært reflekterer volumendring (som også påvirkes av radiell funksjon), reflekterer GLS myokardfibrenes faktiske forkortning.
- Normalverdier: En normal GLS ligger typisk rundt -20 % (i området -18 % til -23 %, avhengig av leverandør/vendor). Verdier som er «mindre negative» (f.eks. -15 %) indikerer nedsatt funksjon.
- Kardio-onkologi: GLS er gullstandarden for overvåking av pasienter som får kardiotoksisk kjemoterapi (f.eks. antrasyklin). Et fall i GLS på >15 % fra utgangspunktet er en tidlig markør for hjerteskade, ofte lenge før EF faller.
- Klaffesykdom: Ved aortastenose og mitralinsuffisiens kan EF holdes kunstig oppe til tross for myokardskade. Nedsatt GLS er en sterk prognostisk markør og kan indikere behov for kirurgi før symptomdebut.
- Amyloidose: Ved hjerteamyleidose ser man et karakteristisk mønster med «apical sparing» (bevart strain i apex, men sterkt nedsatt i basale segmenter), noe som gir et «cherry-on-top»-utseende på Bullseye-plottet.
Oppsummert gir analyse av myokarddeformasjon, og særlig speckle tracking-avledet GLS, en dypere og mer presis innsikt i hjertets mekanikk enn konvensjonelle metoder. Det muliggjør tidlig diagnostikk og bedre prognostisk vurdering ved et bredt spekter av hjertesykdommer.